过表达GBA诱导SH-SY5Y细胞自噬和降低α-synuclein的表达
2014-11-27范成河王雪晶楚广磊马耀华滕军放
范成河,王雪晶,楚广磊,马耀华,荆 婧,滕军放
(郑州大学 第一附属医院 神经内科, 河南 郑州 450052)
过表达GBA诱导SH-SY5Y细胞自噬和降低α-synuclein的表达
范成河,王雪晶,楚广磊,马耀华,荆 婧,滕军放*
(郑州大学 第一附属医院 神经内科, 河南 郑州 450052)
目的探讨葡萄糖脑苷脂酶(GBA)对SH-SY5Y细胞自噬及α-突触核蛋白(α-synuclein)表达水平的影响。方法将EGFP-N1、EGFP-GBA质粒转染SH-SY5Y细胞,Western blot检测Beclin 1、LC3-Ⅱ/LC3-Ⅰ及α-synuclein蛋白的表达,荧光显微镜观察自噬泡的形成及LC3与GBA在细胞内的共定位。结果与转染EGFP-N1组相比,转染EGFP-GBA组上调Beclin 1和LC3-Ⅱ/LC3-Ⅰ 蛋白的表达水平(Plt;0.05),而α-synuclein表达水平则下降(Plt;0.05);与转染EGFP-N1组相比,转染EGFP-GBA组自噬空泡数目明显增加,外源性LC3免疫荧光表达明显增强,且GBA与LC3存在共定位。结论GBA上调自噬水平,降低α-synuclein蛋白的表达。
葡萄糖脑苷脂酶;α-突触核蛋白;自噬
大量病理的、遗传的及临床的研究都证实葡萄糖脑苷脂酶基因(glucocerebrosidase gene, GBA)基因突变是帕金森病及相关疾病的重要危险因素[1]。帕金森病(Parkinson’s disease, PD)的病理标志是黑质致密部选择性多巴胺神经元的丢失及残存的神经元内蛋白聚集体的形成,而α-突触核蛋白是这些蛋白聚集体的主要组成部分,PD的发生、发展以及受累脑区的变性均与α-突触核蛋白的异常聚集有密切的联系[2-3]。GBA基因的突变可促进α-突触核蛋白相互聚集并形成稳定的寡聚体,积聚的α-突触核蛋白影响了GBA蛋白的活性,而GBA活性的改变反过来又影响了α-突触核蛋白的清除,由此可见α-突触核蛋白与GBA蛋白的缺乏在PD的发病中起到了一个双向环路的作用[4]。自噬-溶酶体途径在清除异常聚集的α-突触核蛋白中发挥着重要作用[5],GBA是溶酶体内的一种酶,且GBA与α-突触核蛋白可相互影响,因此有学者推测GBA蛋白在自噬-溶酶体和调控α-突触核蛋白的表达中发挥着某种作用。为此,设计本实验以探讨GBA对自噬的调控及对α-突触核蛋白表达水平的影响。
1 材料与方法
1.1 材料
细胞及试剂:质粒EGFP-N1、EGFP-GBA和RFP-LC3(苏州大学药学院王光辉教授馈赠),人神经母细胞瘤细胞(SH-SY5Y)(中南大学湘雅医院唐北沙教授馈赠),DMEM培养基、胎牛血清(FBS)(Gibco公司),抗LC3抗体(Abcam公司)、抗GAPDH抗体(Santa Cruz Biotechnology公司)、抗Beclin抗体(Eptimics公司),过氧化物酶标记山羊抗兔IgG(Promega公司),Lipofectamine2000、单丹磺酰尸胺(monodan-sylcadaverine,MDC)和Hochest33258(Sigma公司),LysoTracker(Invitrogen公司)。
1.2 方法
1.2.1 细胞培养及转染:SH-SY5Y细胞常规培养于含有体积分数15%新鲜胎牛血清的DMEM完全培养液中,置于37 ℃、体积分数5% CO2细胞培养箱中培养,细胞以4×108个/L接种于6孔板里,次日转染,转染具体操作步骤参考脂质体LipofectamineTM2000说明书进行。
1.2.2 MDC染色:MDC是一种化学荧光染料,可以标记自噬空泡,通过其染色可观察判断细胞自噬的发生。SH-SY5Y细胞分别转染EGFP-N1、EGFP-GBA 24 h后,用质量分数4%多聚甲醛室温固定10 min,磷酸盐缓冲液(1×PBS)洗3次,加入终浓度为0.05 mmol/L的MDC染色液,37 ℃孵育1 h后加入1×PBS洗3遍,在荧光倒置显微镜(Olympus 1×70)下观察荧光情况,并在400倍视野下,各组细胞随机抽取20个不相重复的视野进行观察拍照。
1.2.3 细胞免疫荧光化学:将SH-SY5Y细胞按1∶4接种比例接种至6孔板进行培养,次日转染后置于37 ℃、体积分数5% CO2细胞培养箱中培养48 h,弃去培养基,1×PBS洗2遍,用质量分数4%的多聚甲醛,室温下固定10 min,1×PBS洗3遍,0.25%聚乙二醇辛基苯基醚(Trito X-100)封闭10 min,1×PBS洗3遍,Hochest33258(1∶10 000)染细胞质,室温下避光孵育3 min,1×PBS洗3次,用荧光倒置显微镜观察并分析荧光情况(568 nm激发,探测RFP红色荧光;488 nm激发,探测EGFP绿色荧光),并在400倍视野下,各组细胞随机抽取20个不相重复的视野观察和拍照。
1.2.4 蛋白印迹(Western blot):SH-SY5Y细胞转染48 h后,收集细胞提取总蛋白制成所需样品;十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)后转移到聚偏二氟乙烯(PVDF)膜上;PVDF膜用5%脱脂奶粉室温封闭1 h,TBST洗3次,加入抗Beclin1(1∶800)、抗α-synuclein(1∶1 000)、抗LC3(1∶300)抗体,4 ℃过夜。次日加入HRP结合的二抗(山羊抗兔IgG,1∶5 000),室温孵育2 h后行ECL光化学法显色,暗室下行X线胶片曝光,内参为GAPDH。各组Western blot蛋白条带用AlphaEaseFC(FluorChem8900)软件分析图像,采用平均吸光度值比较各组蛋白的表达。
1.3 统计学分析
2 结果
2.1Westernblot检测细胞内源性Beclin1、LC3-Ⅱ/LC3-Ⅰ、α-synuclein的表达
与转染EGFP-N1组相比,转染EGFP-GBA组内源性Beclin 1蛋白的表达明显上调(Plt;0.05),且LC3-Ⅱ/LC3-Ⅰ比值增高(Plt;0.05),而α-synuclein表达减少(Plt;0.05)(图1,表1)。
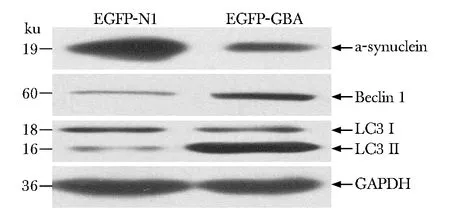
图1 过表达GBA后对α-synuclein、Beclin1和LC3蛋白的影响Fig 1 The influence of GBA overexpression on α-syn- uclein, Beclin1 and LC3 protein expression
表1 GBA对α-synuclein、Beclin 1、LC3-Ⅱ/LC3-Ⅰ蛋白表达的影响Table 1 Effect of GBA on protein of α-synuclein, Beclin 1 and the ratio of LC3-Ⅱ/LC3-Ⅰ
*Plt;0.05 compared with EGFP group.
2.2 免疫荧光观察MDC和Lysotracker染色
与转染HA组相比,转染HA-GBA组MDC染色信号增强,自噬空泡聚集增多(图2A)。同时利用溶酶体标志物LysoTracker Red DND-99来观察溶酶体荧光强度的变化(图2B)。
2.3转染后观察细胞内RFP-LC3和EGFP-GBA的免疫荧光信号及共定位
与转染EGFP组相比,转染EGFP-GBA组RFP-LC3的免疫荧光信号明显增强,外源性LC3的表达明显上调,自噬水平上调;且RFP-LC3和EGFP-GBA存在亚细胞共定位(图3)。
3 讨论
研究证实GBA基因是PD重要的危险因素,其与PD发病机制的关系主要有两种假设:一种是GBA基因突变导致蛋白错误折叠,抑制了泛素-蛋白酶体系统的活性,导致异常蛋白的降解减少[6];另一种是GBA基因突变导致GBA在体内聚集,引起自噬障碍或溶酶体机能不全,使α-突触核蛋白的聚集增多[7]。GBA蛋白与α-突触核蛋白在体内外都存在相互作用,且二者共定位在组织蛋白酶D阳性的细胞结构内[8]。在一种GBA基因突变的鼠模型的海马区域中发现,GBA基因的突变和下调GBA的表达都能上调α-突触核蛋白的表达[9];在本实验中,过表达GBA使α-突触核蛋白的表达水平明显降低,这与GBA基因突变导致GBA缺乏引起α-突触核蛋白聚集、浓度增加的结果相对应。
越来越多的研究证实,自噬调节途径的病理改变可能是易聚集蛋白(如α-突触核蛋白)在受损神经元内积聚的主要原因,与PD等神经系统变性疾病的发生、发展密切相关[10-11]。当自噬发生时,LC3-Ⅱ/LC3-Ⅰ比值明显增高[12-13],Beclin1表达明显上调[14]。在一个过表达GBA基因突变(D409V)的动物模型研究中发现,GBA基因的突变导致α-突触核蛋白的聚集, 但这种聚集可被自噬诱导剂雷帕霉素逆转[9]。 在该实验中,过表达GBA使Beclin1蛋白表达明显上调,LC3-Ⅱ/LC3-Ⅰ比值增高,且MDC染色结果也显示细胞内自噬空泡数目明显增加,溶酶体标志物也显示溶酶体的数量明显增加。共转染HA-GBA和RFP-LC3,LC3荧光强度增加,且HA-GBA和RFP-LC3存在明显的共定位,由此表明过表达GBA可诱导细胞自噬的发生。
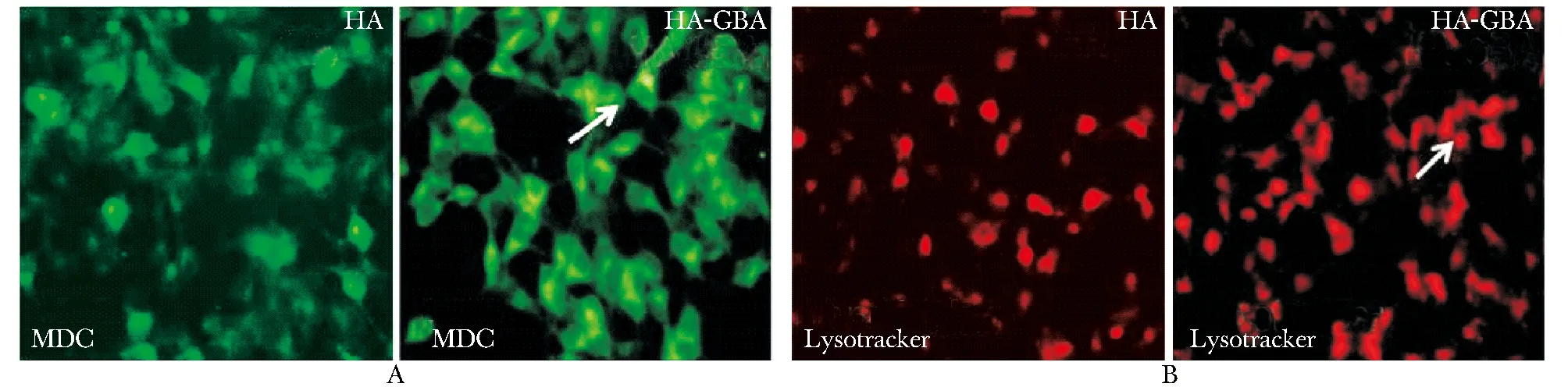
A.in GBA overexpressing groups,the bright green dots of MDC staining were increased in the morphologic picture, which marked autophagy; B.immunofluorescene showed that the bright red dots of Lysotracker staining were increased in GBA overexpressing groups
图2共聚焦倒置显微镜观察MDC和Lysotracker染色情况
Fig2ConfocalfluorescencemicroscopyimageofMDCandLysotrackerstaining(×400)
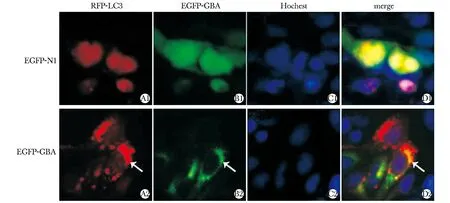
Immunoflourescence analysis showed that GBA(green) colocalized with LC3(red) in the cytoplasm of SH-SY5Y cells图3 GBA和LC3在SH-SY5Y细胞中的共定位关系Fig 3 Co-localization of GBA and LC3 in SH-SY5Y cells(×400)
过表达GBA既可以上调自噬水平,又能使α-突触核蛋白表达降低,二者是否存在关联呢?自噬可通过降解那些触发早期阶段细胞死亡的损伤的异常蛋白(如α-突触核蛋白),从而对神经元起保护作用,而抑制神经元内的自噬则会导致蛋白聚集体的积聚和神经元的变性。本实验发现过表达GBA可以诱导自噬,自噬又是降解α-突触核蛋白的重要途径,且GBA与α-突触核蛋白共定位在组织蛋白酶D阳性的细胞结构内[8],由此推测过表达的GBA可能部分通过自噬降低α-突触核蛋白的表达水平,但该推测及具体的机制还需要进一步的研究证实。
[1] Sidransky E, Nalls MA, Aasly JO,etal. Multicenter analysis of glucocerebrosidase mutations in Parkinson’s disease[J]. N Engl J Med, 2009, 361: 1651-1661.
[2] 翟骁,段国礼,沈下贤,等. α-突触核蛋白在帕金森病中的作用[J]. 基础医学与临床,2012, 32: 1481-1483.
[3] Spillantini MG, Schmidt ML, Lee VM,etal. AlpHA-synuclein in Lewy bodies[J]. Nature, 1997,388:839-840.
[4] Tan EK, Tong J, Fook-Chong S,etal. Glucocerebrosidase mutations and risk of Parkinson disease in Chinese patients[J]. Arch Neurol, 2007,64:1056-1058.
[5] Pan T, Kondo S, Le W,etal. The role of autophagy-lysosome pathway in neurodegeneration associated with Parkinson’disease[J]. Brain, 2008, 131:1969-1978.
[6] Dawson TM. Parkin and defective ubiquitination in Parkinson’s disease[J]. J Neurla Transm Suppl, 2006, 70: 209-213.
[7] Wong K, Sidransky E, Verma A,etal. Neuropathology provides clues to the pathphysiology of Gaucher disease[J]. Mol Genet Metab, 2004, 82: 192-207.
[8] Yap TL, Gruschus JM, Velayati A,etal. AlpHA-synuclein interacts with glucocerebrosidase providing a molecular link between Parkinson and Gaucher diseases[J]. J Biol Chem, 2011,286: 28080-28088.
[9] Cullen V, Sardi SP, Ng J,etal. Acid beta-glucosidase mutants linked to Gaucher disease, Parkinson disease, and Lewy body dementia alter alpHA-synuclein processing[J]. Ann Neurol, 2011, 69: 940-953.
[10] 杨光,祝元刚,杨慧. 雷帕霉素抗神经退行性病研究进展[J]. 基础医学与临床,2008, 28: 1336-1338.
[11] Cherra SJ, Chu CT. Autophagy in neuroprotection and neurodegeneration:a question of balance[J]. Future Neurol, 2008, 3:309-323.
[12] Klionsky DJ. Autophagy: from phenomenology to molecular understanding in less than a decade[J]. Nat Rev Mol Cell Biol, 2007, 8:931-937.
[13] Klionsky DJ,Cuervo AM, Seglen PO. Methods for monitoring autophagy from yeast to human[J]. Autophagy, 2007,3: 181-206.
[14] Luo S, Rubinsztein DC. Apoptosis blocks Beclin 1-dependent autophagosome synthesis: an effect rescued by Bcl-xL[J]. Cell Death Differ, 2010, 17: 268-277.
Overexpression of GBA induces autophagy and decreases α-synuclein expression in SH-SY5Y cells
FAN Cheng-he, WANG Xue-jing, CHU Guang-lei, MA Yao-hua, JING Jing, TENG Jun-fang*
(Dept. of Neurology, the First Affiliated Hospital of Zhengzhou University, Zhengzhou 450052, China)
ObjectiveTo investigate the mechanism of autophagy induced by GBA and the regulation of GBA on the expression of α-synuclein in SH-SY5Y cells.MethodsThe recombinated plamid EGFP-N1, EGFP-GBA were transfected into SH-SY5Y cells through eukaryotic cell transfection technique. The expression of beclin1, LC3-Ⅱ/LC3-Ⅰ and α-synuclein in the level of protein was detected through Western blot,MDC staining and cellular immunofluorescence microscopy were performed to observe the change of autophagic vacuolization and their subcellular colocalization.ResultsCompared to EGFP-N1 group, the expression of Beclin1 and LC3-Ⅱ/LC3-Ⅰ in group of overexpression EGFP-GBA were significantly increased, and the average number of autophagic vacuoles per cell increased, however, the expression of α-synuclein was significantly decreased (Plt;0.05). Besides, the signals for LC3, GBA and the extent of their co-localization increased in GBA groups.ConclusionsGBA protein decreases the expression of α-synuclein and induces autophagy of SH-SY5Y cells.
GBA; α-synuclein; autophagy
2013-07-18
2013-10-28
国家自然科学基金(81241046)
*通信作者(correspondingauthor): 13838210077@163.com
1001-6325(2014)04-0480-05
研究论文
R 741.02
A
