NOK癌基因对人胚肾293T细胞周期G1/S期的影响及其作用机制
2014-11-27刘斌,刘力
刘 斌,刘 力
(中国医学科学院 基础医学研究所 北京协和医学院 基础学院 病原生物学系,北京 100005)
NOK癌基因对人胚肾293T细胞周期G1/S期的影响及其作用机制
刘 斌,刘 力*
(中国医学科学院 基础医学研究所 北京协和医学院 基础学院 病原生物学系,北京 100005)
目的探讨NOK癌基因对人胚肾293T细胞周期G1/S期的影响,并研究NOK对G1/S期调控的作用机制。方法用流式细胞仪对瞬时转染NOK及pcDNA3.0空载体的293T、293ET及HeLa细胞进行周期检测,并用免疫印迹法(Western blot)在293T细胞中,对其细胞周期G1/S期检验点调控蛋白cyclin D/E1及CDK2/4等蛋白水平进行检测。结果瞬时转染NOK可使293T、293ET及HeLa细胞G1期较转染空载体pcDNA3.0的细胞比例减少,S期比例增多 (Plt;0.05)。转染NOK可使G1/S期检验点相关蛋白cyclin D、cyclin E1、p-CDK-2、p-CDK-4、p-Akt及p-Rb蛋白的表达量上升,使P21及P53蛋白表达量下降。结论NOK可促进细胞快速通过细胞G1/S期检测点,其机制涉及对Akt及CDK2/4通路的影响。
NOK;细胞周期;周期素
细胞周期是细胞重要的生理过程,而细胞周期异常与肿瘤发生密切相关。恶性肿瘤的特征之一在于细胞周期稳态的失控,所以,对于细胞周期的研究对了解肿瘤细胞的增殖与分化有重要作用[1]。NOK(novel oncogene with kinase-domain)是从人扁桃体癌中克隆出的一个新型癌基因,之前的研究已经证明,NOK具有肿瘤基因的特征,其可以促进BaF3细胞向肿瘤转化,诱导肿瘤细胞向远端器官侵袭和转移,且这种致癌效果可在多种组织脏器中发挥作用[2],在乳腺癌和肺癌等恶性肿瘤中均有体现[3]。然而,对于NOK在调控细胞周期中的作用机制尚未见报道。本研究就NOK对于细胞周期的影响进行了一些初步的研究,以期为进一步揭示NOK的致癌性作用机制以及为抗NOK药物筛选提供依据。
1 材料与方法
1.1 细胞培养及转染
将293T,293ET及HeLa细胞置于10%胎牛血清的DMEM中培养,放入37 ℃、5%CO2细胞培养箱,待其贴壁增殖至80%~90%汇合时,更换培养液。换液后1 h,使用高效真核转染试剂对细胞进行瞬时转染,分别转入pcDNA3.0(5、4及0 μg)和pcDNA-NOK-HA(或简称NOK-HA) (5、1及0 μg)。转染后2 h更换培养基,48 h收获细胞。
1.2 流式细胞检测细胞周期
取大约3×106个收获的细胞置于1.5 mL离心管,5 000r/min离心5 min,弃去上清后用4 ℃ PBS洗涤两遍,弃去上清。加入0.3 mL 4 ℃ PBS重悬沉淀,后用4 ℃无水乙醇逐滴加入,并轻轻振动,使之成为单细胞悬液。将离心管置于-20 ℃冰箱内进行沉淀,24 h后取出离心管,5 000r/min离心5 min去乙醇,使用4 ℃ PBS洗涤两遍,并重悬,加入1 μL RNase A,放入37 ℃孵箱水浴0.5 h,通过冰浴终止反应。加入100 μL PI染色液避光染色10 min后,使用COULTER 流式细胞仪进行细胞周期检测。本研究中,所有流式检测设平行试验3组,探讨NOK对细胞周期的影响。
1.3 Western bolt检测蛋白表达水平
取收获细胞于1.5 mL离心管中,12 000r/min离心8 min,弃去上清后用4 ℃ PBS洗涤两遍,弃去上清。加入0.2 mL细胞裂解液重悬,冰浴20 min裂解细胞,后12 000r/min离心10 min,取上清进行Western blot检测。使用Quantity One进行吸光度比值测定。
1.4 实验材料
实验所用细胞(中国医学科学院基础所细胞中心提供),转染试剂(Vigorous公司),RNase A(Sigma公司),细胞裂解液(北京赛驰生物科技有限公司),抗体(Bioworld公司)。
1.5 统计方法
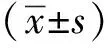
2 结果
2.1NOK促进293T、293ET及HeLa细胞由G1期进入S期
转染pcDNA3.0的293T细胞(图1A)G1期所占比例为(49.10±1.23)%,S期所占比例为(50.75±1.08)%,而转染了NOK-HA的293T细胞(图1B)G1期所占比例为(41.51±0.12)%,S期所占比例为(58.49±0.12)%,A组细胞G1期比例大于B组,S期比例小于B组 (Plt;0.05)。同时,在293ET(图2)及HeLa(图3)细胞中也分别进行了同样的实验。与转染293T细胞结果一致,在293ET和HeL细胞中转染了pcDNA3.0的A组细胞G1期比例大于转染了NOK-HA的B组细胞,而S期比例则小于B组细胞 (Plt;0.05)。
2.2 NOK对cyclin-CDKs蛋白的影响
293T细胞中,随着NOK转染量的上升,细胞周期素D1及与之复合的p-CDK4蛋白表达量上升(图4A),细胞cyclin E及与之复合的p-CDK2蛋白表达量亦上升(图4B)。
2.3 NOK对细胞Akt通路的影响
过表达NOK可以促进CDK上游增殖信号Akt通路的活化,促进p-Akt蛋白水平量的上升,且显著抑制CDK抑制因子P21蛋白的表达,以及抑制抑癌基因P53的表达(图5A)。此外,过表达NOK可显著提高CDK下游基因Rb蛋白的磷酸化水平(图5B)。

A.FCM result of 5 mg pcDNA 3.0 transient transfection in a 35 mm dish; B.FCM result of 5 mg NOK-HA transient transfection in a 35mm dish; C.statistics result of the G1/S distribution of 293T cell;*Plt;0.01 compared with pcDNA 3.0
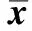

A.FCM result of 5 mg pcDNA 3.0 transient transfection in a 35 mm dish; B.FCM result of 5 mg NOK-HA transient transfection in a 35 mm dish; C.statistics result of the G1/S distribution of 293ET cell;*Plt;0.05 compared with pcDNA 3.0
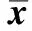
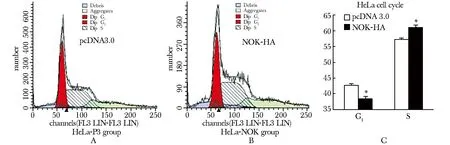
A.FCM result of 5 mg pcDNA 3.0 transient transfection in a 35 mm dish; B.FCM result of 5 mg NOK-HA transient transfection in a 35 mm dish; C.statistics result of the G1/S distribution of HeLa cell;*Plt;0.01 compared with pcDNA3.0
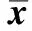
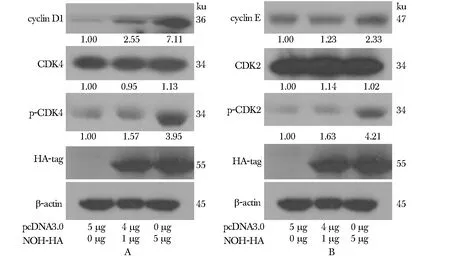
图4 NOK对细胞Cyclin-CDKs蛋白的变化水平Fig 4 The protein levels change of cyclin-CDKs in responding to increased doses of NOK
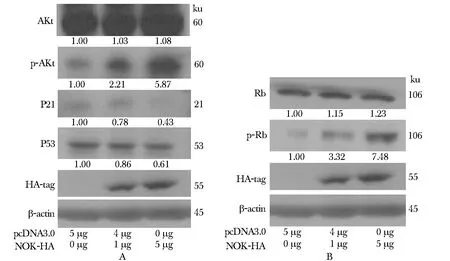
A.alterations of upstream proteins of CDKs in responding toNOKover-expression; B.changes of downstream protein of CDKs in responding toNOKover-expression
图5NOK对CDK上游及下游相关调控基因的影响
Fig5TheeffectsofNOKontheexpressionsofupstreamordownstreamregulatorygenesofCDKs
3 讨论
NOK是一个受体型蛋白酪氨酸激酶分子(RPTKs),而RPTKs在细胞的不同阶段都发挥着重要作用[4],之前的研究已经证明了NOK具有与FGFR/EGFR的高度同源性,且已经证明其具有一定的致癌性。但由于NOK缺少胞外配体结合区域,所以对于胞外信号受NOK调控的机制尚不清晰[5]。过度增殖是肿瘤细胞的特征之一,而细胞周期的改变是造成细胞增殖的重要原因。在本研究中,过表达NOK基因,可以使细胞停留在G1期的百分比下降,停留在S期的百分比上升,这提示NOK基因可能具有使细胞快速从G1期向S期转化的作用,进而使细胞周期缩短,提高细胞增殖率。
在正常细胞中,细胞周期的各个时点存在着起到关键作用的调控点,发挥着“开关”式的作用。这其中细胞周期依赖性激酶(cyclin-dependent kinase, CDK)因子起到了核心作用,CDK因子主要是依赖于细胞周期素(cyclins)发挥特异性调控作用[6]。具体到细胞G1/S期调控,已有大量研究证明,cyclin D1-CDK4和cyclin E-CDK2是构成细胞G1/S期检测点的重要部分,其共同激活Rb蛋白,使其磷酸化,调节细胞进入S期[7]。本研究中,293T、293ET及HeLa细胞流式结果趋势基本一致,故本研究只选用了293T细胞作为蛋白水平检测细胞系。在本研究中,在293T细胞中,过表达NOK可以使cyclinD1及cyclinE表达量上升,且可促进CDK2和CDK4的磷酸化,提示NOK可能促进细胞cyclin D1-CDK4和cyclin E-CDK2复合物的形成,同时,过表达NOK使磷酸化Rb蛋白表达量上升(图5B),也提示了NOK可能通过调节G1/S期检测点关键蛋白的方式,促进细胞由G1期向S期转变。上述结果证明并解释了流式细胞周期检测结果。
Akt蛋白的活性与细胞周期有密切关系[8-9],在本研究中,探讨NOK对于细胞G1/S检测点关键蛋白发挥作用的机制,对于其相关的信号通路进行了检测。研究结果显示,过表达NOK可以促进磷酸化Akt蛋白(p-Akt)的表达,进而起到激活Akt信号通路的作用,同时,处于Akt信号通路下游的P21及P53因子表达水平有所降低(图5A),而P21与P53分子已被证明可以作用于细胞G1/S期检测点,其表达量上升有抑制CDK蛋白磷酸化的作用,使细胞停留在G1期[10]。由此本研究认为,NOK可能通过影响Akt信号通路的活性,降低P21及P53因子的表达水平,进而提高CDK因子的磷酸化水平,促进cyclins-CDKs复合物的形成,致使Rb蛋白磷酸化,释放转录因子E2F,激活E2F/DP,促进DNA聚合酶等的转录过程,使细胞更快速的通过G1/S期检测点,由G1期进入S期,从而缩短了细胞周期。
尽管本研究已对NOK对于细胞周期的影响及其可能涉及到的信号通路做了初步研究,但NO对于细胞周期发挥作用的完整机制尚不清晰,且对于NOK基因在何位置介入到细胞周期调控网络中也不明确,相关工作将在后续研究中予以证明。
[1] Chen DS, Mellman I. Oncology meets immunology: the cancer-immunity cycle[J].Immunity, 2013,39:1-10.
[2] Chen Y, Li YH, Liu L,etal.Point mutation at single tyrosine residue of novel oncogene NOK abrogates tumorigenesis in nude mice[J]. Cancer Res, 2005,65:10838-10846.
[3] Moriai R, Kobayashi D, Amachika T,etal. Diagnostic relevance of overexpressed NOK mRNA in breast cancer[J]. Anticancer Res, 2006,26:4969-4973.
[4] 陈慧娜,任满意,魏峰涛,等.TWEAK促进大鼠心肌成纤维细胞增殖和胶原合成[J].基础医学与临床,2011,31:170-173.
[5] Li YH, Wang YY, Zhong S,etal. Transmembrane helix of novel oncogene with kinase-domain (NOK) influences its oligomerization and limits the activation of RAS/MAPK signaling[J]. Mol Cells, 2009,27:39-45.
[6] Lim S, Kaldis P. Cdks, cyclins and CKIs: roles beyond cell cycle regulation[J].Development, 2013,140:3079-3093.
[7] Yu Z, Wang L, Wang C,etal.Cyclin D1 induction of Dicer governs microRNA processing and expression in breast cancer[J]. Nat Commun,29:2812-2822.
[8] Xu G, Li Y, Yoshimoto K,etal.2,3,7,8-Tetrachlorodibenzo-p-dioxin stimulates proliferation of HAPI microglia by affecting the Akt/GSK-3β/cyclin D1 signaling pathway[J]. Toxicol Lett, 2013,224:362-370.
[9] Shimura T. Acquired radioresistance of cancer and the AKT/GSK3β/cyclin D1 overexpression cycle[J]. J Radiat Res, 2011,52:539-544.
[10] Bhattacharya S, Das T, Biswas A,etal. A cytotoxic protein (BF-CT1) purified from Bungarus fasciatus venom acts through apoptosis, modulation of PI3K/AKT, MAPKinase pathway and cell cycle regulation[J]. Toxicon,2013,74:138-150.
Influence and mechanism ofNOKoncogene on G1/S distribution in human embryonic kidney 293T cells
LIU Bin, LIU Li*
(Dept. of Microbiology, Institute of Basic Medical Sciences, CAMS, School of Basic Medicine, PUMC, Beijing 100005, China)
ObjectiveTo analyze the influence of theNOKoncogene on the G1/S distribution in 293T cells and to elucidate the regulated mechanisms responsible forNOKmediated G1/S phase control.MethodsAfter transiently transfectingNOKinto 293T, 293ET and HeLa cells, we detected the cell cycle distribution by flow cytometry. Then, we detected the protein expressions of G1/S check point related genes such as cyclin D, cyclin E1,CDK2 and CDK4 by western blot analysis.ResultsIn the 293T,293ET and HeLa cell which was transfected byNOK, the G1phase proportions of cells were reduced, but the S phase proportion of cells was increased (Plt;0.05). Significant up-regulations in the expressions of cyclin D,cyclin E1, p-CDK-2, p-CDK-4, p-Akt and p-Rb were observed with the increased delivery ofNOKinto 293ET cells.ConclusionsNOKcan promote cell cycle progression by rapidly passing the G1/S check point, which may involve the activation of both Akt and CDK2/4 signaling pathways.
NOK; cell cycle; cyclin
2013-12-23
2014-01-07
国家自然科学基金(30871283,81171944)
*通信作者(correspondingauthor): lliu@pumc.edu.cn
1001-6325(2014)04-0470-05
研究论文
R 113
A
