池塘养殖异育银鲫寄生黏孢子虫的种群动态
2014-11-05叶灵通李文祥吴山功王江勇王桂堂
叶灵通 李文祥 邹 红 吴山功 王江勇 王桂堂
(1. 中国水产科学研究院南海水产研究所, 广东省渔业生态重点实验室, 农业部南海渔业资源开发利用重点实验室,广州 510300; 2. 中国科学院水生生物研究所, 武汉 430072)
异育银鲫具有生长快、个体相对较大等特点,且肉质鲜美, 已经成为我国重要的养殖品种, 遍布于各养殖地区[1,2]。但是, 由于近年来集约化养殖的兴起, 使得异育银鲫的疾病越来越多, 给异育银鲫养殖业带来了很大的威胁。黏孢子虫病就是其中较为严重的一种疾病。迄今为止, 已经在异育银鲫上发现了40多种黏孢子虫, 其中不少种类能导致严重的疾病。比如, 武汉单极虫(Thelohanellus wuhanensis)寄生于异育银鲫鱼苗的皮肤上, 影响鱼苗正常发育, 严重时能造成鱼苗大规模死亡[3]; 洪湖碘泡虫(Myxobolus honghuensis)寄生于异育银鲫的咽部, 造成江苏省北部一带养殖异育银鲫的大量死亡[4,5]。由于黏孢子虫具有坚硬的外壳, 使用的药物难以进入孢子虫内。药物防治难以有效控制异育银鲫黏孢子虫病的暴发。因此, 只有弄清楚了黏孢子虫病的发生规律, 制定合理的生态防控策略, 结合药物防治的方法切断黏孢子虫的传播途径, 才能有效控制黏孢子虫病的发生。
在国外, 已经有较多的关于黏孢子虫的流行病学及季节动态的研究, 这些研究主要分为两类: (1)寄生于江河、湖泊等自然水体中鱼类宿主的黏孢子虫季节动态及流行病学研究[6—16]; (2)寄生于池塘养殖鱼类宿主的黏孢子虫季节动态及流行病学研究[17—21]。自20世纪 80年代以来, 我国也开展了一些寄生于异育银鲫上的黏孢子虫的流行病学调查, 如武汉单极虫、多格里碘泡虫、异样碘泡虫、肌肉碘泡虫等的种群动态[3,22,23]。但是, 在池塘养殖的异育银鲫中,还有一些较常见的、危害较大的种类的流行规律未见报道。因此, 本研究通过对湖北省洪湖市异育银鲫养殖区一口养殖池塘(30亩)周年跟踪调查, 试图了解该地区池塘养殖过程中异育银鲫寄生的黏孢子虫种类及其季节发生规律。
1 材料与方法
1.1 样品的收集与鉴定
2009年9月至2010年8月间, 选择湖北省洪湖市龙口镇(北纬29° 40′–29° 58′ , 东经113° 12′–113° 26′ )一口30亩异育银鲫养殖池塘, 对异育银鲫寄生的黏孢子虫种类和季节动态进行调查。每月采样一次(其中2010年2月份未采样), 每次用手网捕获并随机选择24—35条异育银鲫。将实验鱼装入氧气袋, 活体运回实验室,暂养于水族箱中, 进行鱼体测量和黏孢子虫检查。
首先观察检查异育银鲫的体表, 如鳞片、鳍条、鱼体黏液等是否有包囊或者孢子的存在; 在检查完鱼体外部器官后, 对鱼进行解剖, 依次分离并检查鱼的鳃、心脏、肝、胆胰腺、肠、肾、膀胱等。如果发现黏孢子虫的包囊, 则首先测量包囊的直径。寄生于鳃上的种类按照鳃片的顺序(从外及里定义为第一至第四鳃片)进行包囊的数量统计。在测量并记录包囊后, 将包囊置于载玻片上, 用盖玻片将包囊压破, 然后置于显微镜下进行种类鉴定。对于没有明显包囊的器官, 采用直接压片的方法: 剪下小块组织, 置于干净载玻片上, 尽量将组织压薄至10 μm以下, 置于显微镜下进行种类鉴定。黏孢子虫的鉴定方法参照中国动物志黏体动物门[24]和Lom与Arthur[25]等提出的分类准则。
1.2 参数计算及统计分析
黏孢子虫的感染情况主要依据感染率和感染丰度, 有包囊的种类还计算感染强度。感染率和平均丰度定义参考 Bush等[26]和李文祥[27]。对于有包囊的种类, 依据包囊出现与否确定感染率, 依据包囊数量确定感染丰度和感染强度; 对于无包囊种类,依据孢子出现与否确定感染率, 不统计感染丰度和感染强度。实验数据采用SPSS 13.0软件进行统计分析, 各月份间黏孢子虫感染率的显著性差异用卡方检验, 各月份间包囊直径大小的显著性检验用单因素方差分析(One-way ANOVA)。根据统计的数据,利用Excel或者SigmaPlot10.0进行作图。
2 结果
2.1 异育银鲫体内的黏孢子虫种类组成
本研究共检查异育银鲫 362尾, 经鉴定发现 4种黏孢子虫, 分别为: 多涅茨尾孢虫(Henneguya doneci Schulman 1962)、住心碘泡虫(Myxobolus hearti Chen, 1998)、瓶囊碘泡虫(Myxobolus ampullicapsulatus Zhao 2008)和尾孢虫未定种(Henneguya sp.)。多涅茨尾孢虫的孢囊寄生于鳃丝基部, 位于相邻两片鳃丝之间; 住心碘泡虫的孢囊寄生于心脏肌肉之间; 瓶囊碘泡虫的孢囊寄生于鳃丝末端, 组织切片显示其寄生于初级鳃丝的游离端; 尾孢虫未定种寄生于膀胱内, 属腔内寄生虫。
2.2 黏孢子虫的季节动态
在感染异育银鲫鳃部的种类中, 多涅茨尾孢虫的总体感染率为16.57% (62/362), 2009年9月感染率较高, 为 37.5%, 然后感染率逐渐降低, 至 2010年3月, 感染率只有6.1%; 4月至6月未发现感染,至7月份时感染率突增, 达到38.2%, 8月感染率在所有月份中最高, 达到42.4% (图1)。在不同的月份间, 多涅茨尾孢虫的感染率在统计学上差异显著(χ2= 63.59, df =10, P<0.05)。7月至9月间的感染率较高, 为37.5%—42.4%, 明显高于其他月份。
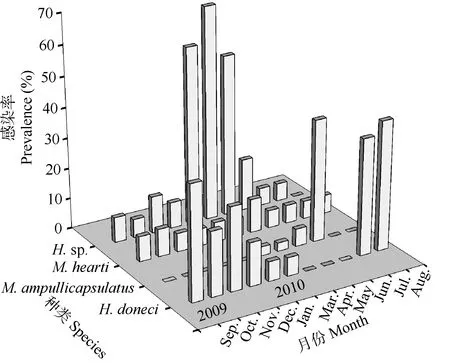
图1 异育银鲫体内黏孢子虫感染率的月份变化Fig. 1 Monthly prevalence of the myxosporean parasites in the allogynogenetic gibel carp Carassius gibelio
瓶囊碘泡虫的总体感染率为4.97% (18/362)。与多涅茨尾孢虫不同的是, 瓶囊碘泡虫只在2010年3月至6月出现, 3月份感染率最低为3%, 然后感染率逐月递增, 至6月感染率最高为40% (图1)。在不同的月份间, 瓶囊碘泡虫的感染率在统计学上差异显著(χ2=103.22, df =10, P<0.05)。
住心碘泡虫每月都能在异育银鲫的心脏上发现,2010年4月感染率最高为11.1%, 2009年12月感染率最低为5.7% (图1)。不同的月份间, 住心碘泡虫的感染率在统计学上差异不显著(χ2=1.72, df =10,P>0.05)。
尾孢虫未定种除了 2010年 8月未发现感染外(图1), 其他月份均有感染, 其中在2010年1—4月感染率较高为 60% (60/100), 其他月份感染率较低为8.02% (21/262)。在不同月份间, 尾孢虫未定种在1—4月的感染率与其他月份相比, 在统计学上差异显著(χ2=112.61, df =1, P<0.05)。
2.3 多涅茨尾孢虫包囊直径与平均丰度的变化
鳃寄生的多涅茨尾孢虫是本次调查中最常见、危害最大的黏孢子虫, 是本研究的重点。多涅茨尾孢虫包囊的丰度为0—52, 2009年9月包囊平均丰度为 2.42, 然后平均丰度逐月下降, 至 2010年 3月,平均丰度为0.06; 4月至6月, 未发现多涅茨尾孢虫感染。7月至 8月平均丰度突然上升, 最高达到2.79(图 2)。在不同月份间, 多涅茨尾孢虫平均丰度在统计学上差异显著(F = 2.669, df = 10, P<0.05)。包囊直径为0.3—4.5 mm变化, 2009年12月平均包囊直径最大为2.70 mm, 2010年7月平均包囊直径最小为0.87 mm。在不同月份间, 多涅茨尾孢虫平均包囊直径在统计学上差异显著(F = 21.402, df = 7,P<0.05)(图 2)。
2.4 各鳃片上多涅茨尾孢虫包囊的感染强度
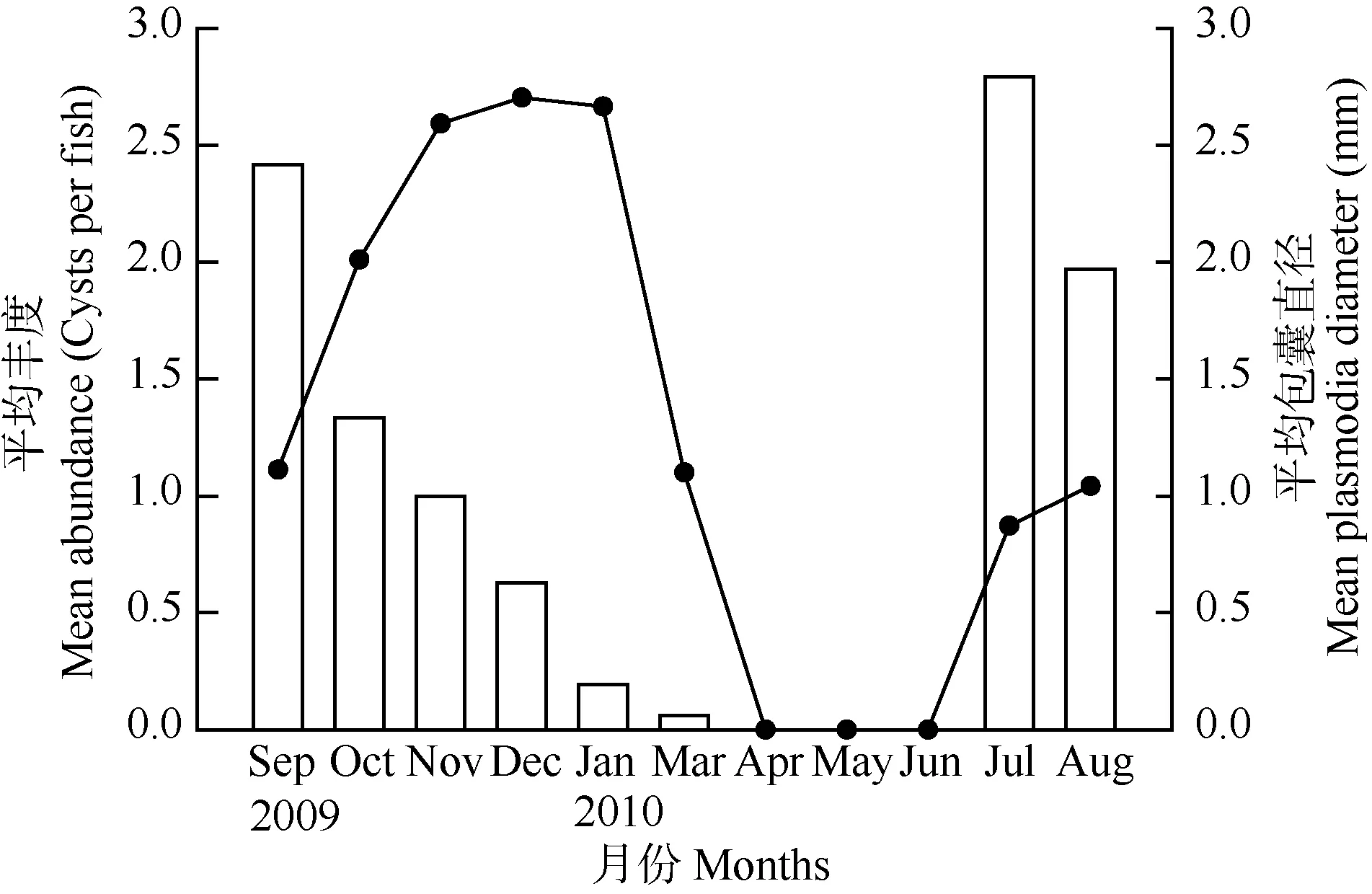
图2 寄生于异育银鲫鳃部的多涅茨尾孢虫包囊平均丰度(条形,左轴)和平均直径(点, 右轴)的月变化Fig. 2 Monthly changes in mean abundance (bars, left axis) and mean diameter (dots, right axis) of the plasmodia of Henneguya doneci on the gill filaments of the allogynogenetic gibel carp Carassius gibelio
异育银鲫鳃片分为 4瓣, 由外及里分别为第一至第四片鳃瓣。在60条感染多涅茨尾孢虫的异育银鲫中, 第一至第四片鳃被感染的鱼的尾数分别为30、39、37和40。在4片鳃中, 多涅茨尾孢虫的平均感染强度在2.08—3.09。虽然不同的鳃片之间, 多涅茨尾孢虫平均感染强度在统计学上差异不显著(χ2=2.56, df=3, P>0.05), 但第4片鳃的平均感染强度明显要高于其他鳃片(图3)。
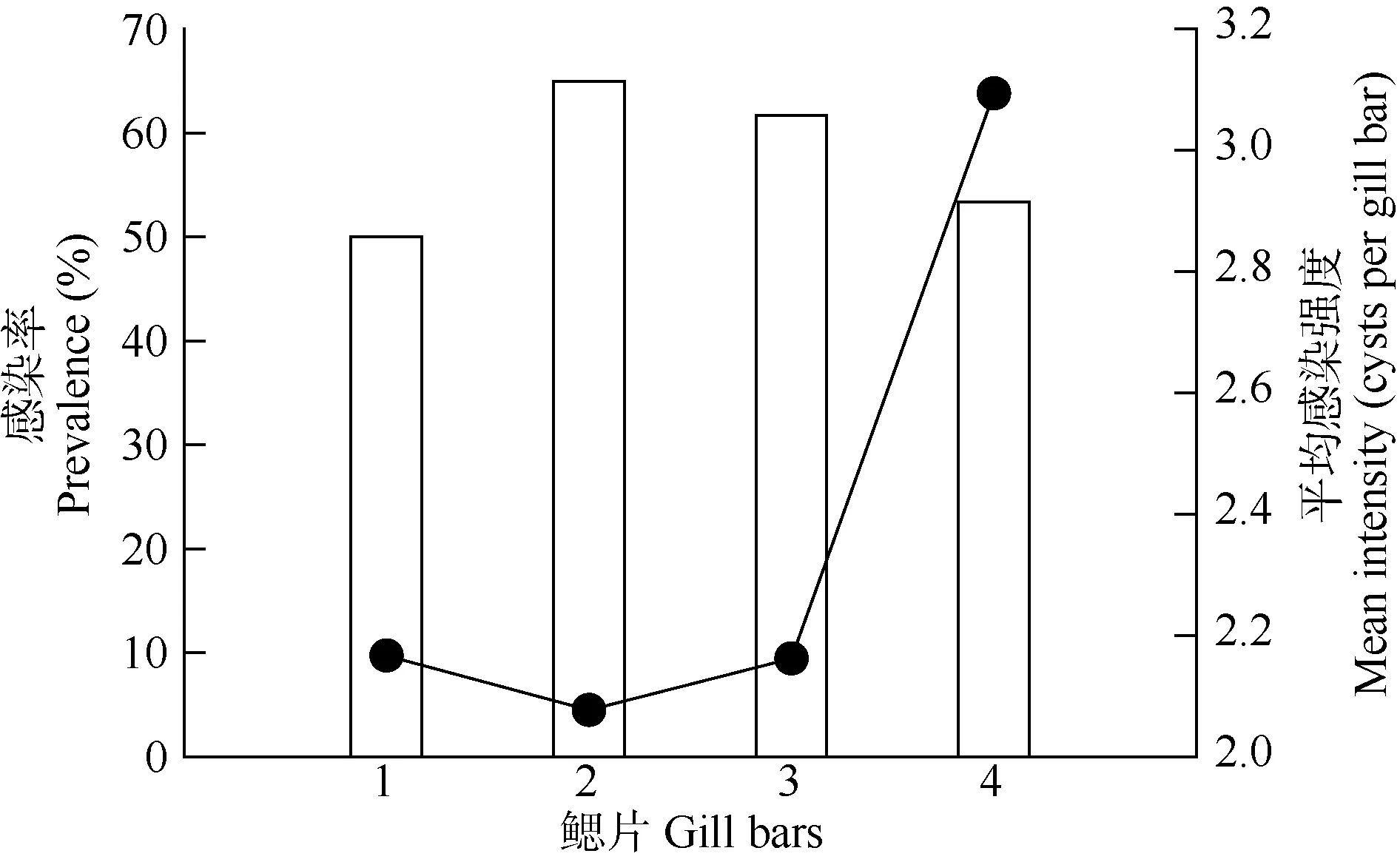
图3 异育银鲫不同鳃片间多涅茨尾孢虫的平均感染强度(点,右轴)和感染率(条形, 左轴)的变化Fig. 3 The intensity (dots, right axis) and prevalence (bars, left axis)of Henneguya doneci on different gill bars of Carassius gibelio
3 讨论
在本次池塘养殖异育银鲫寄生黏孢子虫季节动态研究中共发现了 4种黏孢子虫, 即多涅茨尾孢虫(Henneguya doneci)、住心碘泡虫(Myxobolus hearti)、瓶囊碘泡虫(Myxobolus ampullicapsulatus)和尾孢虫未定种(Henneguya sp.)。它们各自的感染率变化规律都不一样, H. doneci的感染高峰期处于 7—9月,4—6月并未发现感染; M. ampullicapsulatus只在3—6月发现感染, 且感染率都不太高; M. hearti每个月份都发现感染, 但是感染率在统计学上差异不显著; Henneguya sp.除了8月份外, 其他月份都发现感染, 且1—4月的感染率明显高于其他月份。不同的黏孢子虫具有不同的感染规律, 这是一个普遍的现象。Wang等[23]发现寄生于异育银鲫鳃部的银鲫碘泡虫(M. gibelioi)的感染高峰期出现在夏秋季, 即4—10月间, 低谷期出现在冬春季, 即11月至翌年5月间; Hallett等[11]发现寄生于属(Sillago)鱼类肠道内的Kudoa ciliatae在秋季感染率最高, 达到100%,在春季感染率最低, 只有 10%; Viozzi和 Flores[14]发现寄生于大斑南乳鱼(Galaxias maculatus)胆囊的Myxidium biliare全年都有感染, 但是夏季感染率最高, 冬季感染率最低; Cone[10]发现寄生于黄金鲈(Perca flavescens)鳃部的H. doori夏季未发现感染,秋冬季感染率最高; Alvarez-Pellitero和 Sitja-Bobadilla[9]发现寄生于海鲈(Dicentrarchus labrax)胆囊内的Ceratomyxa labracis和C. diplodae在冬季感染率最高, 夏季感染率最低。黏孢子虫的感染率变化规律的不同可能与其寄生部位、孢子发育机制等有直接关系, 不同的黏孢子虫所需的发育成熟时间也不一样[10]。H. doneci寄生于异育银鲫的鳃部[28], 可能会受外部因素影响较大, 如水温、水质、水的pH等。由H. doneci的感染规律可以推测, H. doneci的放射孢子虫期可能是在春季入侵异育银鲫, 随后孢子在夏季不断的发育分裂, 至 8月份时染率最高;到秋季时, 孢子发育分裂完成, 逐渐开始老化, 慢慢脱落到水中; 至冬季时, 大部分包囊都脱落, 孢子被寡毛类吞食, 并在其体内发育, 在春季时又释放出放射孢子虫重新感染宿主。因此推测H. doneci在鱼体宿主上需要 9个月完成一个周期, 而在寡毛类宿主上需要3个月完成一个周期。我们认为不同黏孢子虫的感染规律差异如此大可能是由于黏孢子虫在两种宿主中的发育周期不同造成的。如 M.ampullicapsulatus只在 3—6月发现感染, 可能就说明其在鱼体宿主内发育时间短, 在寡毛类宿主内发育时间长。但是也有可能是M. ampullicapsulatus本身发育分裂速度慢, 起初少量的感染并未被发现,从而人为地导致感染率低的情况。M. hearti寄生于异育银鲫的心脏内[29], 全年都有感染, 但是感染差异不显著。这可能是与其寄生于宿主内部器官有关系。M. hearti可能通过血液循环感染宿主心脏, 这样其感染所受的影响因素就较少, 水温、水质等外部因素可能只会影响其在寡毛类宿主内发育的过程,也会影响飘在水中的放射孢子虫期孢子, 但是在鱼体宿主内的发育分裂可能只受宿主的免疫能力、体质条件的影响, 所以一般其变化不会很明显。Henneguya sp.寄生于异育银鲫的膀胱, 属于排泄系统寄生的黏孢子虫, 其感染高峰出现在冬春季, 夏秋季感染率较低, 这可能与宿主的摄食有关, 夏秋季时是宿主生长发育时期, 摄食较为频繁, 排泄较为旺盛, 此时 Henneguya sp.感染率较低, 在冬春季时宿主几乎不摄食, 排泄也较为缓慢, 因此此时Henneguya sp.感染率较高。这种现象与寄生于海鲈(Dicentrarchus labrax)胆囊内的Ceratomyxa labracis和Ceratomyxa diplodae的感染情况相似[9]。
本研究中发现 H. doneci的包囊直径与其平均丰度呈负相关, 这可能跟孢子发育分裂有关, 感染初期放射孢子虫刚入侵宿主, 形成的包囊直径较小,但是能同时形成很多包囊, 所以感染的丰度较大;随着孢子的不断发育分裂, 孢子数目越来越多, 包囊直径也因此越来越大, 但是当孢子发育分裂到一定程度后, 包囊就开始破裂, 孢子掉入水中, 这样包囊数量就会减少, 感染丰度就会随之下降。本研究还发现 H. doneci在异育银鲫四片鳃中的感染强度也有差异, 其中第 4片鳃(即最里面的鳃片)比其他3片鳃的感染强度要高, 这可能与 4片鳃具有不同的外部环境有关, 由于第四片鳃位于最里面, 所以一旦感染, 就很容易稳定下来继续发育分裂, 其他鳃片可能更容易受到水流、滤食等的影响, 使感染的 H. doneci有可能会脱落。根据本研究的结果,可以推断H. doneci在4—6月处于放射孢子虫发育阶段, 这个时期可能是杀灭 H. doneci的最佳时间,因为放射孢子虫在水中的存活时间较短, 一旦感染上鱼体, 用药杀灭黏孢子虫的效果就不明显, 所以,可以利用这个时期采用药物或者生态防治措施来杀灭H. doneci, 减轻对宿主的危害。
