2-脱氧-D-葡萄糖对人脐静脉内皮细胞的作用
2014-11-02张冠华易成刚宋雅娟
程 静, 张冠华, 易成刚, 余 州, 宋雅娟, 杨 力
2-脱氧-D-葡萄糖对人脐静脉内皮细胞的作用
程 静, 张冠华, 易成刚, 余 州, 宋雅娟, 杨 力
目的观察2-脱氧-D-葡萄糖对人脐静脉内皮细胞增殖、迁移、管腔形成及细胞凋亡的影响,试图寻找治疗血管瘤的新药。方法用四甲基偶氮唑盐比色法、倒置显微镜下形态学观察、体外划痕实验的方法,观察2-脱氧-D-葡萄糖对人脐静脉内皮细增殖、迁移的作用;用成管法,检测2-DG对血管形成的影响;用流式细胞仪检测2-DG对血管内皮的凋亡影响。结果2-DG作用于人脐静脉内皮细胞后,对其增殖,迁移和成管能力有明显抑制作用,大大地增加细胞的凋亡率,且有显著剂量和时间依赖性。结论2-DG对HUVEC增殖、迁移和成管有显著的抑制作用,且能促使细胞凋亡。
2-脱氧-D-葡萄糖; 脐静脉内皮细胞; 血管瘤
血管瘤是婴幼儿最常见的先天性良性肿瘤,1岁以下发病率约为10%,早产儿或低体质量新生儿发病率可高达22%~30%[1]。血管瘤可发生于全身各处,约60%发生于头颈部。严重影响美观,甚至影响生理功能,威胁生命[2-3]。血管瘤的临床治疗包括激光、普萘洛尔等多种方法[4-5]。2-脱氧-D-葡萄糖(2-deoxy-glucose, 2-DG)是一种葡萄糖类似物,除了c-2端的-OH被-H取代外,其余结构与葡萄糖一致,它可以抑制内皮细胞的糖酵解途径和抑制其N-连接糖基化作用(R Datema, 1979年)[6],从而影响肿瘤生长的多个环节。血管瘤是以血管内皮细胞异常增殖为主要病理特征的良性血管病变[7],人脐静脉内皮细胞(human umbilical vein endothelial cells, HUVECs)和血管内皮细胞有相似的特性。我们利用HUVECs进行初步研究,观察2-DG对HUVECs增殖、迁移、成管及凋亡的作用。
1 对象与方法
1.1 主要材料 2-DG(美国SIGMA公司);人脐静脉内皮细胞株(北京清源浩生物公司);ECM培养基(美国SCIENCELL公司);胎牛血清、胰蛋白酶、二甲基亚砜(美国GIBCO公司);DMSO、MTT(美国SIGMA公司);Matrigel、流式细胞仪(美国BD公司);Annexin V-FITC凋亡检测试剂盒(北京宝赛生物技术有限公司);倒置显微镜(日本NIKON公司)。
1.2 分组 本实验分为空白对照组和2-DG试验组,试验组按照2-DG的浓度分为0.06、0.6、6、9 mM 2-DG处理组。
1.3 HUVECs的培养与传代 HUVEC购自北京清源浩生物公司,接种于T-75培养瓶(poly-l-lysine包被)内,加入ECM培养基,置于37 ℃,5%CO2的培养箱内,培养至细胞密度为90%时,用Trypsin-EDTA消化成细胞悬液,再传代于T-75培养瓶内,继续培养。将培养至3~6代的细胞用于实验。
1.4 四甲基偶氮唑盐比色法检测2-DG对HUVECs细胞增殖活性的影响 将HUVECs经Trypsin-EDTA消化后制成细胞悬液,记数,按每孔104个细胞接种于96孔培养板内,共接种9块板。常规培养24 h,待其贴壁后,向对照组和实验组分别加入0、0.06、0.6、6、9 mM 2-DG,继续常规培养,分别于第1~9天各取出一块板,每孔加入20 μl MTT,再放入孵箱中继续孵育4 h时,取出后吸掉孔内上清液,加入150 μl DMSO,震荡10 min,在酶联免疫仪上选择490 nm波长测各孔的吸光度值(OD值)。
1.5 倒置显微镜细胞形态学观察2-DG对HUVECs细胞生长和形态的影响 取对数生长的HUVECs,经Trypsin-EDTA消化后接种于用六孔板(poly-l-lysine包被)中,常规培养24 h,待细胞密度为90%,向对照组和实验组分别加入0、0.06、0.6、6、9 mM 2-DG,放入孵箱中继续培养,分别于0、24、48 h用OLYMPUS倒置显微镜拍照,观察细胞数量和形态变化。
1.6 体外划痕法检测2-DG对HUVECs迁移能力的影响 取对数生长的HUVECs,消化并接种到6孔板(poly-l-lysine包被)中,常规培养,待细胞密度为90%时,向每孔内加入20 μl丝裂霉素C,继续常规培养2 h,取出后用灭菌的1 ml枪头在每孔中心划十字线,吸掉培养基,用PBS液洗两遍,向对照组和实验组分别加入0、0.06、0.6、6、9 mM 2-DG,放入孵箱中培养,于0、12 h用OLYMPUS倒置显微镜拍照,统计。
1.7 Matrigel成管法检测检测2-DG对HUVECs成管能力的影响 用枪头(预冷)吸取50 μl Matrigel均匀铺到96孔板(预冷)中,放入培养箱,放置30 min,使Matrigel凝固后取出。取对数生长的HUVECs,消化后制成1×104/ml的细胞悬液,按每孔50 μl将其加入96孔板,向对照组和实验组分别加入0、0.06、0.6、6、9 mM 2-DG,继续常规培养,在0、12 h取出,用OLYMPUS倒置显微镜拍照,统计。
1.8 流式细胞仪检测2-DG对HUVECs凋亡影响
取对数生长的HUVECs,消化并接种于6孔板中,常规培养,待细胞密度为90%时,向对照组和实验组分别加入0、0.06、0.6、6、9 mM 2-DG,继续常规培养24 h,取出并消化,收集到15 ml离心管中离心(800 r/min,5 min),弃上清,用预冷的PBS洗2遍后再离心,取出用Bing Buffer(结合液)重悬细胞,调整细胞浓度为1×104/ml,置入流式专用管中,分别加入5 μl FITC Annexin V和5 μl PI进行处理,轻轻混匀细胞,室温避光孵育15 min,取出,每管加入400 μl Bing Buffer,用流式细胞仪检测并分析。
1.9 统计学处理 数据用SPSS 12.0统计软件处理分析,组间比较t检验,P<0.05为差异有统计学意义。
2 结果
2.1 MTT比色法检测2-DG对HUVECs活力的影响 用不同浓度2-DG处理HUVECs 72 h后取出,测得其在490 nm波长处的OD值,与对照组相比,HUVECs的细胞活力随着2-DG剂量的增加逐渐减小,0.06 mM 2-DG处理组只能小幅度抑制HUVECs的活力,而0.6 mM 2-DG处理组的细胞活力为49.6%,有明显的抑制作用;6、9 mM 2-DG处理组的抑制程度更加明显,均在60%以上。
2.2 倒置显微镜细胞形态学观察2-DG对HUVECs细胞数量和形态的影响 用不同浓度2-DG处理HUVECs,分别于0、24、48 h用OLYMPUS倒置显微镜拍照,观察细胞的数量和形态变化。对照组细胞生长良好,呈梭型,边界清楚,排列紧密,贴壁牢固,胞浆丰富,内含小颗粒,呈铺路石样生长,随着时间的变化,细胞形态和数量均无明显变化。实验组中,0.6 mM 2-DG作用HUVECs 24 h,细胞数量略少,细胞内出现发泡现象,体积变小,细胞质收缩,间隙增大,细胞形态发生少许变化,且少量细胞脱落和损伤;作用48 h,细胞数量明显减少,形态变化更加明显,且大量细胞受损脱落。随着2-DG浓度的增加或随着作用时间的延长,细胞数量减少且形态发生更加明显的变化。
2.3 2-DG抑制HUVECs的迁移能力 细胞迁移是血管瘤生长中内皮细胞血管形成重要的环节。12 h后对照组细胞已迁移至划痕区域(虚线内),几乎爬满整个划痕区域(图1),而9 mM 2-DG处理组仅有极少量细胞发生迁移(图2)。0.06 mM 2-DG处理组细胞迁移抑制率为26.4%,有统计学意义,随着2-DG剂量增大,抑制率随之增大, 6 mM 2-DG处理组细胞迁移抑制率大大增加,已超过50%(图3)。
2.4 2-DG抑制HUVECs的成管能力 HUVECs在Matrigel中能自发形成毛细血管状结构。对照组中HUVECs经过12 h可自发形成连接在一起的微管,而9 mM 2-DG处理组形成微管的能力较差,统计结果表明该浓度能显著抑制HUVECs的成管能力,低剂量2-DG处理组也能不同程度的抑制HUVECs微管形成。
2.5 流式细胞仪法测2-DG对HUVECs的凋亡影响影响 诱导内皮细胞凋亡是抑制血管瘤内皮细胞增殖的重要环节,本实验用Annexin V 和PI 双染色法通过流式细胞仪来分析2-DG对HUVECs的凋亡影响,如图4所示, 2-DG能诱导HUVECs的细胞凋亡,且随着2-DG剂量的增大HUVECs凋亡细胞的数量也随之增多,对照组细胞凋亡率为10.63%,0.6 mM 2-DG处理组比对照组上升4.77%,差异有统计学意义(P<0.01),6 mM和9 mM 2-DG处理组诱导细胞凋亡更加明显,凋亡率为21.77%和25.07%,比对照组上升了1倍多。
3 讨论
目前,血管瘤的病因有溶性细胞因子学说、基因突变学说、细胞凋亡学说、血管内皮祖细胞学说和缺氧学说等几种假说[8],但发病机制尚未确切,临床上多为经验性用药和对症性治疗,并无特效的根治方法。2-DG可以抑制多种肿瘤细胞的增殖、迁移和分化,且已经进入临床实验阶段,在肿瘤细胞中2-DG 主要通过以下两个方面来发挥作用:一方面,在缺氧的条件下,2-DG主要通过竞争性的抑制磷酸葡萄糖异构酶来抑制糖酵解途径,阻断了细胞获得ATP的主要来源,从而阻止细胞的快速增殖、迁移和分化;另一方面,无论是在有氧还是无氧的条件下,2-DG可通过抑制细胞的N-连接糖基化作用来抑制细胞的增殖、迁移和分化。2-DG联合化疗的抗肿瘤作用已被体内、体外实验证实(RI Aft, 2002年)[9-11], 2004年,有学者通过临床试验证实2-DG与多烯紫杉醇联合治疗实体瘤细胞的效果远远高于单独应用多烯紫杉醇[12]。在小鼠异种移植瘤模型和临床试验中,2-DG与放疗结合的疗效明显高于放疗单独作用的效果[13],口服2-DG的安全性和可行性也已经在肿瘤病人的早期临床治疗中得到验证[14]。
本实验通过2-DG体外细胞试验的检测,发现2-DG能显著抑制HUVECs的增殖、迁移和成管,使细胞形态发生明显改变,同时能诱导HUVECs的凋亡。在2-DG作用12 h时,可观察到2-DG有明显的抑制HUVECs成管和迁移的作用,在6 mM 2-DG作用下, HUVECs基本上不能形成管腔结构,当增加药物浓度时,镜下仅能观察到些许细胞团块;细胞处理12 h后,在镜下观察细胞的迁移情况时发现,对照组细胞基本爬满整个视野,而经6 mM 2-DG处理的实验组,细胞迁移率不超过50%。在2-DG作用24 h时,通过流式细胞试验检测凋亡蛋白,说明2-DG可以诱导细胞的凋亡,且随着剂量的增加,凋亡细胞所占比例也随之增大。通过细胞形态试验和MTT比色试验,发现随着时间的推移,活细胞的数量逐渐减少,形态亦发生显著改变,HUVECs体积变小、细胞质收缩,细胞膜尚完整,但细胞内可观察到发泡现象。在2-DG作用48 h时,HUVECs经0.6 mM 2-DG处理后,在OLYMPUS倒置显微镜下仅能观察到少量细胞存活,大部分细胞与孔板底部分离、脱落,随着2-DG浓度的增大,凋亡和坏死的细胞增多,活细胞数量更少,且有明显的细胞损伤。
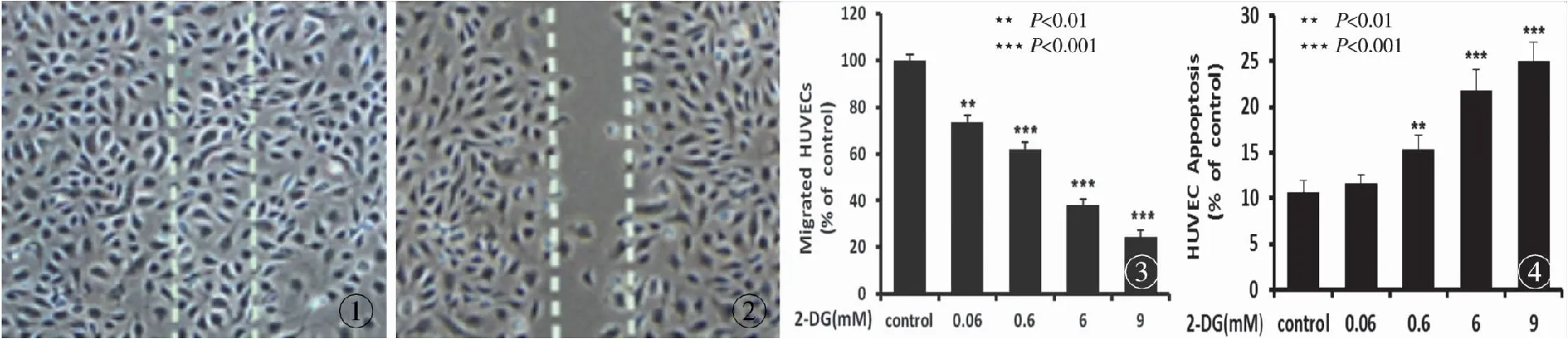
图1 对照组12 h后细胞迁移情况图2 9 mM 2-DG处理组12 h后细胞迁移情况图3 对照组与实验组12 h后的细胞迁移抑制率图4 对照组与实验组12 h后HUVECs的细胞凋亡率
Fig1 HUVECs cell migration in control group at 12 hours.Fig2 HUVECs cell migration in 9 mM 2-DG treated group at 12 hours.Fig3 Inhibition ratio (percentage) at 12 hours in the experimental and the control groups after 12 hours.Fig4 Apoptosis ratio (percentage) at 12 hours in the experimental and the control groups.
本研究结果显示,2-DG对HUVECs的增殖、迁移和管腔形成有明显的抑制作用,且能诱导其凋亡。为将2-DG用于血管瘤的防治进行了初步的探索。
[1] 中华口腔医学会口腔颌面外科专业委员会脉管性疾病学组. 口腔颌面部血管瘤治疗指南[J]. 中国口腔颌面外科杂志, 2011,1(9):61-67.
[2] Haggstrom AN, Drolet BA, Baselga E, et al. Prospective study of infantile hemangiomas: demographic, prenatal and perinatal characteristicsp[J]. J pediatr, 2007,150(3):291-294.
[3] Jia J, Zhao YF. Biomarkers: important clues to the pathogenesis of infantile haemangioma and their clinical significance[J]. Chin J Dent Res, 2010,13(2):105-108.
[4] Zhao JH, Zhang WF, Zhao YF. Sclerotherapy of oral and facial venous malformations with use of pingyangmycin and/or sodium morrhuate[J]. Int J Oral Maxillofac Surg, 2004,33(5):463-466.
[5] 郑家伟, 秦中平, 张志愿, 等. 口服皮质激素治疗婴幼儿口腔颌面部血管瘤[J]. 中国口腔颌面外科杂志, 2006,4(3):228-332.
[6] Kurtoglu M, Maher JC, Lampidis TJ. Differential toxic mechanisms of 2-deoxy-D-glucose versus 2-fluorodeoxy-D-glucose in hypoxic and normoxic tumor cells[J]. Antioxid Redox Signal, 2007,9(9):1383-1390.
[7] Tucci FM, De Vincentiis GC, Sitzia E, et al. Head and neck vascular anomalies in children[J]. Int J Pediatr Otorhinolaryngol, 2009,73(Suppl 1):S71-S76.
[8] Hochman M, Adams DM, Reeves TD. Current knowledge and management of vascular anomalies: I. Hemangiomas[J]. Arch Facial Plast Surg, 2011,13(3):145-151.
[9] Boutrid H, Jockovich ME, Murray TG, et al. Targeting hopoxia, a novel treatment for advanced retinoblastoma[J]. Invest Ophthalmol Vis Sci, 2008,49(7):2799-2805.
[10] Kurtoglu M, Gao N, Shang J, et al. Under normoxia, 2-deoxy-D-glucose elicits cell death in select tumor types not by inhibition of glycolysis but interfering with N-linked glycosylation[J]. Mol Cancer Ther, 2007,6(11):3049-3058.
[11] Maschek G, Savaraj N, Priebe W, et al. 2-Deoxy-D-Glucose inceases the efficacy of a driamycin and paclitaxel in human osteosarcoma and non-small cell lung cancers in vivo[J]. Cancer Res, 2004,64(1):31-34.
[12] Kurtoglu M1, Maher JC, Lampidis TJ. Differential toxic mechanisms of 2-deoxy-D-glucose versus 2-flurodeoxy-D-glucose in hypoxic and normoxic tumor cells[J]. Antionxid Redox Signal, 2007,90(9):1383-1390.
[13] Raez LE1, Papadopoulos K, Ricart AD, et al. A Phase I dose escalationtrial of 2-Deoxy-D-Glucose alone and in combination with docetaxel insubjects with advanced solid tumors[J]. Cancer Chemother Pharmacol, 2013,71(2):523-530.
[14] Stein M, Lin H, Jeyamohan C, et al. Targeting tumor metabolism with 2-deoxyglucose in Patients with castrateresistant prostate cancer and advanced malignancies[J]. Prostate, 2010,70(13):1388-1394.
Effectof2-Deoxy-D-glucoseonhumanumbilicalveinendothelialcell
CHENGJing,ZHANGGuan-hua,YICheng-gang,etal.
(InstituteofPlasticSurgery,XiJingHospital,TheFourthMilitaryMedicalUniversity,Xi′an710032,China)
ObjectiveTo explore the effects of 2 Deoxy D glucose on the proliferation, migration, capillary formation and apoptosis of human umbilical vein endothelial cells (HUVECs), searching a new medicine for hemangioma.MethodsMTT ,morphorlogical test and scratch test were used to detect HUVECs proliferation rate and mirgrating ability after 2-DG treatment. Tube formation matrigel assay and flow cytometry were performed for the capillary formation and endothelial apoptosis after the drug intervention respectively.ResultsAfter 2-DG was applied to HUVECs, the proliferation, migration, tube formation of HUVECs were inhibited significantly. The apoptosis rate of these cells increased and was highly time and dosage dependent.Conclusion2-DG inflicts negative effects on the proliferation and capillary formation of HUVECs, and induces apoptosis of HUVECs.
2-deoxy-glucose; Human umbilical vein endothelial cell; Hemangioma
10.3969/j.issn.1673-7040.2014.04.020
R732.2
A
1673-7040(2014)04-0248-04
2013-10-31)
710032 陕西 西安,第四军医大学西京医院 全军整形外科研究所
程 静(1987-),女,陕西咸阳人,住院医师,硕士研究生.
杨 力,710032,第四军医大学西京医院 全军整形外科研究所,电子信箱:yangli@fmmu.edu.cn
