p16基因高表达对293细胞衰老的影响*
2014-10-08马珊珊崔渊博王梦然郭天宇关方霞1
马珊珊,刘 静,姚 宁,崔渊博,邢 衢,王梦然,郭天宇,杨 波,关方霞1,
1)郑州大学生命科学学院干细胞实验室 郑州 450001 2)华东师范大学生命科学学院 上海 200241 3)中山大学生命科学学院 广州 510275 4)郑州大学第一附属医院 郑州 450052
衰老是机体的细胞、组织及器官在结构和功能上逐渐出现的不可逆转的全面退行性变化。目前研究[1]认为,衰老是干细胞衰退、DNA退化、饮食及精神因素、衰老基因活跃等综合作用的结果,但仍未形成统一的衰老理论。细胞衰老是受某些基因控制、借助于信号转导途径实现的,其中P16/Rb和P53控制的信号途径至关重要[2-4]。研究[5-6]发现,在衰老细胞中p16基因处于高表达水平。该研究首先构建p16基因高表达载体,然后将高表达载体转染293细胞,并观察p16基因高表达对293细胞增殖、细胞周期及衰老的影响,报道如下。
1 材料与方法
1.1 细胞 293细胞为郑州大学生命科学学院干细胞实验室保存的人肾上皮细胞,用含体积分数10%胎牛血清的DMEM/F12培养基于37℃、体积分数为5%的CO2饱和湿度培养箱中培养,常规传代。
1.2 主要试剂 Trizol和Lipofectamine2000均购自Invitrogen公司,RT-PCR试剂盒、逆转录试剂盒和β-半乳糖苷酶染色试剂盒均购自TaKaRa公司,Western blot相关试剂和抗体均购自北京鼎国生物技术有限公司。
1.3 p16基因高表达载体的构建 取对数生长期的293细胞,消化后离心,收集细胞,用Trizol提取细胞总RNA,然后用逆转录试剂盒将RNA逆转录成cDNA模板。根据p16 mRNA序列(GenBank登录号为:U26727.1)设计引物,RT-PCR扩增p16基因ORF序列(上游引物为5'-GCCGGAAGCTTATG GTGCGCAGGTTCTTGGT-3',下游引物为 5'-CTAAT GGTACCCAGCCAGGTCCACGGGCAGA-3',下划线碱基表示引入的酶切位点)。反应条件为:95℃预变性5 min;95℃变性30 s,63℃退火30 s,72℃延伸30 s,30个循环;72℃延伸5 min,4℃终止反应。然后将扩增片段酶切后插入到pEGFP-N1的HindⅢ和KpnⅠ位点之间,构成重组质粒 pEGFPN1-p16ORF。
1.4 p16基因高表达载体转染293细胞 用Lipofectamine2000将p16基因高表达载体转染293细胞,操作步骤严格按照说明书进行。将293细胞分为3组:正常组、空质粒组(转染pEGFP-N1)、高表达组(转染pEGFPN1-p16ORF),每组3个复孔。各组细胞均置于37℃、体积分数为5%的CO2饱和湿度培养箱中培养,48 h之后在荧光显微镜下观察GFP的表达情况。
1.5 CCK-8法检测p16基因高表达对293细胞增殖的影响 细胞分组及处理同1.4。各组细胞每天同一时间加入10 μL CKK-8溶液,于细胞培养箱中继续培养2 h,检测细胞在450 nm波长下的吸光度值,连续测6 d,记录数据,绘制细胞生长曲线。
1.6 PI染色法检测p16基因高表达对293细胞周期的影响 细胞分组及处理同1.4。培养24 h后消化、收集各组细胞并计数,调整细胞密度为2×106mL-1。取1 mL单细胞悬液,离心后去除上清,在细胞中加入2 mL体积分数为70%的冰乙醇固定过夜。用PBS洗去固定液,加入2.5 μL 10 g/L RNase A并置于37℃水浴30 min。避光加入PI染料,4℃30 min。上流式细胞仪检测细胞周期。
1.7 RT-PCR法检测各组293细胞中p16和p21 mRNA的表达 细胞分组及处理同1.4。首先采用Trizol法抽提各组细胞总RNA,逆转录合成cDNA,采用RT-PCR试剂盒并按说明进行操作,采用β-actin作为内参。引物序列见表1。反应条件:95℃30 s,95 ℃ 3 s,60 ℃ 30 s,40 个循环。数据分析采用比较CT法,mRNA相对表达量=2-ΔΔCT。
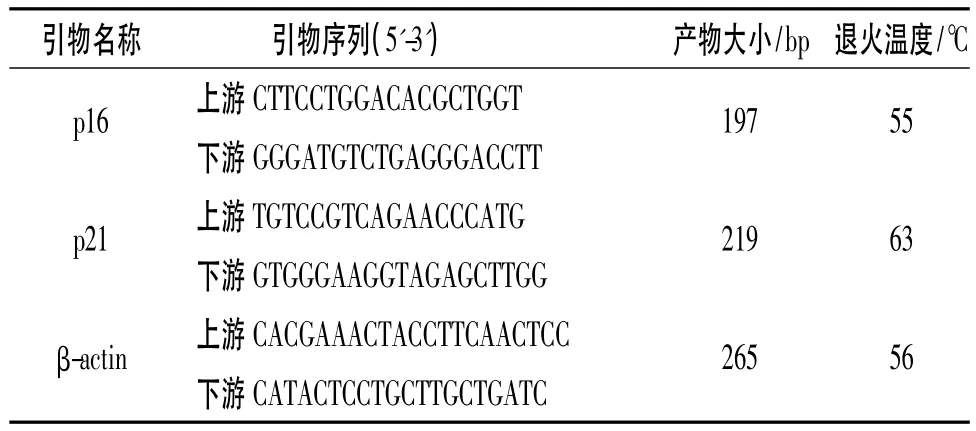
表1 引物序列
1.8 Western blot法检测各组293细胞中P16和P21蛋白的表达 细胞分组及处理同1.4。收集3组细胞,提取总蛋白。加入适量蛋白抽提试剂,冰上孵育30 min,让细胞充分裂解。蛋白样品中加入5×上样缓冲液,沸水中煮10 min,再迅速冰浴5 min,分装后置于-20℃保存备用。经SDS-PAGE凝胶电泳及转膜后于体积分数5%的脱脂牛奶中室温封闭1 h,加入鼠抗 P16一抗(1∶500稀释)、P21一抗(1∶1000稀释)过夜孵育,TBST洗膜3次,用辣根过氧化物酶标记的山羊抗鼠二抗在室温孵育2 h,TBST洗膜3次,ECL化学发光显影成像,最后用Image J图像分析软件进行蛋白灰度分析。
1.9 各组293细胞β-半乳糖苷酶表达的检测 细胞分组及处理同1.4。吸取各组细胞培养液,加入1 mL β-半乳糖苷酶染色固定液,室温固定10 min。去除细胞固定液,用PBS洗涤细胞3次,每次3 min。然后每孔加入1 mL染色工作液,37℃孵育2 h。普通光学显微镜下观察,蓝染细胞为衰老细胞。100倍镜下选取5个视野,观察并计算阳性细胞百分率。
1.10 统计学处理 采用 SPSS 19.0进行数据分析。3组间细胞周期分布、p16及p21 mRNA和蛋白相对表达量、β-半乳糖苷酶阳性细胞率的比较均采用单因素方差分析,两两比较采用LSD-t检验。检验水准 α =0.05。
2 结果
2.1 p16基因高表达载体转染293细胞 结果见图1。
2.2 p16基因高表达对293细胞增殖的影响 各组293细胞生长曲线见图2。
2.3 p16基因高表达对293细胞周期的影响 结果见表2。高表达组G0/G1期细胞增加,S期、G2/M期细胞减少。
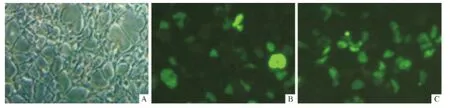
图1 各组293细胞GFP的表达(×100)
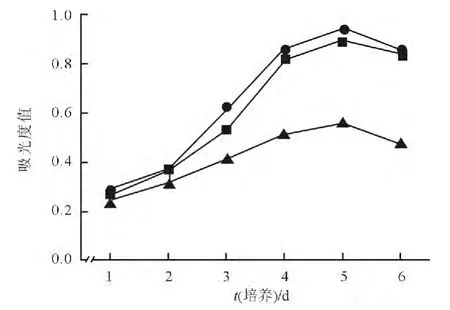
图2 各组293细胞的生长曲线
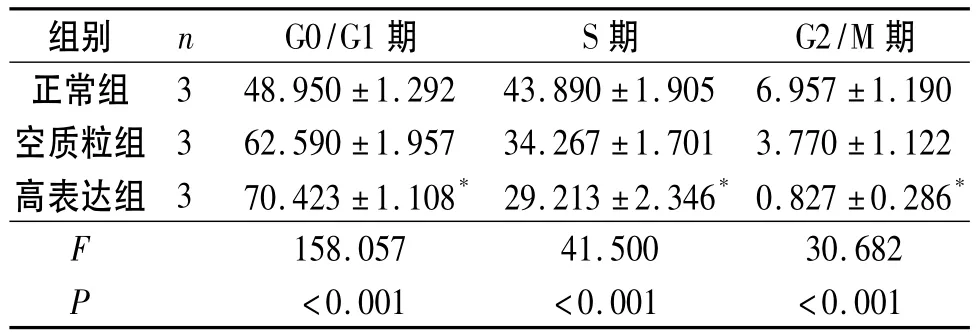
表2 各组293细胞周期的变化 %
2.4 RT-PCR检测各组293细胞中 p16和 p21 mRNA的表达 结果见表3。可知高表达组中p16和p21 mRNA的表达上升。
2.5 Western blot检测各组293细胞中P16和P21蛋白的表达 结果见图3和表4。可知,高表达组P16和P21蛋白的表达上升。
2.6 各组293细胞中β-半乳糖苷酶表达的检测高表达组293细胞β-半乳糖苷酶的表达上升(图4和表5)。

表3 各组293细胞中p16、p21 mRNA的表达
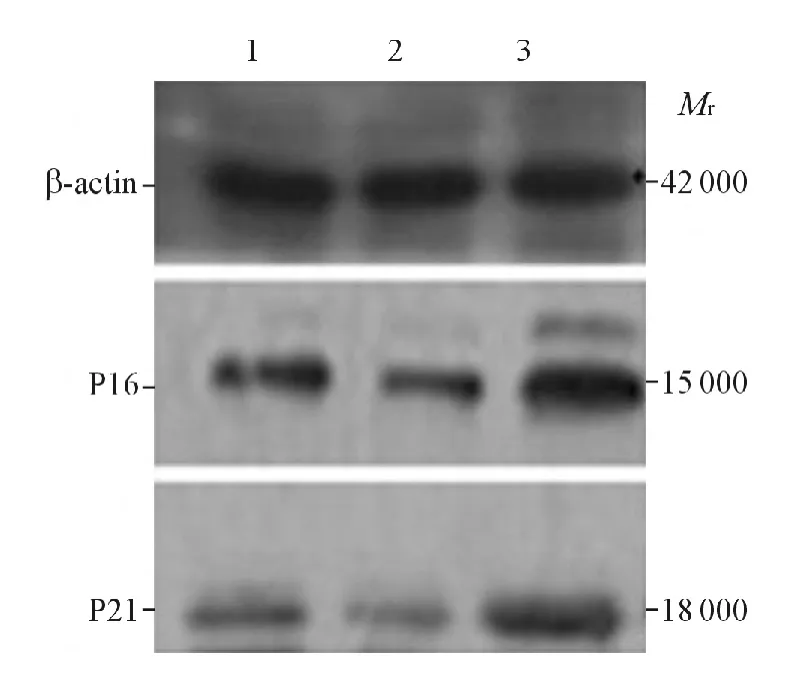
图3 各组293细胞中P16和P21蛋白的表达
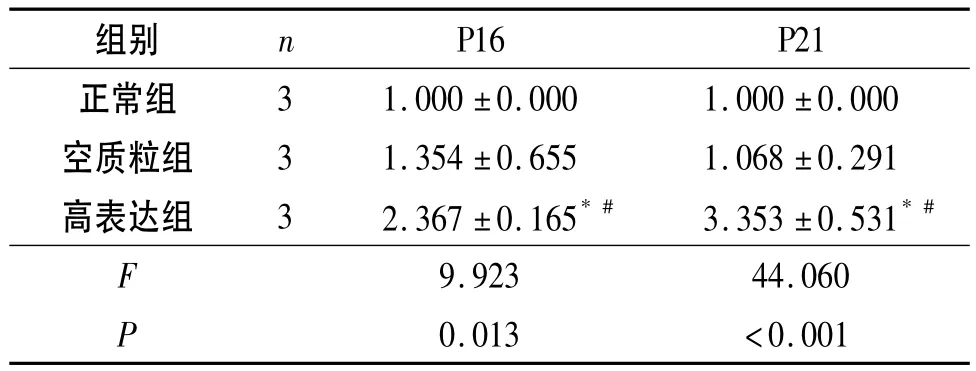
表4 各组293细胞中P16、P21蛋白的表达
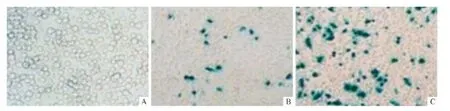
图4 各组293细胞β-半乳糖苷酶染色情况(×40)

表5 各组293细胞β-半乳糖苷酶阳性细胞率 %
3 讨论
Han等[7]研究发现P16蛋白能增加P21蛋白的稳定性,P21蛋白则通过转录因子Sp1激活p16基因的表达,二者协同抑制细胞周期。细胞周期的停滞是细胞衰老的前提,细胞衰老伴随着细胞形态的改变和相关基因表达的变化[6,8-10]。研究[11]表明利用脂质体介导p16 cDNA真核表达载体转入p16阴性的人红白血病细胞株后,细胞增殖受到抑制,凋亡率增加。该实验将p16基因高表达载体转染至293细胞,结果显示p16基因高表达抑制了293细胞的增殖并将细胞阻滞在G0/G1期,而且p16基因高表达可以上调细胞衰老相关基因 p21的表达,说明p16基因可能通过促进p21基因的表达导致细胞衰老。
细胞衰老的指标中,除p21表达升高外,β-半乳糖苷酶的表达亦升高。有研究[12]发现体外培养的人二倍体成纤维细胞在pH为6时,其β-半乳糖苷酶阳性率随着代龄增加而增加,因此β-半乳糖苷酶是目前公认的检测细胞衰老的金标准。该实验中作者发现p16基因高表达载体导致293细胞中β-半乳糖苷酶阳性细胞率上升,说明细胞已呈现衰老状况。
总之,该研究说明p16基因在细胞衰老过程中发挥调控作用,并初步建立了p16基因高表达的细胞衰老模型,为进一步研究细胞衰老的机制奠定了基础。
[1]Blagosklonny MV.Cell senescence and hypermitogenic arrest[J].EMBO Rep,2003,4(4):358
[2]闫海龙,龚勇珍.氧化应激及p16和p53/p21与细胞衰老关系的研究进展[J].医学综述,2011,17(5):682
[3]Janzen V,Forkert R,Fleming HE,et al.Stem-cell ageing modified by the cyclin-dependent kinase inhibitor p16INK4a[J].Nature,2006,443(7110):421
[4]王文恭.细胞衰老过程中p16INK4 mRNA稳定性调控[J].生理科学进展,2013,44(3):213
[5]Haferkamp S,Becker TM,Scurr LL,et al.p16INK4a-induced senescence is disabled by melanoma-associated mutations[J].Aging Cell,2008,7(5):733
[6]Leontieva OV,Blagosklonny MV.CDK4/6-inhibiting drug substitutes for p21 and p16 in senescence:duration of cell cycle arrest and MTOR activity determine geroconversion[J].Cell Cycle,2013,12(18):3063
[7]Han XL,Wu FG,Zhang ZY,et al.Posttranscriptional induction of p21Waf1 mediated by ectopic p16INK4 in human diploid fibroblast[J].Chin Med J,2007,120(5):405
[8]Hong H,Takahashi K,Ichisaka T,et al.Suppression of induced pluripotent stem cell generation by the p53-p21 pathway[J].Nature,2009,460(7259):1132
[9]刘凌,王雪妮,刘泽,等.枸杞多糖对血管紧张素Ⅱ诱导的血管内皮细胞衰老及P53和P16表达的影响[J].南方医科大学学报,2011,31(7):1212
[10]余明蔚,王文恭.氧化应激诱导的细胞衰老过程中细胞生长相关基因的表达[J].中国生物化学与分子生物学报,2012,28(2):164
[11]Burd CE,Sorrentino JA,Clark KS,et al.Monitoring tumorigenesis and senescence in vivo with a p16(INK4a)-luciferase model[J].Cell,2013,152(1/2):340
[12]Itahana K,Campisi J,Dimri GP.Methods to detect biomarkers of cellular senescence:the senescence-associated betagalactosidase assay[J].Methods Mol Biol,2007,371:21
