过氧化物酶体增殖物激活受体γ在保护大鼠脑缺血中的作用
2014-09-04祝春华王力娜河北医科大学第二医院神经内科河北石家庄050000
祝春华,温 雅,王力娜,季 辉,杨 燚,刘 莹 (河北医科大学第二医院神经内科,河北 石家庄 050000)
·论著·
过氧化物酶体增殖物激活受体γ在保护大鼠脑缺血中的作用
祝春华,温 雅,王力娜,季 辉,杨 燚,刘 莹
(河北医科大学第二医院神经内科,河北 石家庄 050000)
目的探讨过氧化物酶体增殖物激活受体γ(peroxisome proliferator-activated receptor gamma,PPARγ)对大鼠脑缺血的保护作用及其机制。方法线栓法建立大鼠右侧大脑中动脉闭塞(middle cerebral artery occlusion,MCAO)模型。实验分为假手术组、溶剂对照组、替米沙坦组、替米沙坦+GW9662组。采用Western Blot和RT-PCR观察大鼠脑缺血后24h时PPARγ、色素上皮源性生长因子(pigment epithelium-derived factor,PEDF)、基质金属蛋白酶9(matrix metalloproteinase-9,MMP-9)的基因和蛋白表达变化,采用干湿法测定各组脑组织含水量,采用TTG染色法测定患侧脑梗死体积,采用改良Longna分级法评价神经功能。结果MCAO后24h,溶剂对照组PPARγ、PEDF表达明显减少,而MMP-9显著增加;替米沙坦组替米沙坦激活PPARγ能够上调PEDF、下调MMP-9,并明显改善神经功能缺失,减轻脑水肿,减小梗死体积,保护缺血脑组织;替米沙坦+GW9662组合并应用PPARγ特异性阻断剂GW9662显著逆转上述保护作用。结论PPARγ是调控脑缺血后炎症反应的关键性因子,激活PPARγ途径可能成为治疗脑缺血的新靶点。
脑缺血;过氧化物酶体增殖物激活受体;基质金属蛋白酶9
10.3969/j.issn.1007-3205.2014.09.001
炎症反应是脑缺血后继发性脑损伤的最重要原因之一,早期快速有效控制炎症反应能够显著减轻脑损伤[1]。过氧化物酶体增殖物激活受体γ(peroxisomeprolixferator-activatedreceptorsgamma,PPARγ)是关键性核转录因子,在抗炎、抗氧化、神经保护等方面表现出独特优势,尤其是在保护缺血脑组织方面作用突出[2-3]。PPARγ能够有效调节下游炎症因子,如色素上皮源性生长因子(pigmentepithelium-derivedfactor,PEDF)和基质金属蛋白酶9(matrixmetalloproteinases-9,MMP-9)等,抑制炎症反应。本研究选择PPARγ激动剂替米沙坦及其特异性阻断剂GW9662等干预治疗脑梗死大鼠,观察其脑水肿、脑缺血体积和神经功能缺失改善情况,探讨PPARγ保护缺血脑组织的详细机制。
1 资料与方法
1.1 动物与试剂
1.1.1 实验动物:成年雄性清洁级SD大鼠84只,体质量250~280g,由河北省实验动物中心提供。
1.1.2 试剂和仪器:兔抗PPARγ、抗PEDF多克隆抗体(美国SantaCraz);兔抗MMP-9单克隆抗体(英国Abcam公司);替米沙坦(德国Boehringer-Ingelheim);GW9662(美国Sigma);电泳仪DYY-12型(北京六一仪器厂);多功能酶标仪Synergy-HT(美国Bio-Tek);聚合酶链反应扩增仪(德国Eppendorf);荧光定量PCR仪7500(美国ABI)。
1.1.3 引物设计与合成:上海生物工程公司合成,引物序列如下。PPARγ,扩增产物的DNA全长为207bp,引物序列,上游5′-GAAGACATCCCGTTCA-CAAGA-3′,下游5′-TGATGCTTTATCCCCACAGAC-3′;MMP-9,扩增产物的DNA全长为187bp,引物序列,上游5′-CAGATGATGGGAGAGAAGCAG-3′,下游5′-TGTTATGATGGTGCCACTTGA-3′;PEDF,扩增产物的DNA全长为200bp,引物序列,上游5′-CTGTGAGAGTCCCCATGATGT-3′,下游5′-AGGGG-CAGGAAGAAGATGATA-3′;β-actin,扩增产物的DNA全长为150bp,引物序列,上游5′-GGAGATTA-CTGCCCTGGCTCCTA-3′,下游5′-GACTCATCGTAC-TCCTGCTTGCTG-3′。
1.2 实验方法
1.2.1 动物分组和模型:随机将SD大鼠84只分为假手术组、溶剂对照组、替米沙坦组、替米沙坦+GW9662组。线栓法建立大鼠永久性右侧大脑中动脉闭塞(middlecerebralarteryocclusion,MCAO)模型。手术前1h给予替米沙坦溶于生理盐水(30mg/kg)灌胃,并给予GW9662(4mg/kg)腹腔注射。术后24h处死,留取脑组织标本。
1.2.2 神经功能评分;处死之前,采用改良的Longa分级法单盲进行行为学评分。0分,无缺陷;1分,不能伸展对侧前肢;2分,对侧前肢屈曲;3分,轻度向对侧转圈;4分,严重向对侧转圈;5分,向对侧跌倒(n=6)。
1.2.3 测定脑组织含水量:断头取脑,冠状切开去除额极,取双侧脑组织约2mm厚,采用干湿法测定脑组织含水量,脑组织含水量=(湿质量-干质量)/湿质量×100% (n=8)。
1.2.4 测定脑梗死体积:断头取脑,均匀切成5片冠状切片,浸入2% 2,3,5-氧化三苯基甲氮唑溶液,37℃染色30min后4%多聚甲醛中固定24h。梗死体积(百分比)=(矫正梗死体积/非缺血侧半球体积)×100% (n=6)。
1.2.5PEDF和PPARγ蛋白和基因表达:取各实验组动物梗死侧皮层脑组织,置-80℃冻存备用。采用WesternBlot检测PPARγ、PEDF和MMP-9蛋白表达,计算PPARγ/β-actin、PEDF/β-actin和MMP-9/β-actin比值(n=4)。采用反转录-聚合酶链反应检测PPARγ、PEDF和MMP-9mRNA表达,内参基因β-actin,得到目的基因表达的CT值,与对照组相比,我们采用2-△△CT法进行相对定量分析(n=3)。
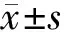
2 结 果
2.1 替米沙坦激活PPARγ改善神经功能:术后24h,假手术组行为学评分均为0分。与溶剂对照组(4.00±0.81)分和替米沙坦+GW9662组(3.76±0.68)分比较,替米沙坦组(2.40±1.32)分,神经功能障碍明显改善(F=2.482,P<0.05);溶剂对照组与替米沙坦+GW9662组之间差异无统计学意义(P>0.05)。
2.2 替米沙坦激活PPARγ显著减轻患侧脑水肿:术后24h,替米沙坦组、溶剂对照组和替米沙坦+GW9662组3组患侧脑组织有明显的水肿(P<0.05);与溶剂对照组和替米沙坦+GW9662组比较,替米沙坦组患侧脑水肿明显减轻(P<0.05)。对侧脑组织含水量4组之间无差别,见表1。


GroupsIpsilateralContralateralSham78.22±0.3978.88±0.47Vehicle84.09±0.55∗78.11±0.30Telmisartan82.08±0.77∗#78.54±0.67Telmisartan+GW966286.04±0.69∗78.74±0.63 F2.920 P0.027
*P< 0.05vssham group #P< 0.05vsvehicle and telmisartan+GW9662 group byqtest
2.3 替米沙坦激活PPARγ显著减小脑梗死体积:与溶剂对照组(53.42±7.09)%和替米沙坦+GW9662组(44.94±7.95)%比较,替米沙坦组(35.08±3.09)%缺血性病灶体积明显减小(F=1.317,P<0.05);替米沙坦+GW9662组与溶剂对照组比较病灶大小差异无统计学意义(P>0.05)。
2.4 替米沙坦激活PPARγ上调PEDF 、下调MMP-9蛋白和基因表达:Western Blot和实时定量PCR结果显示,相比假手术组,溶剂对照组和替米沙坦+GW9662组PEDF和PPARγ蛋白以及基因表达明显下降(P<0.05),MMP-9表达明显增加(P<0.05);替米沙坦组与溶剂对照组和替米沙坦+GW9662组比较,PEDF和PPARγ蛋白以及基因表达明显上调,MMP-9表达明显下调(P<0.05)。见表2,3和图1。


GroupsPPARγPEDFMMP⁃9Sham0.368±0.1130.904±0.5030.003±0.001Vehicle0.070±0.032∗0.121±0.062∗0.103±0.030∗Telmisartan0.284±0.084#0.842±0.470#0.042±0.023#Telmisartan+GW96620.073±0.043∗0.180±0.141∗0.081±0.011∗ F2.1982.3112.299 P0.0140.0160.031
*P< 0.05vssham group #P< 0.05vsvehicle and telmisartan+GW9662 group byqtest
PPARγ:peroxisome proliferator-activated receptor gamma;PEDF:pigment epithelium-derived factor;MMP-9:matrix metalloproteinase-9

图1 替米沙坦调节PEDF和MMP-9蛋白
Figure 1 Telmisartan regulates PEDF and MMP-9 protein by Western Blot


GroupsPPARγPEDFMMP⁃9Sham1.000±0.2511.000±0.3931.000±1.260Vehicle0.161±0.022∗0.174±0.038∗10.731±5.833∗Telmisartan0.709±0.168#0.851±0.315#2.117±1.082#Telmisartan+GW96620.210±0.143∗0.266±0.147∗9.068±1.981∗ F2.6942.8882.183 P0.0290.0180.011
*P< 0.05vssham group #P< 0.05vsvehicle and telmisartan+GW9662 group byqtest
PPARγ: peroxisome proliferator-activated receptor gamma;PEDF: pigment epithelium-derived factor;MMP-9: matrix metalloproteinase-9
3 讨 论
本研究结果显示,脑缺血早期PPARγ和PEDF 表达明显减少,MMP-9明显增多,显著的炎症反应伴有脑水肿和神经功能缺失出现;替米沙坦激活PPARγ上调PEDF、下调MMP-9水平,显著减轻脑水肿,减小脑缺血体积,改善神经功能,而PPARγ特异性阻断剂GW9662阻断了上述作用。因此,PPARγ作为上游核转录因子上调PEDF 、下调MMP-9表达,在脑缺血后炎症反应过程中发挥关键性调控作用,减轻继发性脑损伤。
PPARγ是核激素受体超家族过氧化物酶体增殖物激活受体 (peroxisome proliferator-activated receptors,PPARs)的3个亚型之一。作为配体依赖性的核转录因子,活化的PPARγ因在调节糖类吸收、脂肪代谢、细胞增殖和分化、免疫调节、炎症反应等机制方面作用突出而备受关注。国内外研究[2-7]发现,PPARγ还参与脑缺血后炎症反应和神经保护等过程,激活的PPARγ能够显著减小实验动物脑梗死体积,抑制脑缺血后炎症反应,促进神经保护因子的表达,减轻继发性脑损伤。研究[7-8]证明,敲除PPARγ基因,实验动物脑缺血体积显著增大。进一步证明PPARγ在脑缺血后继发性脑损伤中发挥至关重要作用。
替米沙坦是临床常用的血管紧张素受体阻断剂类抗高血压药物。近年国内外研究认定,替米沙坦是PPARγ的激活剂[9]。经过大量的实验研究证明,替米沙坦对脑缺血具有明确的保护作用,其作用不仅通过经典的肾素-血管紧张素-醛固酮途径,而且多通过依赖激活的PPARγ减轻炎症反应,显著减小脑缺血体积[2,10-11]。
本研究结果证明,PPARγ是调控脑缺血后炎症反应的关键性核转录因子,这仅仅是PPARγ复杂调控机制中的一部分,仍有大量工作需要完成。通过激活PPARγ可能成为治疗脑缺血的理想靶点。
[1] DONG L,QIAO H,ZHANG X,et al.Parthenolide is neuroprotective in rat experimental stroke model:downregulating NF-κB,phospho-p38MAPK,and caspase-1 and ameliorating BBB permeability[J].Mediators Inflamm,2013,2013:370804.
[2] XU F,LI J,NI W,et al.Peroxisome proliferator-activated receptor-γ agonist 15d-prostaglandin J2 mediates neuronal autophagy after cerebral ischemia-reperfusion injury[J].PLoS One,2013,8(1): e55080.
[3] HARAGUCHI T,IWASAKI K,TAKASAKI K,et al.Telmisartan,a partial agonist of peroxisome proliferator-activated receptor gamma,improves impairment of spatial memory and hippocampal apoptosis in rats treated with repeated cerebral ischemia[J].Brain Res,2010,1353(24):125-132.
[4] LEE SR,KIM HY,HONG JS,et al.PPARgamma agonist pioglitazone reduces matrix metalloproteinase-9 activity and neuronal damage after focal cerebral ischemia[J].Biochem Biophys Res Commun,2009,380(1):17-21.
[5] WU JS,LIN TN,WU KK.Rosiglitazone and PPAR-gamma overexpression protect mitochondrial membrane potential and prevent apoptosis by upregulating anti-apoptotic Bcl-2 family proteins[J].J Cell Physiol,2009,220(1): 58-71.
[6] COLLION M,ARAGNO M,MASTROCOLA R,et al.Modulation of the oxidative stress and inflammatory response by PPAR-γ agonists in the hippocampus of rats exposed to cerebral ischemia/reperfusion[J].Eur J Pharmacol,2006,530(1/2):70-80.
[7] SCHOCK SC,XU J,DUQUETTE PM,et al.Rescue of neurons from ischemic injury by peroxisome proliferator activated receptor-gamma requires a novel essential cofactor LMO4[J].J Neurosci,2008,28(47): 12433-12444.
[8] ZHAO X,STRONG R,ZHANG J,et al.Neuronal PPARgamma deficiency increases susceptibility to brain damage after cerebral ischemia[J].J Neurosci,2009,29(19):6186-6195.
[9] ZENG XC,LI XS,WEN H.Telmisartan protects against microvascular dysfunction during myocardial ischemia/reperfusion injury by activation of peroxisome proliferator-activated receptor γ[J].BMC Cardiovasc Disord,2013,13:39.
[10] KASAHARA Y,TAGUCHI A,UNO H,et al.Telmisartan suppresses cerebral injury in amurine model of transient focal ischemia[J].Brain Res,2010,1340(22):70-80.
[11] KOBAYASHI T,KAWAMATA T,SHIBATA N,et al.Angiotensin Ⅱ type 1 receptor blocker telmisartan reduces cerebral infarct volume and peri-infarct cytosolic phospholipase A(2) level in experimental stroke[J].J Neurotrauma,2009,26(12):2355-2364.
(本文编辑:刘斯静)
本刊关于录用稿件签单的规定
根据《中华人民共和国著作权法》等有关法律、法规的规定,为了扼制一稿两投(多投)、论文剽窃以及论文抄袭等学术不端行为,本刊决定对录用稿件实行签单程序,即凡本刊录用稿件均需由全体作者、通讯作者、在读硕(博)士研究生第一导师、第一作者所在单位共同签属《<河北医科大学学报>论文专有使用权授权书》。
《河北医科大学学报》编辑部
PROTECTIVEROLEOFPEROXISOMEPROLIFERATOR-ACTIVATEDRECEPTORGAMMAINRATBRAINAGAINSTFOCALCEREBRALISCHEMIA
ZHUChunhua,WENYa,WANGLina,JIHui,YANGYi,LIUYing
(DepartmentofNeurology,theSecondHospitalofHebeiMedicalUniversity,Shijiazhuang050000,China)
ObjectiveThisstudyistoexploreperoxisomeproliferator-activatedreceptorgamma(PPARγ)protectingratbrainagainstfocalcerebralischemicstrokeanditsmechanism.MethodsMaleSprague-Dawleyratsweresubjectedtopermanentmiddlecerebralarteryocclusion(MCAO).Sprague-Dawleyratswererandomlydividedintofourgroupssham-operatedgroup,vehiclegroup,telmisartangroup,andtelmisartan+GW9662group.At24hafterfocalcerebralischemia,theexpressionofPPARγ,pigmentepithelium-derivedfactor(PEDF),matrixmetalloproteinase-9(MMP-9)wereexploredbywesternblotandRT-PCR.Thewatercontentofbraintissuewasmeasuredbydry-wetweightmethod,theinfarctvolumewasdetectedbyTTCstain,andthenervefunctionswereevaluatedwiththeimprovedLongvamethod.ResultsAt24hafterMCAOPPARγandPEDFexpressionsignificantlydecreased,whileMMP-9increasedinvehiclegroup.TelmisartanactivatingPPARγdramaticallyup-regulatedPEDFanddown-regulatedMMP-9,alleviatedtheneurologicaldeficits,brainwatercontentandinfarctvolumeintelmisartan+GW9662group,whichwereallabolishedbyGW9662blockingPPARγasshownintelmisartan+GW9662group.ConclusionPPARγisthekeyfactorinmodulatingtheinflammatoryreactionssecondarytofocalcerebralischemia.PPARγmightbethepotentialtherapeutictargetforfocalcerebralischemia.
brainischemia;peroxisomeproliferator-activatedreceptors;matrixmetalloproteinases9
2014-04-02;
2014-07-05
祝春华(1978-),女,河北唐山人,河北医科大学第二医院主治医师,医学博士,从事脑血管疾病诊治研究。
R743.31
A
1007-3205(2014)09-0993-04
