丙型肝炎病毒HLA-A*1101和A*2402限制性CD8+T细胞表位的研究
2014-08-08钟晓芝段志良郭江龙李强王思娜李静林荣文金生
钟晓芝,段志良,郭江龙,李强,王思娜,李静,林荣,文金生
丙型肝炎病毒(hepatitis C virus,HCV)为有 包膜的单股正链RNA病毒,其基因组编码三个结构蛋 白(C、E1和E2)和七个非结构蛋白(P1、NS2、NS3、NS4a、NS4b、NS5a和NS5b)[1]。HCV感染肝脏后引起急性丙型肝炎,可发展成慢性肝炎、肝硬化,甚至肝细胞癌。目前全球已有约1.7亿丙型肝炎患者[2]。由于临床上丙型肝炎治疗效果不太理想,因而,研发有效的疫苗仍是目前HCV研究的重点和热点。
有研究表明:HCV特异性抗体无保护作用,而活化的CD8+T细胞是控制HCV感染和清除细胞内感染病毒的决定因素[3-4]。因此,能诱导特异性CD8+T细胞反应的CD8+T细胞表位肽疫苗是一种很有希望的候选疫苗。HLA-A的三种等位基因HLA-A*0201、A*1101和A*2402在不同种族人群中总百分率均大于90%[5],因此由三种等位基因限制性表位组成的CD8+T细胞表位肽疫苗具有广泛的人群覆盖率。在前期研究中,我们课题组以及国外研究人员已鉴定出了大量HCV特异性HLA-A*0201限制性CD8+T细胞表位[6-9],但HLA-A*1101及A*2402限制性细胞表位的报道则寥寥无几。本研究拟鉴定HCV特异性HLA-A*1101和A*2402限制性CD8+T细胞表位,为研发具有广泛人群覆盖性的CD8+T细胞表位肽疫苗奠定基础。
1 材料和方法
1.1 材料 未感染HCV的健康志愿者招募自温州医科大学在校研究生,HCV基因型1b感染者血液由瑞安市人民医院检验科及温州市中心血站提供,人淋巴细胞分离液购自天津市灏洋生物制品科技有限责任公司,人γ-干扰素(IFN-γ)酶联免疫斑点(ELISPOT)试剂盒购自荷兰U-CyTech公司,APC标记抗人CD3、FITC标记抗人CD8a和PE标记抗人IFN-γ的流式单抗购自美国Biolegend公司,ELISPOT分析仪来自北京赛智创业科技有限公司,FACS Calibur流式细胞仪来自美国BD bioscience公司。
1.2 方法
1.2.1 候选CD8+T细胞表位的预测及其合成:基于HCV基因型1b(AF165064)的氨基酸序列,采用T细胞表位预测软件SYFPEITHI(http://www.syfpeithi.de/Scripts/MHCServer.dll/EpitopePrediction.htm)预测HCV特异性HLA-A*1101及A*2402限制性候选CD8+T细胞表位[10-11]。选择候选表位的标准如下:①候选表位具有较高的预测得分;②通过Blast检索,候选表位在1b基因型中高度保守;③候选表位C-末端残基是蛋白酶体裂解预测结果。FITC标记的已报道HLA-A*1101限制性表位肽NS4b_147(GVAGALVAFK)[12]和FITC标记的已报道HLA-A*2402限制性表位肽NS4b_49(FWAKHMWNF)[13]用作阳性表位肽。委托上海强耀生物科技有限公司合成候选表位肽及阳性表位肽(纯度>95%)。肽溶于PBS(1 mg/mL),储存于-80 ℃。
1.2.2 永生化的HLA-A*1101阳性、A*2402阳性B细胞株的建立:设计扩增HLA-A*1101和A*2402的引物。在健康志愿者签署了知情同意书后,抽取每人1 mL EDTA抗凝的外周静脉血,采用DNA提取试剂盒提取DNA。基于上述引物,采用PCR仪扩增HLA-A*1101和 A*2402,PCR产物采用2%琼脂糖凝胶电泳。采集HLAA*1101阳性、A*2402阳性者的10 mL EDTA抗凝外周静脉血,采用人淋巴细胞分离液分离外周血单个核细胞(PBMCs),将PBMCs悬浮于RPMI-1640培养基中并置于细胞培养板孔中。传代培养B95-8细胞(感染EB病毒的绒猴白细胞,其培养上清中含有大量具有转化B细胞作用的EB病毒基因),将其培养上清加入PBMCs中诱导B细胞永生化[14]。
1.2.3 竞争性肽结合实验:大量培养上述永生化的 HLA-A*1101阳性、A*2402阳性B细胞,收集细胞。用 枸橼酸(0.131 mol/L枸橼酸和0.061 mol/L磷酸氢 二钠,pH 3.2)处理细胞90 s以洗脱表面HLA-A*1101、 A*2402分子肽结合凹槽中结合的肽[15]。细胞经PBS洗涤后分成以下管:阴性对照管(无肽),细胞在无候选表位肽和阳性表位肽的情况下于37 ℃孵育 6 h;实验管,细胞中加入不同浓度(1μg/mL、10 μg/mL、100μg/mL)的候选表位肽和FITC标记的HLA-A*1101限制性或A*2402限制性阳性表位肽(NS4b_147或NS4b_49,均为30μg/mL),于37 ℃孵 育6 h;阳性对照管,细胞同FITC标记阳性表位肽 (NS4b_147或NS4b_49,均为30μg/mL)于37 ℃孵育 6 h。采用流式细胞仪测定细胞平均荧光强度(MFI)。下述公式用于计算候选表位肽对阳性表位肽的百分抑制率(percentage inhibition,PI)。PI>50%表示候选表位肽与HLA-A*1101或A*2402有高结合力。
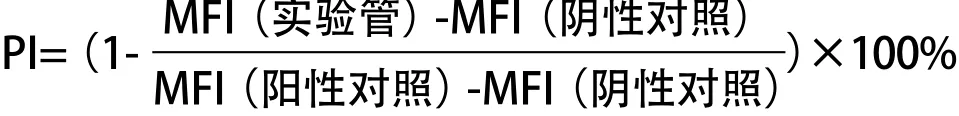
1.2.4 ELISPOT检测HCV感染者PBMCs中肽特异性分泌IFN-γ的细胞:6例HLA-A*1101阳性HCV-1b感染者和6例HLA-A*2402阳性HCV-1b感染者(ELISA-IgM试剂盒证实为HCV感染,HCV基因型特异性RT-PCR证实为HCV基因型1b感染[16])来自瑞安市人民医院检验科及温州市中心血站,在研究对象签署了知情同意书后,抽取每人10 mL EDTA抗凝的外周静脉血。采用人淋巴细胞分离液分离PBMCs,用RPMI-1640培养基(含2 mmol/L L-谷氨酰胺,100 U/mL青霉素,100μg/mL链霉素和10%胎牛血清)悬浮PBMCs。ELISPOT实验简单过程如下:将1×105PBMCs(悬浮 于100 μL RPMI-1640培养液)加入人IFN-γ ELISPOT试剂盒(预包被的PVDF膜96孔板)每孔中,设置阴性对照孔(加PBMCs而不加多肽),多肽刺激孔(加PBMCs同时加入多肽,其终浓度为10μg/mL),每个处理因素均设置2孔。将ELISPOT板放于37 ℃、5% CO2培养箱中培养24 h。弃去每孔细胞及液体,洗板4次后,每孔加入100μL生物素化抗IFN-γ的检测抗体,于37 ℃培养1 h。弃去孔中液体,洗板4次后,每孔加入100μL辣根过氧化物酶(HRP)标记的链酶亲和素,于37 ℃培养1 h(避光)。弃去孔中液体,洗涤4次后,每孔加入100μL现配的ACE显色液,于37 ℃反应15~20 min(避光)。移除每孔中液体,用去离子水冲洗板。采用ELISPOT斑点分析仪对每孔斑点计数,一个斑点代表一个斑点形成细胞(SFC),斑点数表示为SFCs/1×105PBMCs。减去阴性对照孔斑点数后,肽刺激孔斑点数≥5 SFCs/1×105PBMCs时,结果判读为阳性[17]。
1.2.5 细胞内细胞因子染色(ICS)检测HCV感染者PBMCs中肽特异性IFN-γ+CD8+T细胞:5×105PBMCs(悬浮于500μL RPMI-1640营养液)加入EP管中,设置阴性对照管(无肽)和肽刺激管(多肽的终浓度为10μg/mL)。细胞管中加入布雷菲德菌素A(BFA)使其达到终浓度为10μg/mL,于37 ℃、5% CO2培养箱中培养6 h。PBS洗涤细胞后,采用4%的多聚甲醛于4 ℃固定20 min。PBS洗涤细胞后,采用1%皂素悬浮细胞,然后加入APC标记抗人CD3、FITC标记抗人CD8a和PE标记抗人IFN-γ的单抗,避光于4 ℃孵育40 min。PBS洗涤细胞后,采用流式细胞仪检测CD8+T细胞中IFN-γ+CD8+T细胞的百分率。
1.3 统计学处理方法 采用SPSS 17.0软件统计。数据用±s来表示,组间比较采用t检验。P<0.05为差异有统计学意义。
2 结果
2.1 候选CD8+T细胞表位与HLA-A*1101、A*2402分子的结合实验 根据SYEPEITHI预测结果,我们选择了5条HLA-A*1101限制性候选表位[E1_61(SIPTTTIRR)、 NS3_609(ITLTHPITK)、NS2_165(VVFSDMETK)、NS3_ 351(GKAIPLEVIK)和NS5b_251(QVIRSLTER)]和3条HLA-A*2402限制性候选表位[NS3_373(KCDELASKL)、NS5b_382(YYLTRDPTI)和NS5b_451(TYSIEPLDL)]并委托多肽合成公司加以合成。液相色谱和质谱结果均证实合成多肽为目的肽,肽的实际纯度均>95%。候选表位肽和阳性表位肽的详细信息见表1。
2.2 永生化的HLA-A*1101阳性、A*2402阳性B细胞株的建立 扩增HLA-A*1101和A*2402的引物见表2。扩增A*1101的条件为:94 ℃ 4 min,30循环(94 ℃ 30 s,60 ℃ 1 min,72 ℃ 1 min),72 ℃ 4 min。扩增A*2402的条件为:94 ℃ 4 min,15循环(94 ℃ 30 s,65 ℃ 1 min),30循环(94 ℃ 30 s,55 ℃ 50 s,72 ℃ 30 s),72 ℃ 5 min。A*1101和A*2402 的PCR产物大小分别为500 bp和557 bp,见图1。图2和图3分别为HLA-A*1101和HLA-A*2402的PCR产物的测序结果,Blasting检索结果证实PCR产物序列与实际序列完全一致。图4为PBMCs和永生化的B细胞株的图片。PBMCs的细胞偏小,边缘整齐,折光度好,无分裂生长能力。随着B95-8细胞培养上清刺激PBMCs的时间不断延长,细胞量减少,存活细胞的边缘不整齐,细胞变大并呈现分裂生长趋势。最后,细胞分裂迅速,呈团块状生长,经过进一步传代培养后即建立了稳定的永生化的B细胞株。最终,我们建立了HLA-A*1101阳性、A*2402阳性B细胞株。
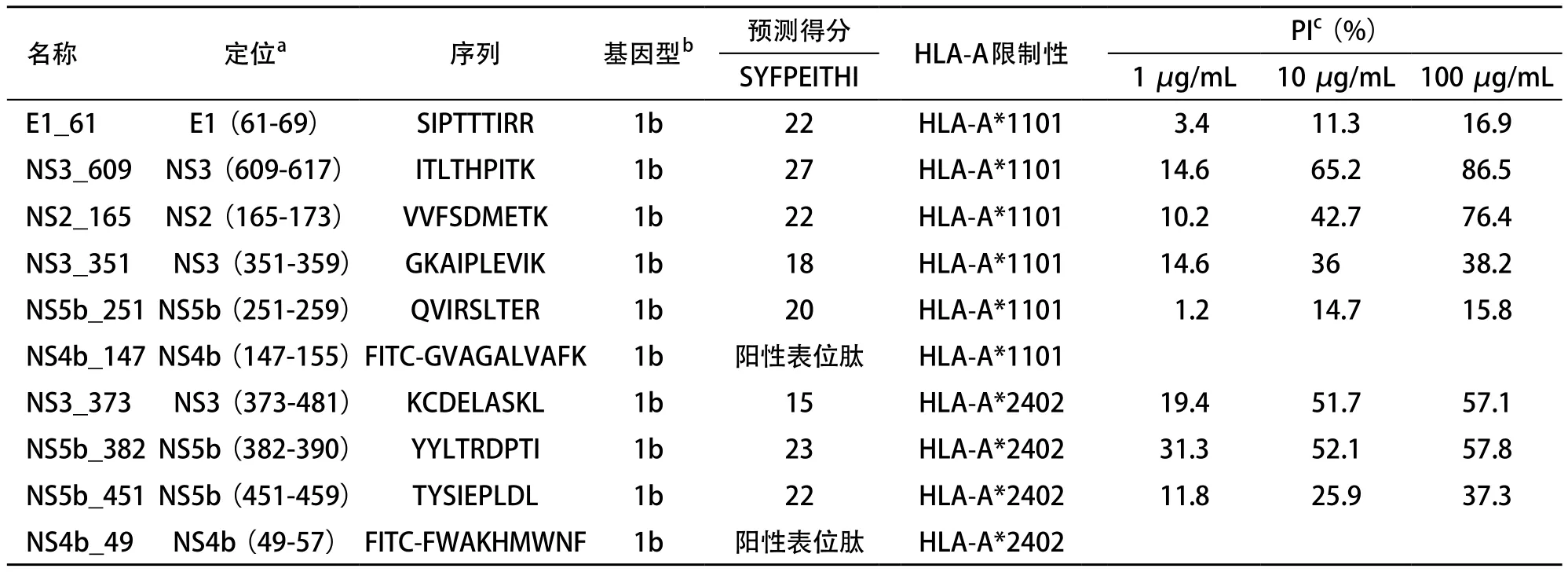
表1 HCV特异性HLA-A*1101、A*2402限制性候选CD8+T细胞表位肽及阳性表位肽
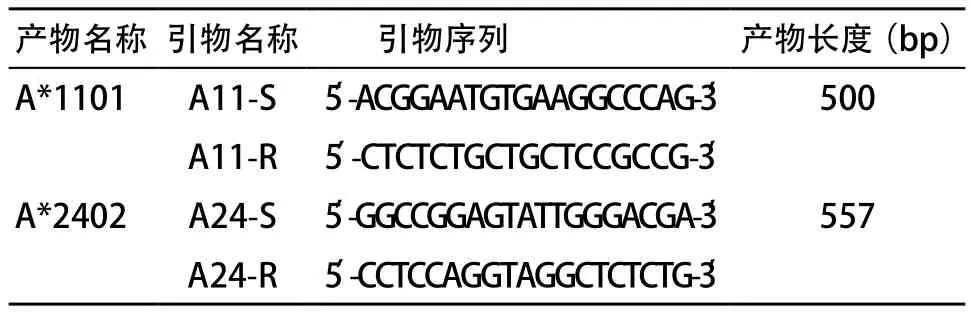
表2 扩增HLA-A*1101和A*2402的引物
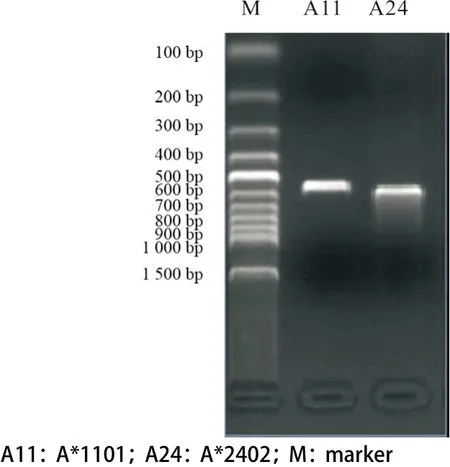
图1 HLA-A*1101和HLA-A*2402的PCR扩增结果
2.3 竞争性肽结合实验结果 基于上述建立的永生化的B细胞株,我们研究了候选表位肽与HLA分子的结合力。在5条HLA-A*1101限制性候选表位肽(E1_61、NS3_609、NS2_165、NS3_351和NS5b_251)中,NS3_609和NS2_165对阳性表位肽的PI与候选表位肽的浓度呈正比,当肽浓度为100μg/mL时,NS3_609和NS2_165的PI均大于50%(分别为86.5%和76.4%)(见表1和图5)。在3条HLA-A*2402限制性候选表位肽(NS3_373、NS5b_382和NS5b_451)中,NS3_373和NS5b_382对阳性表位肽的PI与候选表位肽的浓度呈正比,当肽浓度为100μg/mL时,NS3_373和NS5b_382的PI均大于50%(分别为57.1%和57.8%)(见表1和图6)。
图2 HLA-A*1101的PCR产物测序结果
图3 HLA-A*2402的PCR产物测序结果

图4 正常的PBMCs和B95-8细胞上清刺激HLA-A*1101阳性PBMCs产生的永生化B细胞株
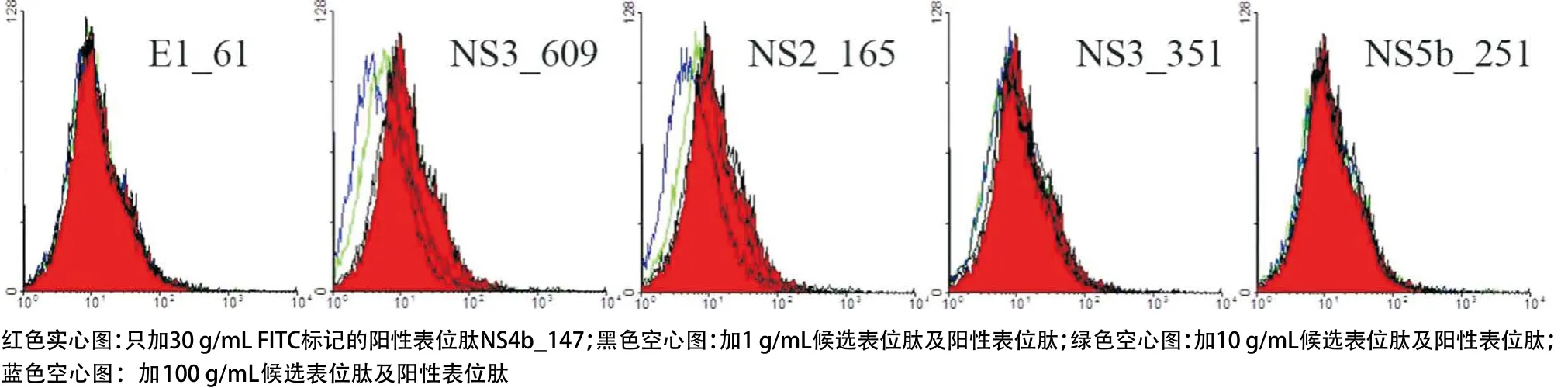
图5 候选表位与HLA-A*1101分子的结合力
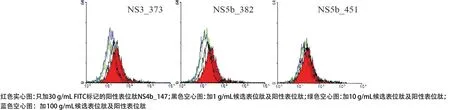
图6 候选表位与HLA-A*2402分子的结合力
2.4 IFN-γELISPOT实验 在6名HLA-A*1101阳性HCV感染者PBMCs中,NS3_609和NS2_165特异性分泌IFN-γ的细胞频率分别为(14±4)SFCs/1×105PBMCs和(8±2)SFCs/1×105PBMCs(已减去阴性对照),均大于5 SFCs/1×105PBMCs;而在6名HLA-A*2402阳性HCV感染者PBMCs中,NS3_373和NS5b_382特异性分泌IFN-γ的细胞频率分别为(12±5)SFCs/1×105PBMCs和(15±4)SFCs/1×105PBMCs(已减去阴性对照),均大于5 SFCs/1×105PBMCs;其他肽特异性IFN-γ的斑点数在减去阴性对照后均小于5 SFCs/1× 105PBMCs(见图7)。
2.5 PBMCs中肽特异性IFN-γ+CD8+T细胞的水平 在6名HLA-A*1101阳性HCV感染者PBMCs中,NS3_609和NS2_165特异性IFN-γ+CD8+T细胞占总CD8+T细胞的百分率分别为0.12%±0.04%和0.06%±0.02%,与阴性对照比差异有统计学意义(P<0.05);而在6名HLA-A*2402阳性HCV感染者PBMCs中,NS3_373和NS5b_382特异性IFN-γ+CD8+T细胞占总CD8+T细胞的百分率分别为0.11%±0.03%和0.15%±0.05%,与阴性对照比较差异有统计学意义(P<0.05);其他肽特异性IFN-γ+CD8+T细胞的百分率与阴性对照比较差异无统计学意义(P>0.05)(见图8)。
3 讨论
大量研究证实:HCV感染机体产生的抗体对HCV没有中和作用,而诱导的CD8+T细胞可清除感染者体内HCV[3-4,18-23]。由于天然HCV抗原含有不合理的表位组分,能够诱导Th1/Th2平衡改变,免疫偏差或免疫颠覆,而使HCV逃避机体的免疫防御而持续存在于肝细胞内,导致感染慢性化、肝硬化或肝癌。因而,仅能诱发CD8+T细胞反应的CD8+T细胞表位疫苗已成为目前HCV疫苗研究的新方向[24-25]。HLAA的常见等位基因A*0201、A*1101和A*2402在不同种族人群中具有极高的总百分率。在既往研究中,基于T2细胞株(表达HLA-A*0201分子,其肽结合凹槽中无肽),研究者们已鉴定出多条HLA-A*0201限制性CD8+T细胞表位[6-9]。然而,由于缺乏类似的细胞株,HLA-A*1101和A*2402限制性CD8+T细胞表位的鉴定受到了极大制约。

图7 HCV感染者PBMCs中肽特异性分泌IFN-γ的细胞的水平
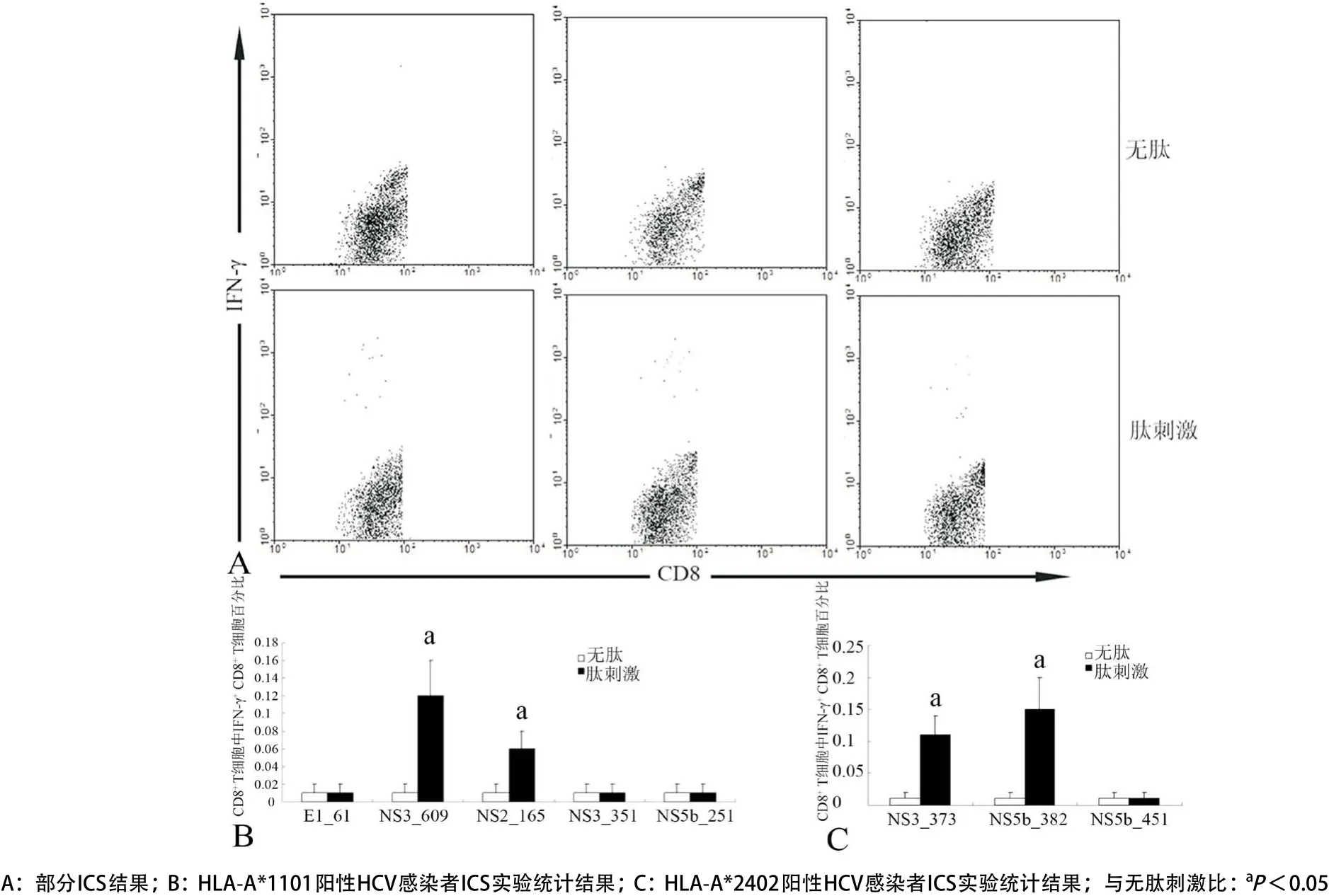
图8 HCV感染者CD8+T细胞中肽特异性IFN-γ+CD8+T 细胞的百分比
我们前期在登革病毒和HCV中的研究表明:T细胞表位预测软件预测结合体内、外实验验证法是一种快捷、费用低廉的鉴定病毒T细胞表位的研究策略[8,26-27]。由于HCV-1b基因型感染者在HCV感染者中占极高比率[16],在本研究中,我们基于1b基因型的氨基酸序列采用SYFPEITHI预测合成了5条HLAA*1101限制性候选表位肽和3条HLA-A*2402限制性候选表位肽。研究表明:低浓度的枸橼酸可以洗脱细胞表面HLA分子肽结合凹槽中的肽,为后续研究候选表位肽与HLA的结合奠定了物质基础[15]。基于此,竞争性肽结合实验已成功用于检测候选表位肽与HLA的结合力[15]。其基本原理为:首先采用枸橼酸处理细胞(PBMCs或细胞株),然后将候选表位肽和FITC标记的已报道的能与某种HLA等位基因分子结合的阳性表位肽同枸橼酸处理的细胞共同孵育,最后采用流式细胞仪检测细胞MFI并计算PI。候选表位肽与HLA-A*1101或A*2402结合力越强,则占据的HLA-A分子越多,而荧光素标记的阳性表位肽结合的量就越少,因而细胞的MFI就越弱,PI则越高。因而,PI可用于反映候选表位肽与HLA分子的结合力。相对PBMCs而言,细胞表型单一并能稳定表达HLA分子的细胞株能产生更稳定和可靠的实验结果。B95-8细胞是一种感染EB病毒的绒猴白细胞,实验证实其培养上清可诱导某些B细胞永生化产生稳定的细胞株[14]。在本研究中,我们招募了近50例健康志愿者,最后建立了稳定的HLA-A*1101阳性、HLA-A*2402阳性永生化B细胞株。基于建立的B细胞株,竞争性肽结合实验结果证明了候选表位肽NS3_609和NS2_165与HLA-A*1101分子具有高结合力,NS3_373和NS5b_382则与HLA-A*2402具有高结合力。
研究表明:与HLA分子结合力高的候选表位肽不一定是真正的T细胞表位[28]。一种肽到底是不是真正的T细胞表位,不但取决于肽与HLA分子的结合力,还取决于肽是否为蛋白在人细胞内被蛋白酶体裂解产物。而通过采用敏感的免疫学实验检测HCV感染者PBMCs中是否存在某种肽特异性分泌IFN-γ的细胞则可证实该肽是否为人蛋白酶体裂解结果。ELISPOT和ICS实验是公认的用于研究细胞免疫的最佳方法,原因是这两种实验具有极高的敏感性和可重复性,前者可以反映单细胞免疫水平,后者则可以确定细胞免疫的表型。因此,这两种方法可以结合起来从单细胞水平研究细胞免疫反应。在本研究中,我们同时使用ELISPOT和ICS两种方法检测肽刺激HCV感染者PBMCs后分泌IFN-γ的细胞的频率以及表型。结果显示,HLA-A*1101阳性HCV感染者PBMCs中存在NS3_609和NS2_165特异性能分泌IFN-γ的CD8+T细胞,HLA-A*2402阳性HCV感染者PBMCs中存在NS3_373和NS5b_382特异性能分泌IFN-γ的CD8+T细胞。证实NS3_609、NS2_165、NS3_373和NS5b_382均是HCV蛋白经人细胞内蛋白酶体裂解后产生的,从而表明这4条肽为HCV特异性CD8+T细胞表位。
总之,本研究成功鉴定出了2条HCV特异性HLAA*1101限制性CD8+T细胞表位和2条HLA-A*2402限制性CD8+T细胞表位。本研究证实,将永生化的B细胞株和竞争性肽结合实验结合起来是一种极好的检测候选表位肽与HLA分子结合力的研究策略。在将来的研究中,我们将探讨这些表位诱导的CD8+T细胞能否杀伤HCV感染的靶细胞,对机体有无免疫保护效应。
