人骨形态发生蛋白2真核表达载体构建及其基因/壳聚糖纳米复合体制备
2014-07-17杨晓喻李世轶张迪吴颖杨涛刘长虹
杨晓喻 李世轶 张迪 吴颖 杨涛 刘长虹
南方医科大学附属口腔医院·广东省口腔医院种植中心,广州 510280
种植体表面良好的处理,有利于尽快实现骨整合,从而履行功能。以往的种植体表面处理研究主要集中在种植体表面的物理化学处理,而基因水平的生物化学处理较为少见。人骨形态发生蛋白(bone morphogenetic protein,BMP)具有独特的诱导成骨活性[1]。其中,BMP2的诱导成骨活性最强,可促进Ca、P在钛金属表面沉积,提高种植体-骨界面结合率,加快骨结合进程。壳聚糖(chitosan,CS)[2]作为一种非病毒载体,是自然界中唯一一种带阳离子的可降解纳米级载体,具有良好的生物相容性、可降解性和黏膜黏附性,特别适合包载蛋白质、多肽、疫苗和基因等生物活性大分子[3-5]。本研究利用基因重组技术在体外构建人BMP2基因的真核表达重组质粒,并采用去溶剂法合成壳聚糖/质粒纳米复合体,为后续基因转染形成活性因子激活成骨信号通道以加快种植体周成骨的研究奠定基础。
1 材料和方法
1.1 材料和仪器
pMD18T-hBMP2-His(带有组氨酸标签的人骨形态发生蛋白2模板质粒,北京义翘神州生物技术公司),p IRES2-EGFP(携带有增强型绿色荧光蛋白的真核表达载体,含卡那霉素抗性基因,Clontech公司,美国),感受态大肠杆菌DH5α(Promega公司,美国),限制性内切酶(Takara公司,日本),T4 DNA连接酶(NEB公司,美国),质粒抽提试剂盒(Qiagen公司,美国), DNA引物合成及测序(Invitrogen公司,美国),核酸蛋白分析仪(Implen公司,德国),ZetaPALS电位及粒度分析仪(Brookhaven公司,美国),原子力显微镜MFP-3D(Asylum Research公司,美国)。壳聚糖:A组(相对分子质量98.8×103,脱乙酰度87.31%)、B组(相对分子质量121×103,脱乙酰度91.48%)、C组(相对分子质量77.8×103,脱乙酰度97.37%)(上海卡博工贸有限公司),D组(相对分子质量379×103,脱乙酰度93.9%)(Sigma公司,美国),E组(相对分子质量17×103,脱乙酰度79%)(日本庆应大学实验室提供)。
1.2 p IRES2-EGFP-hBMP2-His重组质粒的构建、鉴定及测序
1.2.1 p IRES2-EGFP-hBMP2-His重组质粒的构建p IRES2-EGFP和pMD18T-hBMP2-His双酶切及目的片段回收:取p IRES2-EGFP载体质粒和经PCR扩增并加载双酶切位点的pMD 18T-hBMP2-His质粒经BamHⅠ、EcoRⅠ在37 ℃水浴双酶切反应2 h,切取目的条带,分别将含目的片段的琼脂糖凝胶经DNA纯化回收试剂盒回收。
p IRES2-EGFP-hBMP2-His真核表达重组质粒的构建:取经BamHⅠ、EcoRⅠ双酶切的pIRES2-EGFP大片段以及经BamHⅠ、EcoRⅠ双酶切的目的基因hBMP2-His片段加入T4 DNA连接酶,22 ℃反应2 h。
连接产物转化:转化入感受态细菌DH5α中,取100 μL均匀涂布于含50 μg·m L-1卡那霉素的LB平板上,室温放置涂好的平板直至液体被完全吸收,37 ℃恒温培养箱倒置培养过夜,可见菌落出现。
1.2.2 p IRES2-EGFP-hBMP2-His重组质粒的鉴定及测序 挑取菌落进行摇菌扩增,质粒抽提试剂盒提取质粒。质粒经EcoRⅠ、BamHⅠ双酶切,0.6%琼脂糖凝胶电泳(120 V,25 m in)鉴定。阳性克隆可酶切出1 209 bp大小的片段。将鉴定正确的重组克隆送Invitrogen公司进行测序验证,测序引物为通用引物CMV-F。在www.ncbi.nlm.nih.gov上通过BLAST程序对所测得序列与GenBank的BMP2基因同源序列进行比较。
1.3 CS/pIRES2-EGFP-hBMP2-His纳米复合体的制备及检测
1.3.1 去溶剂法制备CS/p IRES2-EGFP-hBMP2-His纳米复合体 分别称取一定量的5种不同相对分子质量及脱乙酰度的壳聚糖(A~E组),溶解于体积分数为1%的乙酸,使终浓度为0.2 mg·m L-1,NaOH溶液调节pH至6.5,0.22 μm滤膜过滤,置于4 ℃冰箱待用。p IRES2-EGFP-hBMP2-His质粒溶于20%的Na2SO4溶液。按N/P(壳聚糖中的胺基含量与质粒中磷酸基含量的摩尔比)=1、3、5、7、10分别将55 ℃预热壳聚糖与pIRES2-EGFP-hBMP2-His混合,涡旋30 s,静置30 m in,即为CS/p IRES2-EGFP-hBMP2-His纳米复合体混悬液。
1.3.2 CS/p IRES2-EGFP-hBMP2-His纳米复合体的粒径及Zeta电位检测 取N/P=3、5、7、10的纳米复合体悬液,用1%pH 6.5乙酸溶液稀释纳米复合体至适当浓度及体积,ZetaPALS电位及粒度分析仪检测纳米复合体的粒径大小、分布及Zeta电位。
1.3.3 CS/p IRES2-EGFP-hBMP2-His纳米复合体凝胶电泳实验及包封率测定 取裸质粒DNA及不同N/P比值(N/P=1、3、5、7、10)纳米复合体悬液10 μL,行0.6%琼脂糖凝胶电泳(120 V,25 m in)分析。
取C组200 μL pH6.5壳聚糖按照N/P=5与pIRES2-EGFP-hBMP2-His反应形成纳米复合体,低温离心30 m in(4℃,15000 g)。小心吸取上清液,TNE缓冲液(1.21 g Tris,5.84 g NaCl,0.37 g EDTA,定容至1 L,pH=7.4)定容至1 m L,再加入浓度为0.15 μg·m L-1的Hoechst33258染液1 m L,荧光分光法测定荧光强度(F),根据标准曲线公式计算溶液中质粒DNA浓度(c),按下式计算包封率 :包封率(%)=(W总-W上清) /W总×100% ,其中W总为总pDNA 量,W上清为上清液中pDNA量。重复实验3次,取平均值。
1.3.4 CS/p IRES2-EGFP-hBMP2-His纳米复合体形貌观察 取N/P=5的CS/p IRES2-EGFP-hBMP2-His纳米复合体悬液,滴于新剥离的云母片上,分散均匀,过夜使其自然干燥,原子力显微镜观察纳米复合体的形貌。设置空白云母片组及N/P=10组作为对照。
2 结果
2.1 p IRES2-EGFP-hBMP2-His重组质粒的鉴定以及测序
p IRES2-EGFP-hBMP2-His重组质粒经EcoRⅠ、BamHⅠ双酶切后,可见载体片段(5 308 bp)及目的基因片段(1 209 bp),酶切结果正确(图1),表明经转化、扩增、抽提后的质粒为目的质粒。经基因序列测定及分析后未见突变,p IRES2-EGFP-hBMP2-His重组质粒与GenBank的BMP2基因同源序列的比较表明,与人BMP2基因具有高度同源性。
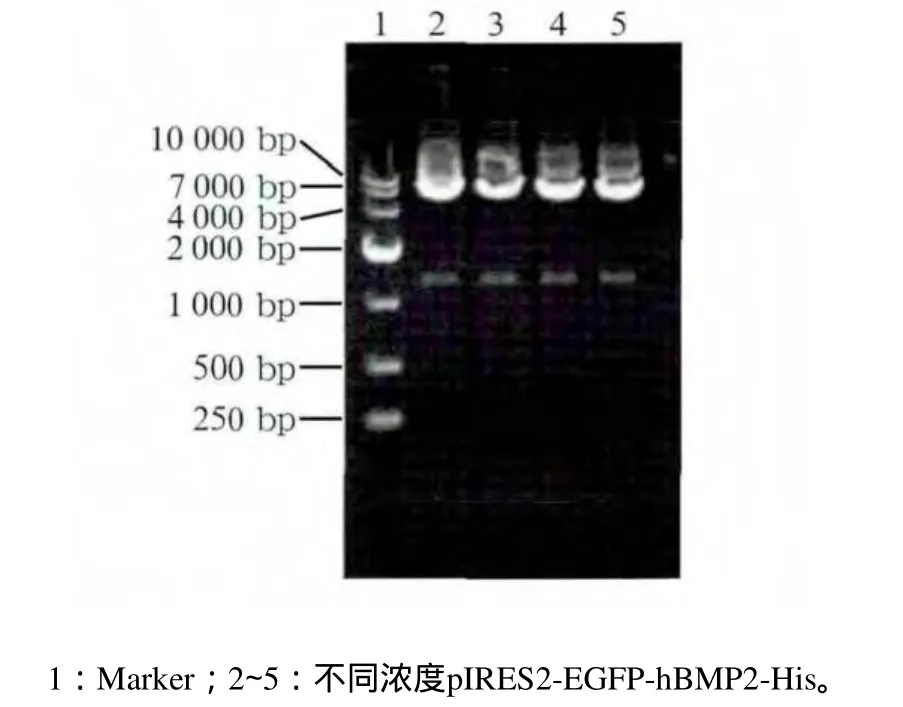
图1 p IRES2-EGFP-hBMP2-His经EcoRⅠand BamHⅠ双酶切Fig 1 p IRES2-EGFP-hBMP2-His plasm id digested by EcoRⅠand BamHⅠ
2.2 CS/pIRES2-EGFP-hBMP2-His纳米复合体粒径大小、分布及Zeta电位检测
不同N/P比值下各组CS/p IRES2-EGFP-hBMP2-His纳米复合体的粒径大小见表1。从表1可见,5组壳聚糖在不同N/P比情况下均能与p IRES2-EGFP-hBMP2-His质粒复合形成纳米复合体,粒径111.7~3 214.2 nm不等,A、B、C组在N/P≥5时及D、E组在每个N/P比情况下均可以形成两种不同粒径大小的纳米复合体。纳米复合体的粒径主要集中在两个区域范围,形成两个峰值,粒径较小的纳米复合体数量较多,粒径较大的复合体数量较少(图2)。
表1 不同N/P比值下各组CS/p IRES2-EGFP-hBMP2-His纳米复合体粒径的大小Tab 1 Size of CS/p IRES2-EGFP-hBM P2-His nanoparticles under various N/P ratio in different groups±s,n=10, nm
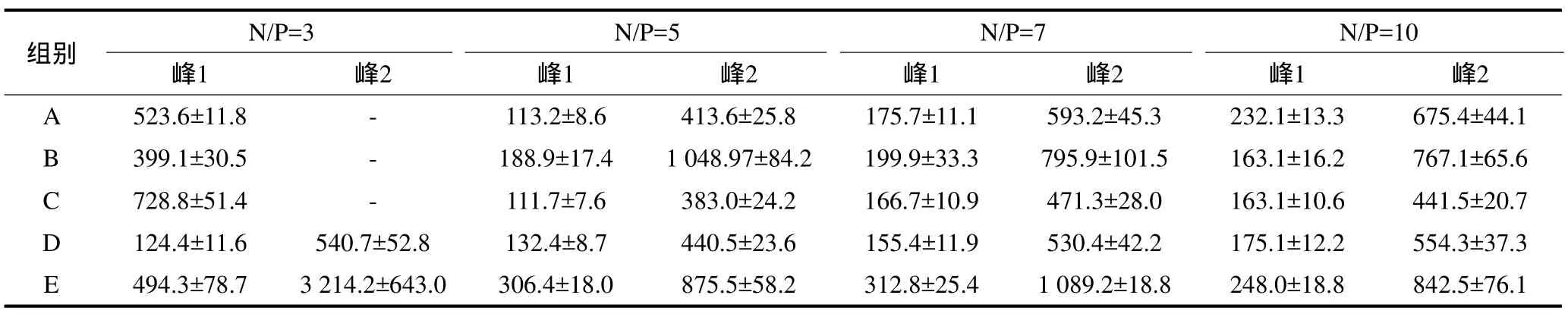
表1 不同N/P比值下各组CS/p IRES2-EGFP-hBMP2-His纳米复合体粒径的大小Tab 1 Size of CS/p IRES2-EGFP-hBM P2-His nanoparticles under various N/P ratio in different groups±s,n=10, nm

图2 C组CS/p IRES2-EGFP-hBMP2-His纳米复合体粒径的分布(N/P=5)Fig 2 Distribution of CS/pIRES2-EGFP-hBMP2-His nanoparticles of group C(N/P=5)
5组CS/p IRES2-EGFP-hBMP2-His纳米复合体的Zeta电位4.93~16.79 mV不等(表2),并且,随着N/P比的增加,纳米复合体表面Zeta电位呈上升趋势且趋于稳定。
表2 不同N/P比值下各组CS/p IRES2-EGFP-hBMP2-His纳米复合体表面Zeta电位大小Tab 2 Zeta potential of CS/p IRES2-EGFP-hBMP2-His nanoparticles under various N/P ratio in different groups , n=10, m V±s

表2 不同N/P比值下各组CS/p IRES2-EGFP-hBMP2-His纳米复合体表面Zeta电位大小Tab 2 Zeta potential of CS/p IRES2-EGFP-hBMP2-His nanoparticles under various N/P ratio in different groups , n=10, m V±s
2.3 CS/pIRES2-EGFP-hBMP2-His纳米复合体的包封率测定
不同N/P比值的纳米复合体凝胶电泳分析结果见图3。当N/P≥3时,壳聚糖对p IRES2-EGFP-hBMP2-His完全包裹。C组CS/p IRES2-EGFP-hBMP2-His纳米复合体的标准曲线方程为F=224.66c+239.43,包封率为(96.03±0.25)%。
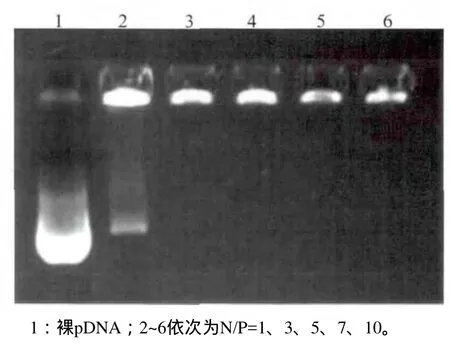
图3 不同N/P比值的CS/pIRES2-EGFP-hBMP2-His纳米复合体凝胶电泳分析Fig 3 Agarose electrophoresis of CS/p IRES2-EGFP-hBMP2-His nanoparticles at different N/P ratios
2.4 CS/pIRES2-EGFP-hBMP2-His纳米复合体的形貌
原子力显微镜下可见,空白云母片呈均匀状,背景较为清晰(图4A);N/P=5时,壳聚糖与p IRES2-EGFP-hBMP2-His质粒复合后形成球状的CS/p IRES2-EGFP-hBMP2-His纳米复合体结构(图4B);N/P=10时,球状的纳米复合体部分聚集形成较大的聚集体(图4C)。

图4 不同N/P比值的CS/p IRES2-EGFP-hBMP2-His纳米复合体形貌的原子力显微镜观察Fig 4 Morphology of CS/p IRES2-EGFP-hBMP2-His nanoparticles by atomic force microscope
3 讨论
目的基因要在转染真核细胞内表达,首先取决于目的基因真核表达载体的构建[6]。p IRES2-EGFP作为基因表达的载体,复制能力强,具有多克隆位点,便于目的基因片段插入,并且含有高效且功能强大的CMV启动子,可以使目的基因在多种类型细胞中稳定表达活性。此外,该载体携带增强型绿色荧光蛋白基因,当携带外源性基因进入细胞内,细胞转录翻译基因产生绿色荧光蛋白,该蛋白强度较普通绿色荧光蛋白强几十倍,有利于镜下观察检测分析目的基因的转染效率。由此可见p IRES2-EGFP具有生物活性、无细胞毒性、不影响融合蛋白表达、荧光效果稳定、检测方便的优点。
在基因治疗中,携带靶基因的载体复合体粒径是基因微粒分散递送系统的一个重要影响因素,可以直接影响分散系统在细胞表面的吸附、吞噬及胞内释放。小于100 nm的粒子不易黏附于细胞表面,较大粒径的微粒因组织扩散和入胞受限影响转染效率,而100~300 nm范围内的纳米微粒相对来说较容易通过细胞的胞吞作用进入胞内,从而释放目的基因作用于靶细胞[7]。
壳聚糖与目的基因的结合通常采用共价交联法、离子诱导法等[8],本研究中壳聚糖与p IRES2-EGFP-hBMP2-His质粒复合形成纳米复合体采用的是去溶剂法。该方法合成工艺简单,条件温和,不会破坏基因和蛋白质,且制备的纳米粒径小,稳定性较好。弱酸性溶液中的壳聚糖部分质子化呈带正电荷状态,当加入带有负电荷的p IRES2-EGFP-hBMP2-His时,二者通过静电作用结合形成纳米复合体,并由于溶液Na2SO4电解质的存在,使得高分子物质从溶液中析出,最终形成纳米粒。在壳聚糖与质粒基因进行复合的时候,存在一定的N/P比,即壳聚糖中的胺基与基因中磷酸基的摩尔比。当壳聚糖与质粒按照N/P=1复合时,加入壳聚糖的量不足以与所加入的质粒量充分结合,遂导致凝胶电泳时游离的质粒在电泳槽中由负极向正极移动,而当N/P≥3时,壳聚糖携带的正电荷对质粒基因有完全捕获能力[9-11]。
此外,本实验中在测定各组纳米复合体粒径大小时发现,相对分子质量17×103~379×103、脱乙酰度79%~97.31%的壳聚糖在N/P≥3的情况下均可以与目的质粒结合形成纳米粒。在纳米复合体粒径检测中发现,每组粒径分布几乎都会出现双峰,其中主峰粒径较小,数量较多,这在以往文献中未见报道。该双峰现象是因为壳聚糖与基因复合过程中,纳米微粒带表面电荷,并且受到微粒在溶液中布朗运动的影响,一些粒径较小的纳米微粒在溶液中呈不稳定状态,在团聚效应作用下形成较大粒径的复合体。
壳聚糖/DNA纳米复合体的构建受多种因素如相对分子质量大小、脱乙酰度、pH值、N/P比等的影响[12-15],探讨CS/p IRES2-EGFP-hBMP2-His的构建工作具有重要的意义。今后的研究将进一步探索影响壳聚糖作为基因载体的多项因素,并进行细胞转染的生物实验,以验证和检测壳聚糖作为基因载体的生物安全性以及转染效率,研究如何对壳聚糖进行改性或接枝以及模拟种植体表面的生物界面,为种植体周围快速成骨提供基础研究。
[1]Bragdon B, Moseychuk O, Saldanha S, et al. Bone morphogenetic proteins: a critical review[J]. Cell Signal, 2011, 23(4):609-620.
[2]张玮, 张学农. 壳聚糖纳米粒制备技术研究进展[J]. 抗感染药学, 2008, 5(2):65-69.
[3]李广峰, 杨建东. 壳聚糖纳米粒子基因载体的研究现状[J]. 中国组织工程研究与临床康复, 2011, 15(47):8879-8882.
[4]Toh EK, Chen HY, Lo YL, et al. Succinated chitosan as a gene carrier for improved chitosan solubility and gene transfection[J]. Nanomedicine, 2011, 7(2):174-183.
[5]Saranya N, Moorthi A, Saravanan S, et al. Chitosan and its derivatives for gene delivery[J]. Int J Biol Macromol, 2011,48(2):234-238.
[6]付春江, 毕郑钢, 黄昀, 等. BMP2真核表达载体的构建[J].哈尔滨医科大学学报, 2007, 41(6):524-526
[7]Ross PC, Hui SW. Lipoplex size is a major determ inant ofin vitrolipofection efficiency[J]. Gene Ther, 1999, 6(4):651-659.
[8]Grenha A. Chitosan nanoparticles: a survey of preparation methods[J]. J Drug Target, 2012, 20(4):291-300.
[9]Ishii T, Okahata Y, Sato T. Mechanism of cell transfection with plasmid/chitosan complexes[J]. Biochim Biophys Acta,2001, 1514(1):51-64.
[10]Lee M, Nah JW, Kwon Y, et al. Water-soluble and low molecular weight chitosan-based plasm id DNA delivery[J].Pharm Res, 2001, 18(4):427-431.
[11]Erbacher P, Zou S, Bettinger T, et al. Chitosan-based vector/DNA complexes for gene delivery: biophysical characteristics and transfection ability[J]. Pharm Res, 1998, 15(9):1332-1339.
[12]宗莉, 陈伶俐, 张淑芸, 等. 壳聚糖纳米粒作为基因载体的研究: 制备, 特征和对DNA的保护[J]. 中国药科大学学报, 2005, 36(6):526-530.
[13]Huang M, Fong CW, Khor E, et al. Transfection efficiency of chitosan vectors: effect of polymer molecular weight and degree of deacetylation[J]. J Control Release, 2005, 106(3):391-406.
[14]卢华定, 赵慧清, 吕璐璐, 等. 壳聚糖-负载增强型绿色荧光蛋白基因的质粒DNA纳米微球体外转染软骨细胞的能力及影响因素[J]. 中华创伤骨科杂志, 2011, 13(11):1066-1071.
[15]叶漫文, 曾曙光. 基于丝素蛋白和壳聚糖的骨组织工程材料研究进展[J]. 广东牙病防治, 2003, 21(2):108-112.
