肌上皮细胞在腮腺再生过程中的变化
2014-03-24毛玉龙张伟伟左金华
毛玉龙 张伟伟 左金华
1.滨州医学院附属医院口腔颌面外科;2.口腔正畸科,滨州 256603
放射治疗、舍格伦综合征以及涎腺炎导致的涎腺萎缩是临床上常见且亟待解决的难题。研究涎腺对萎缩和再生的反应有可能为涎腺的放射防护设计或为涎腺萎缩的治疗找到有效的途径[1]。有学者[2]认为,肌上皮细胞(myoepithelial cell,MEC)可能是导致唾液腺多种疾病的潜能祖细胞之一;在继发性舍格伦综合征患者唾液腺炎症病变过程中,MEC亦可作为靶细胞被淋巴细胞浸润破坏,并最终导致腺泡和导管上皮丧失[3]。目前关于MEC在腮腺萎缩后再生过程中变化方面的研究较少,本实验通过结扎大鼠腮腺主导管14 d后使其再通,建立腮腺萎缩后再生的动物模型,观察MEC在该过程中的数量及分布的变化情况。
1 材料和方法
1.1 实验对象
选用无特定病原体动物(specif ied pathogen free,SPF)级成年雄性Wistar大鼠54只为研究对象,质量(260±15)g,购于山东大学实验动物中心(批号:鲁动质字D20021024)。将大鼠随机分为8个实验组和1个正常对照组,每组6只,常规饲养。
1.2 实验方法
将实验组的大鼠使用质量分数为3%水合氯醛(10 mL·kg-1)行腹腔内注射麻醉,于右耳前下方切开皮肤,显露右侧腮腺主导管,用3—0丝线将直径0.8 mm医用钢丝与主导管捆绑双重结扎。主导管结扎后第14天,再次麻醉大鼠,取出医用钢丝使主导管再通,分别于再通后第0、1、3、5、7、10、14、21天各处死1组大鼠,切取右侧腮腺,放入质量分数4%的多聚甲醛固定液中固定。正常对照组仅手术显露主导管但不结扎。
1.3 观察方法
1.3.1 苏木精-伊红(hematoxylin-eosin,HE)染色观察 将各组腮腺组织样本固定24 h后,梯度乙醇脱水,二甲苯透明,然后浸蜡、包埋,制成4 μm厚切片,进行HE染色,置于光学显微镜下观察腮腺的组织学变化。
1.3.2 免疫组织化学染色观察 采用特异性肌动蛋白α-SMA单克隆抗体(北京中杉金桥生物技术有限公司),应用SABC法对腮腺标本进行免疫组织化学染色,抗体稀释度为1∶200,DAB显色,苏木精轻度复染,观察MEC的阳性表达情况。
1.3.3 MEC计数 将免疫组织化学切片置于OLYMPUS BX51型显微镜下(Olympus公司,日本)观察,每张切片随机选择5个视野拍照,应用Image-Pro Plus 6.0图像分析软件计数MEC的数目。
1.4 统计学处理
实验所得数据采用SPSS 16.0软件包进行方差分析,检验水准为双侧α=0.05。
2 结果
2.1 HE观察结果
实验动物的HE观察结果见图1。正常对照组:腮腺腺小叶中有密集的腺泡细胞及散在的导管系统(闰管、纹管及排泄管),腺泡细胞大小均匀,排列紧凑(图1A)。实验组:导管结扎14 d组(即再通0 d组),腮腺实质内绝大多数腺泡萎缩消失,仅在腺小叶边缘可见少数散在且体积明显减小的腺泡细胞,导管样结构明显增多,占据腺小叶的大部,并伴有大量炎症细胞浸润(图1B);再通1 d组与再通0 d组相比,腺小叶结构未见明显变化;再通3 d组可见体积较小的新生腺泡出现在腺小叶边缘(图1C);再通5 d组可见除腺小叶边缘外,腺小叶中央新生腺泡数量也明显增多,导管样结构明显减少;再通7 d组,成熟的腺泡细胞已占据大部分腺小叶,腺泡形态基本恢复正常,但腺泡排列仍较正常对照组稀疏(图1D);再通10 d组,成熟腺泡进一步增多,导管系统进一步减少;再通14 d组及再通21 d组,腺小叶的结构与正常对照组相近,没有发现明显差异。

图1 正常对照组及实验组腮腺的组织学变化 HE× 400Fig 1 Histological changes of parotid glands for control and experimental group HE× 400
2.2 免疫组织化学观察结果
正常对照组:呈阳性表达的MEC主要分布在闰管及腺泡周围,形态呈星形或梭形,纹管周围亦可见少量MEC(图2A);再通0 d组与正常对照组比较,MEC数目明显增多,主要分布在大量导管样结构周围,此时导管样结构呈典型的双套层结构,大量MEC位于外层,形态呈梭形或星形(图2B);再通1 d组与再通0 d组对比,MEC数目及分布未见明显改变;再通3 d组,随着新生腺泡的出现,MEC数目明显减少,大多分布在导管样结构及新生腺泡周围(图2C);再通5 d组,新生腺泡逐渐增多,导管样结构明显减少,MEC数目进一步明显减少;再通7 d组,新生腺泡已占据大部分腺小叶,导管样结构明显减少,MEC数目减少变缓,主要分布在体积较小的新生腺泡及导管系统表面(图2D);再通10 d组,MEC数量进一步减少;再通14 d组及21 d组,腺小叶结构基本恢复正常,MEC数目及分布也基本恢复正常,与正常对照组未见明显差别。
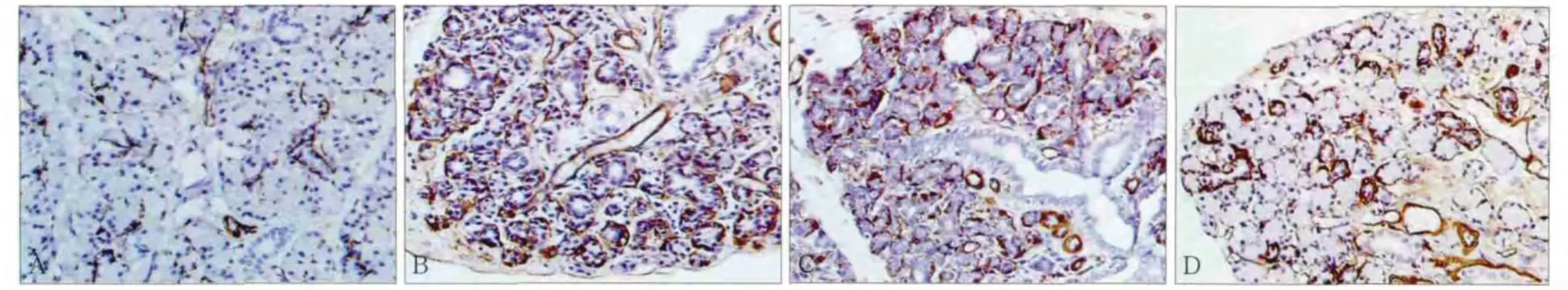
图2 正常对照组及实验组腮腺MEC的阳性表达 SABC× 400Fig 2 MEC positive expression in parotid glands for control and experimental group SABC× 400
2.3 MEC计数结果
各组动物的MEC计数结果见表1:与正常对照组相比,再通0、1、3、5、7、10 d组的MEC数量均有明显差异(P<0.05),再通14 d及21 d组无明显差异(P>0.05);再通3、5 d时MEC数量下降最为明显,再通7 d开始,MEC数量下降明显放缓。
表1 腮腺再生过程中不同时间点的MEC计数Tab 1 Numbers of MEC during each step of duct reopening ±s

表1 腮腺再生过程中不同时间点的MEC计数Tab 1 Numbers of MEC during each step of duct reopening ±s
注:*与正常对照组相比,P<0.05。
组别MEC数量正常对照550.40±80.465再通0 d1 584.30±180.426*再通1 d1 504.62±205.847*再通3 d1 242.55±272.810*再通5 d891.25±312.467*再通7 d765.50±245.214*再通10 d688.64±166.376*再通14 d611.26±154.379再通21 d584.50±138.589
3 讨论
本实验按照潘光华等[4]的实验方法,将医用钢丝捆绑结扎于大鼠腮腺主导管,14 d后取出钢丝使导管再通,成功制造了腮腺萎缩后再生的动物模型。本实验观察到,主导管结扎后14 d,腺泡细胞几乎全部消失,取而代之的是腺体内出现了大量的导管样结构,腺实质大量炎症细胞浸润,仅在腺小叶边缘残留少量的腺泡细胞。通过免疫组织化学染色方法,观察到MEC的数量明显增多,几乎全部分布于导管样结构的周围,呈双套层样结构,形态呈梭形或星形。这与赵腾达等[5]的观察结果是一致的。
主导管结扎后腺体萎缩的机理目前仍然不明确。大部分学者[6-7]认为,这是由于细胞自身的凋亡造成的;但Fujita-Yoshigaki等[8]发现,涎腺萎缩过程中,腺泡细胞可通过Src-p38MAPs信号传导通路快速转变为导管样细胞。还有学者[9]通过分子生物学研究发现,在涎腺萎缩过程中,导管细胞因过表达抗凋亡蛋白B细胞淋巴瘤/白血病(B-cell lymphoma/leukemia,Bcl)基因未发生凋亡,而腺泡细胞由于表达Bcl相关X蛋白Bax而促进其自身的凋亡。
Burgess等[10]指出,在腺体萎缩过程中,MEC能在一定程度上抑制腺体的萎缩。MEC内含有肌动蛋白,能够发生收缩,促进腺泡及导管的分泌[11]。大量研究发现,MEC在正常状况下增殖率很低,当腺体受到损伤时则出现快速增殖。Walker等[12]发现,在正常唾液腺内很少观察到MEC,但随着腺体进行性萎缩,MEC阳性表达明显,并最终完全围绕在导管样结构周围。本研究中,主导管结扎14 d后,腺泡细胞大量消失,而MEC数量不减反增,说明MEC在抑制腺体萎缩方面发挥了重要作用。笔者推测出现这种现象的原因在于,当导管发生阻塞时,导管内的压力增加,腺泡细胞不再需要MEC促进分泌,为了抵抗导管阻塞带来的压力,MEC大量增殖,并围绕在导管周围;同时由于腺体萎缩,单位视野中MEC数量相对增多。关于大量增生的MEC的来源,目前存在两种观点:一是导管细胞作为潜能细胞大量分化为MEC,二是原来位于腺泡周围的MEC发生了移行。至于具体原因还需要进一步研究。
本实验观察到,主导管再通第1天至第5天时,导管样结构明显减少,体积较小的新生腺泡细胞自腺小叶边缘开始大量增殖;究其来源,大部分学者[13]认为是由闰管储备细胞分化而来,笔者认为,腺小叶周围残余的腺泡细胞主动增殖分化也是其大量增殖的原因之一。此阶段MEC数量减少最为明显,且主要分布在新生腺泡周围,故笔者推测,腮腺的再生主要发生在主导管再通后的5 d内。再通第7天,随着腺体的再生恢复,MEC数量减少的程度不如前期明显,形态也逐渐恢复正常,主要分布在体积较小的新生腺泡及残存的导管样组织周围。再通14 d时,镜下观察到的腺实质内各解剖结构及MEC已基本恢复正常。
综上所述,本研究通过建立腮腺萎缩后再通的动物模型,成功观察到腮腺萎缩后再生过程中MEC及腺小叶中各结构的组织学变化,为研究腮腺导管阻塞后再通的变化提供理论依据,并为进一步研究腮腺萎缩的治疗打下基础。
[1]Atkinson JC,Baum BJ.Salivary enhancement:current status and future therapies[J].J Dent Educ,2001,65(10):1096-1101.
[2]Burgess KL,Dardick I,Cummins MM,et al.Myoepithelial cells actively proliferate during atrophy of rat parotid gland[J].Oral Surg Oral Med Oral Pathol Oral Radiol Endod,1996,82(6):674-680.
[3]Hayashi T,Hayashi H,Fujii T,et al.Ultrastructure of myoepithelial cells as a target cell in sialoadenitis of submandibular glands oflupus-prone female NZBxNZWF1 mice[J].Virchows Arch,2008,453(2):177-188.
[4]潘光华,陈伟,张霓霓,等.SD大鼠下颌下腺主导管结扎损伤及再通后的组织学观察[J].实用口腔医学杂志,2012,28(5):570-573.
[5]赵腾达,左金华,王丽芳,等.肌上皮细胞在大鼠腮腺萎缩过程中的转归[J].华西口腔医学杂志,2013,31(1):26-29.
[6]Ihrler S,Blasenbreu-Vogt S,Sendelhofert A,et al.Regeneration in chronic sialadenitis:an analysis of proliferation and apoptosis based on double immunohistochemical labelling[J].Virchows Arch,2004,444(4):356-361.
[7]高旭,左金华,王丽芳,等.腮腺细胞程序性死亡分子5的表达及其与细胞凋亡关系的动物实验[J].中华口腔医学杂志,2012,47(11):694-697.
[8]Fujita-Yoshigaki J,Qi B,Narita T,et al.Parotid acinar cells transiently change to duct-like cells during epithelial-mesenchymal transition[J].J Med Invest,2009,56(Suppl):258-259.
[9]Takahashi S,Yoshimura Y,Yamamoto T,et al.Cellular expression of Bcl-2 and Bax in atrophic submandibular glands of rats[J].Int J Exp Pathol,2008,89(5):303-308.
[10]Burgess KL,Dardick I.Cell population changes during atrophy and regeneration of rat parotid gland[J].Oral Surg Oral Med Oral Pathol Oral Radiol Endod,1998,85(6):699-706.
[11]Lung MA.Autonomic nervous control of myoepithelial cells and secretion in submandibular gland of anaesthetized dogs[J].J Physiol,2003,546(Pt 3):837-850.
[12]Walker NI,Gobé GC.Cell death and cell proliferation during atrophy of the rat parotid gland induced by duct obstruction[J].J Pathol,1987,153(4):333-344.
[13]Takahashi S,Schoch E,Walker NI.Origin of acinar cell regeneration after atrophy of the rat parotid induced by duct obstruction[J].Int J Exp Pathol,1998,79(5):293-301.
