大越豆芋花醇提物抗氧化及α-葡萄糖苷酶抑制活性研究
2014-05-25倪勤学高前欣张有做
张 蕾,周 萌,倪勤学,陈 龙,王 姝,束 旭,高前欣,张有做*
(1. 浙江科技学院 生物与化学工程学院,浙江 杭州 310023;2. 浙江省农产品化学与生物加工技术重点实验室,浙江 杭州 310023;
3. 浙江农林大学农业与食品科学学院,浙江 临安 311300;4. 浙江省农产品品质改良技术研究重点实验室,浙江 临安 311300)
大越豆芋花醇提物抗氧化及α-葡萄糖苷酶抑制活性研究
张 蕾1,2,周 萌3,4,倪勤学3,4,陈 龙3,4,王 姝3,4,束 旭3,4,高前欣3,4,张有做3,4*
(1. 浙江科技学院 生物与化学工程学院,浙江 杭州 310023;2. 浙江省农产品化学与生物加工技术重点实验室,浙江 杭州 310023;
3. 浙江农林大学农业与食品科学学院,浙江 临安 311300;4. 浙江省农产品品质改良技术研究重点实验室,浙江 临安 311300)
采用石油醚、乙酸乙酯、正丁醇对大越豆芋(Apios americana)花醇提物水溶液进行分极萃取,通过比色法测定醇提物及4个极相的总皂苷、总酚及总黄酮含量,2,2’-二苯基-1-苦味酰苯肼(DPPH)法、2,2’-连氮-双(3-乙苯基并噻唑-6-磺酸盐)(ABTS)法及铁离子还原/抗氧化能力(FRAP)分析法测定抗氧化能力,96孔板法检测对α-葡萄糖苷酶的抑制活性。结果表明:大越豆芋花醇提物及4个分极组分中,乙酸乙酯相的有效成分含量(总皂苷29.04%,总酚14.88%,总黄酮11.76%,占提取物质量分数)及α-葡萄糖苷酶抑制活性(IIC50值为137.12 mg/L)均最高,其抗氧化活性(对DPPH及ABTS+自由基的半抑制浓度分别为77.54 mg/L和14.42 mg/L,FRAP值为6.68 mmol/L)显著高于醇提物及其它组分(P < 0.05)。
大越豆芋花;有效成分;抗氧化;α-葡萄糖苷酶
大越豆芋(Apios americana)原产于北美,属多年生豆科蝶形花亚科植物,植株3 ~ 4 m,叶子8 ~ 15 cm,羽状。每年6-8月开花,花呈红棕色到紫色,总状花序[1]。自2009年引进Apios americana(暂定名为“大越豆芋”)后,现已在浙江宁波、温州、丽水、杭州、金华等地试种。国外研究表明,大越豆芋具有降低患癌症风险[2]、清除自由基、激活细胞中的抗氧化体系[3]、减少多种形式癌症发病率[4~5]等特殊功效,还被认为是一种能预防高血压和高血脂的健康食品[6]。小笠原康雄[7]等人研究了大越豆芋块茎和花的糖类组成,发现花的研磨样品中单糖和寡糖、淀粉、细胞壁多糖的含量大致为192、179、131 mg/g,单糖和寡糖中大部分是葡萄糖和果糖。当前研究大多集中在其块茎,事实上,许多欧美国家及日本民间都有饮用大越豆芋花茶稳定血糖、血脂的习惯,对其降血糖活性部位、有效成分及作用机理的研究却鲜有报道。α-葡萄糖苷酶抑制剂因能降低餐后高血糖,是一种有效的降糖药[8~9]。因此建立体外α-葡萄糖苷酶抑制模型,可以筛选出大越豆芋花中的降血糖活性部位。本研究通过测定大越豆芋花醇提物及不同分极组分的有效成分含量,抗氧化活性及对α-葡萄糖苷酶的抑制活性,为大越豆芋花降血糖活性部位的筛选及其精深加工提供依据。
1 实验材料与仪器
1.1 材料
实验原料大越豆芋花于2013年6月底采收自浙江农林大学官塘基地,采下后立即清洗、去杂,60±2℃烘干,粉碎备用。
1.2 试剂
乙醇、石油醚、正丁醇、甲醇均为分析纯,购自天津市永大化学试剂有限公司;乙酸乙酯,分析纯,购自杭州双林化工试剂厂;2,4,6-三吡啶-s-三吖嗪(TPTZ),质量分数99%,购自阿拉丁试剂公司;二甲基亚砜(DMSO),质量分数>99.9%,购自生工生物工程有限公司;2,2’-二苯基-1-苦味酰苯肼(DPPH)、2,2’-连氮-双(3-乙苯基并噻唑-6-磺酸盐)(ABTS)、α-葡萄糖苷酶(α-glucosidase)、4-硝基苯-α-D-吡喃葡萄糖苷(4-N-trophenyl-α-D-glucopyranoside, PNPG)、阿卡波糖(acarbose),质量分数均 > 98%,购自美国Sigma公司。
1.3 仪器
UV-1800紫外可见分光光度计,日本岛津;Multiskan MK3 酶标仪,美国Thermo Electron公司;RE-52A旋转蒸发器,亚荣(上海)生化仪器厂;舒美牌KQ5200DE台式数控超声波清洗器,昆山市超声仪器有限公司;AL104电子天平,梅特勒-托利多仪器(上海)有限公司;ZK-82B电热真空干燥箱:上海实验仪器厂有限公司。
2 方法
2.1 样品制备
称取大越豆芋花粉末2 kg,用无水乙醇5 L反复浸提多次,至提取液基本无色。合并提取液,抽滤、旋蒸挥干乙醇,水溶后依次用等体积石油醚、乙酸乙酯、正丁醇萃取,每种溶剂各4次,合并萃取液,减压干燥挥干溶剂,即得石油醚相、乙酸乙酯相、正丁醇相浸膏状固体,余下溶液挥干水分即为水相。四个组分先用少量DMSO溶解,再用乙醇配制成10 g/L的样品溶液备用。
2.2 有效成分含量的测定
2.2.1 总皂苷含量测定 参照文献[10]的方法加以改进。以吸光值为纵坐标(y),浓度为横坐标(x),绘制标准曲线,得到回归方程y = 0.038 5x-0.177 3,r = 0.999 4。将2.1中制备的样品稀释至适当浓度,测定吸光值,由标准曲线的回归方程计算样品中的总皂苷含量。
2.2.2 总黄酮含量测定 参照文献[11],以吸光值为纵坐标(y)、浓度为横坐标(x)绘制标准曲线,得到回归方程y = 5.577 5x+0.005 3,r = 0.998 7。计算各样品的总黄酮含量。
2.2.3 总酚含量测定 用Folin-Ciocaileu比色法[12]测定。以吸光值为纵坐标(y),溶液浓度为横坐标(x),绘制标准曲线,得回归方程y = 59.044 6x+0.000 1,r = 0.999 0。计算各样品的总酚含量。
2.3 抗氧化活性
2.3.1 DPPH自由基清除能力 采用DPPH法[13]测定样品和Vc的DPPH自由基清除能力。
2.3.2 ABTS+自由基清除能力 参照文献[14]方法加以改进。取176 μL浓度为140 mmol/L的过硫酸钾水溶液,加入到10 mL浓度为3.84 g/L的ABTS溶液(蒸馏水溶解)中混合,避光反应12 ~ 16 h,得ABTS+溶液。测定前加入无水乙醇将ABTS+溶液稀释至734 nm下吸光值为0.700 ± 0.02。将2 mL稀释好的ABTS+溶液与2 mL不同浓度的样品溶液混合摇匀,在室温下反应6 min。以无水乙醇为空白试剂将分光光度计调零,在734 nm波长下测定吸光值A。2 mLABTS+溶液与2 mL乙醇(样品提取和稀释用的溶剂)为空白对照,测得吸光值A0。每组样品平行测3次,计算样品对ABTS+自由基的清除率,ABTS+自由基清除率计算公式如下。
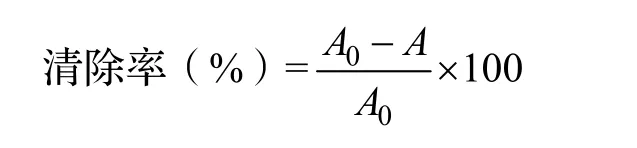
式中:A0为空白对照吸光值;A为样品吸光值。
2.3.3 铁离子还原能力 采用FRAP法[15]检测大越豆芋花不同分极组分的铁离子还原能力。
2.4 α-葡萄糖苷酶抑制活性
2.4.1 α-葡萄糖苷酶抑制活性测定 参照黄元[16]建立的方法加以改进。反应体系为:1 667 nkat/L的α-葡萄糖苷酶50 µL,加入样品溶液50 µL,37℃水浴恒温20 min,再加入0.116 mol/L的PNPG 50 µL,37℃水浴恒温20 min,最后加入1 mol/L的碳酸钠溶液100 µL,终止反应,于405 nm波长下测定D(405)值。用0.05 mol/L的磷酸盐缓冲液(pH6.8)代替酶液作对照,0.05 mol/L的磷酸盐缓冲液代替样品作空白对照,缓冲液作空白。酶活性抑制率计算公式如下。

式中:A为样品的吸光值; A'为对照组吸光值;A0为空白对照组吸光值; A'0为空白组吸光值。以阿卡波糖作阳性对照,按上述方法计算样品和阿卡波糖的抑制活性。
2.4.2 α-葡萄糖苷酶抑制类型 取样品稀释成5个不同浓度,底物PNPG也取5个不同浓度([C]),固定酶浓度不变的情况下,分别测定加入不同浓度样品时的酶反应速度(v)。为计算方便,将反应速度规定为10min产生对硝基苯酚(PNP)的吸光值的变化。以1/v为纵坐标,1/[C]为横坐标,按Lineweave-Burk作图法绘制样品的抑制作用动力学曲线。再通过这些曲线中的直线斜率和纵轴截距,对样品浓度作图,求出抑制常数Ki[17]。
2.5 数据处理
实验结果采用SPSS19.0统计软件进行数据分析,方差分析运用Duncan新复极差法,数据以± S表示。
3 结果与分析
3.1 大越豆芋花醇提物不同分极组分有效成分含量
大越豆芋花醇提物及不同分极组分的有效成分含量见表1。由表1可以看出,大越豆芋花醇提物不同分极组分的总皂苷、总酚及总黄酮含量存在显著差异。三种成分在乙酸乙酯相中的含量最高,在石油醚相中最低,前者的总皂苷、总酚及总黄酮含量分别为 29.04%,14.88%和 11.76%(占提取物质量分数)。另外,乙酸乙酯相中总皂苷含量显著高于醇提物及其他分极组分(P < 0.05),说明通过石油醚、乙酸乙酯、正丁醇依次萃取,可以实现大越豆芋花皂苷的粗分离。

表1 大越豆芋花醇提物不同分极组分总皂苷、总酚及总黄酮含量(n=3)Table 1 Contents of total saponins, polyphenols and flavonoids in different extracts from the ethanol extract of A. americana’s flower (n=3)
3.2 大越豆芋花醇提物不同分极组分抗氧化活性
通过DPPH法、ABTS法和FRAP法测定样品的抗氧化活性,用Vc作阳性对照,得出的抗氧化性能见表2。从表2可以看出大越豆芋花的四个分极组分均有一定的抗氧化能力,且三种抗氧化体系中乙酸乙酯相抗氧化能力最强,显著高于醇提物及其它组分(P < 0.05),说明经过萃取可以得到抗氧化能力显著提高的活性部位。DPPH法和ABTS法测得的抗氧化能力从大到小为:Vc > 乙酸乙酯相 > 水相 > 正丁醇相 > 醇提物 > 石油醚相,FRAP法测得的抗氧化能力则为Vc > 乙酸乙酯相 > 醇提物 > 正丁醇相 > 水相 > 石油醚相。由此可知,主要的抗氧化活性物质在乙酸乙酯相中。乙酸乙酯相对DPPH与ABTS+自由基清除的IIC50值分别为77.54 mg/L与14.42 mg/L,铁离子还原力FRAP值为6.68 mmol/L。

表2 大越豆芋花醇提物不同分极组分DPPH、ABTS+半抑制浓度及铁离子还原力(n=3)Table 2 Half inhibitive concentration of DPPH, ABTS+and ferric reducing antioxidant power of different extracts from the ethanol extract from A. americana’s flower (n=3)
3.3 α-葡萄糖苷酶抑制活性
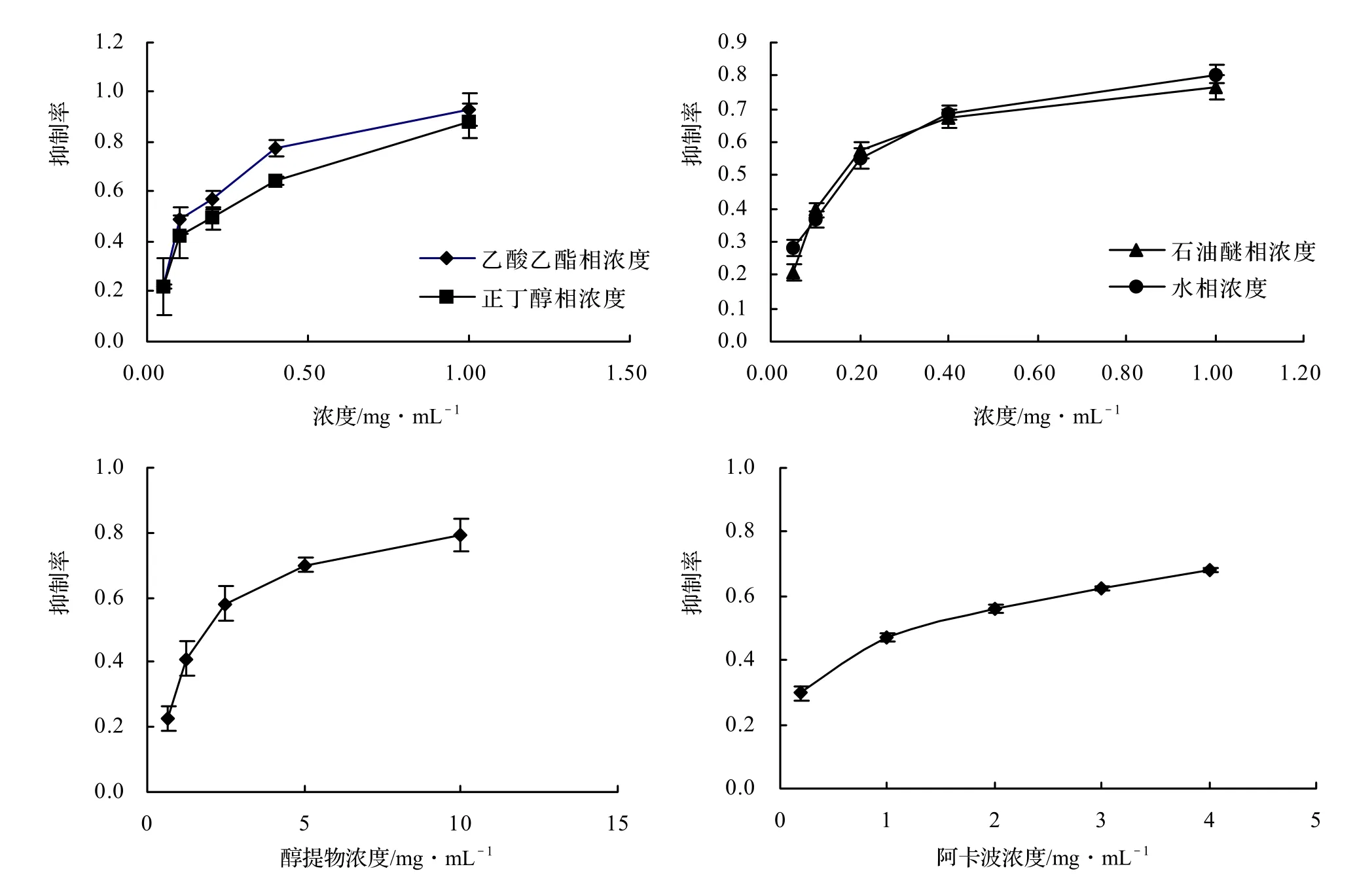
图1 大越豆芋花醇提物不同分极组分对α-葡萄糖苷酶的抑制作用Figure 1 The inhibitory activity of different extracts from the ethanol extract from A. americana’s flower on α-glucosidase
大越豆芋花不同分极组分及阿卡波糖的α-葡萄糖苷酶抑制活性见图1、图2。从图中可以看出,大越豆芋花的四个分极组分对α-葡萄糖苷酶的半抑制浓度显著小于阿卡波糖(P < 0.05),和阿卡波糖(IIC50值为1 093.53 mg/L)相比,四个组分的半抑制浓度均较低,说明具有很高的α-葡萄糖苷酶抑制活性。4组分间的抑制活性无显著差异(P > 0.05),但都高于醇提物,其中乙酸乙酯相抑制效果最好,其IIC50值为137.12 mg/L。大越豆芋花醇提物及其分极组分对α-葡萄糖苷酶的抑制作用,从大到小为:乙酸乙酯相 > 水相 > 正丁醇相 >石油醚相 > 阿卡波糖 > 醇提物。
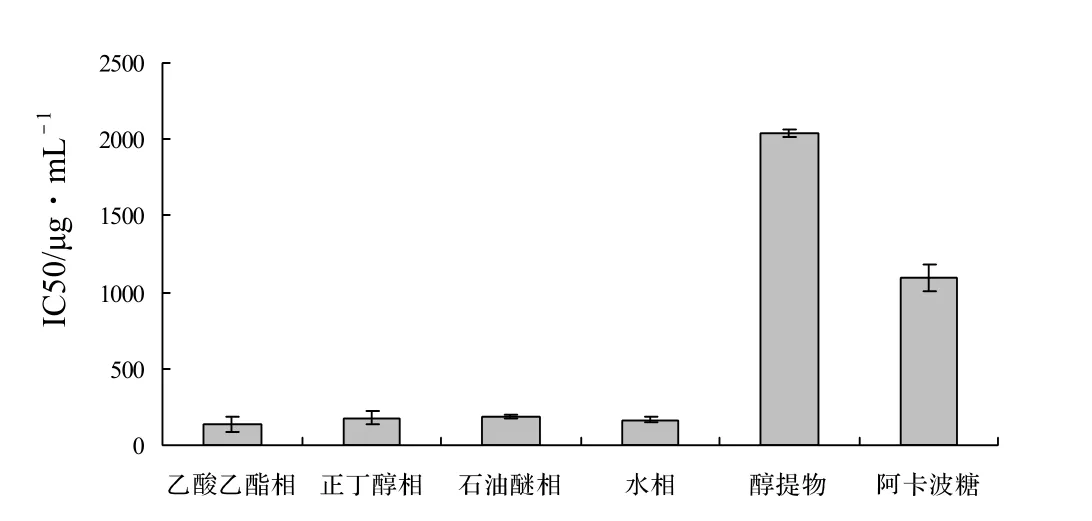
图2 大越豆芋花醇提物不同分极组分的α-葡萄糖苷酶半抑制浓度Figure 2 Half inhibitive concentration of different extracts from the ethanol extract from A. americana’s flower on α-glucosidase
3.4 α-葡萄糖苷酶抑制类型
通过抗氧化实验和α-葡萄糖苷酶抑制活性实验可知,乙酸乙酯相是四个分极组分中活性最好的,因此为了进一步测定乙酸乙酯相对α-葡萄糖苷酶的抑制类型,在测定酶活力的反应体系中,固定酶浓度,改变底物的浓度,加入 0.00、0.05、0.10、0.20、0.40 g/L的乙酸乙酯相待测溶液,测定酶反应速度,以Lineweave-Burk双倒数作图法绘制抑制作用动力学曲线,结果如图 3。从图 3-a中可以看出,随着抑制剂浓度的增大,反应速度vmax保持不变,说明该抑制剂对α-葡萄糖苷酶的抑制作用属于竞争性抑制,即在与酶的结合上,抑制剂与底物有竞争性。该抑制剂与α-葡萄糖苷酶底物PNPG的化学结构相似,在该酶上的结合位点是一样的,抑制剂与酶形成了EI复合物后,使酶不能再与底物结合,从而抑制了酶的活性[18]。通过抑制作用动力学曲线的直线斜率(y),对抑制剂浓度(x)作图(图3-b),得出回归方程y = 11.910 0x+2.635 5,r = 0.955 5,由此可知大越豆芋花醇提物中的乙酸乙酯相对α-葡萄糖苷酶的抑制常数Ki值为11.91 g/L。
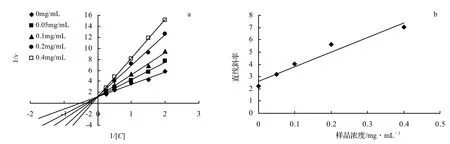
图3 乙酸乙酯相的Lineweave-Burk双倒数曲线与抑制常数曲线Figure 3 Lineweaver-burk plot and inhibition constant curve of ethyl acetate extract
3.5 有效成分含量与抗氧化活性及α-葡萄糖苷酶抑制活性的相关性
考察大越豆芋花石油醚相、乙酸乙酯相、正丁醇相、水相中有效成分含量与抗氧化活性及α-葡萄糖苷酶抑制活性之间的相关性,结果见表3。从表3可以发现,总皂苷、总酚及总黄酮含量均与α-葡萄糖苷酶抑制能力有很大的相关性,R2达到了0.8以上,且其中总皂苷与α-葡萄糖苷酶抑制能力的相关性高于总酚和总黄酮,说明大越豆芋花提取物中对α-葡萄糖苷酶起抑制作用的主要成分是总皂苷。此外,DPPH、ABTS+清除率与总酚、总黄酮之间的相关性较大,且总黄酮大于总酚,说明黄酮类物质对清除DPPH自由基与ABTS+自由基有着重要作用。而铁离子还原力与总皂苷的相关性大于总酚、总黄酮,因此,具有铁离子还原能力的主要成分为大越豆芋花总皂苷。同时,α-葡萄糖苷酶抑制能力与各抗氧化指标的相关性有较大差别,其与铁离子还原力的相关性明显高于与DPPH清除率和ABTS+清除率的相关性,R2达到了 0.8以上,说明α-葡萄糖苷酶抑制能力与铁离子还原能力的关联最大。

表3 有效成分含量与抗氧化活性及α-葡萄糖苷酶抑制活性的相关系数Table 3 Correlation coefficient between the content of effective components, antioxidant activities and the inhibitory activity on α-glucosidase
4 结论
大越豆芋花提取物中含有多种次生代谢物,其中乙酸乙酯相含有较多的总皂苷、总黄酮及总酚,且这些物质在不同分极组分中的量存在显著差异。4个组分均有一定的抗氧化能力,其中乙酸乙酯相抗氧化效果最好,明显高于其他相。可见具有抗氧化活性的物质主要集中在乙酸乙酯相。
和阿卡波糖相比,大越豆芋花 4个组分的半抑制浓度都较低,具有很高的α-葡萄糖苷酶抑制活性,而抑制效果最好的是乙酸乙酯相,其IIC50值为137.12 mg/L。且该抑制作用与样品浓度之间存在剂量——效应关系,随着浓度的增大,其对α-葡萄糖苷酶的抑制作用增强,这种抑制作用还与大越豆芋花总皂苷有很大的相关性,相关系数R2达到了0.98以上,说明大越豆芋花提取物中主要的α-葡萄糖苷酶抑制活性成分是总皂苷。此外,抑制作用最好的乙酸乙酯相对α-葡萄糖苷酶的抑制类型属于竞争性抑制,它与底物PNPG在α-葡萄糖苷酶上的结合位点是一样的,但具体抑制机理不甚明了。本文只针对体外抗氧化和α-葡萄糖苷酶抑制活性进行了研究,体内实验还有待进一步验证。
本文通过不同极性的有机溶剂对大越豆芋花醇提物水溶液进行分极萃取,得到了具有一定抗氧化活性和较好α-葡萄糖苷酶抑制活性的分极组分,对进一步分离具有更好生物活性的部位奠定了研究基础,也为日后将大越豆芋开发成具有降血糖作用的花茶、营养强化剂或功能性饮料等提供了科学的理论基础和实验依据。
[1] Carlisi J, Wollrad D. History, culture, and nutrition of Apios americana[J]. J Nutra, Funct Med Foods, 2004(4):85-92.
[2] Zhang You-zuo, Zhou Cun-shan, Tang Shun-ming, et al. Effect of AATI, a Bowman-Birk type inhibitor from Apios americana,on proliferation of cancer cell lines[J]. Food Chem, 2011, 128(4):909-915.
[3] Takashima M, Nara K, Niki E, et al. Evaluation of biological activities of a groundnut (Apios americana Medik) extract containing a novel isoflavone[J]. Food Chem, 2013, 138(1):298-305.
[4] Krishnan H B. Identification of genistein, an anticarcinogenic compound, in the edible tubers of the American groundnut (Apios americana Medikus)[J]. Crops Sci, 1998, 38(4):1 052.
[5] Nrar K, Nihei K, Ogasawara Y, et al. Novel isoflavone diglycoside in groundnut (Apios americana Medik)[J]. Food Chem, 2010, 123(3):703-710.
[6] Iwai K, Matsue H. Ingestion of Apios americana Medikus tuber suppresses blood pressure and improves plasma lipids in spontaneously hypertensive rats[J]. Nutr Res, 2007(27):218-224.
[7] Ogasawara Y, Hidano Y, Kato Y. Study on carbohydrate composition of Apios (Apios americana Medikus) flowers and tubers[J]. Nippon Shokuhin Kagaku Kogaku Kaishi, 2006, 53(2):130-136.
[8] 顾觉奋,陈紫娟. α-葡萄糖苷酶抑制剂的研究及应用[J]. 药学进展,2009,33(2):62-67.
[9] Azuma K, Toyofuku Y, Iesaki T, et al. Acarbose, an α-glucosidase inhibitor, improves endothelial dysfunction in Goto-Kakizaki rats exhibiting repetitive blood glucose fluctuation[J]. BiochemBiophys Res Commun, 2006, 345(2):688-693.
[10] 申海艳,龚小见,李文敏,等. 苗药黑骨藤中总皂苷含量的测定[J]. 中国实验方剂学杂志,2012,18(11):94-97.
[11] 王喜周,应跃跃,陈学智,等. 全叶榕营养成分分析及黄酮的测定[J]. 浙江农林大学学报,2013,30(2):304-308.
[12] 何文静,张帆,田树革,等. Folin-Ciocaileu比色法测定啤酒花中总酚的含量[J]. 中国实验方剂学杂志,2011,17(5):58-60.
[13] 连喜军,王亮,王吰,等. DPPH法研究不同品种甘薯抗性淀粉抗氧化性[J]. 粮食与油脂,2009(6):26-28.
[14] 唐艳平,张伟敏,陈文学,等. 腰果梨渣多酚提取及抗氧化性研究[J]. 食品科学,2010,31(20):240-245.
[15] Ardestani A, Yazdanparast R. Inhibitory effects of ethyl acetate extract of Teucrium polium on in vitro protein glycoxidation[J]. Food Chem Toxicol, 2007, 45(12):2 402-2 411.
[16] 黄元,陈睿,马继雄,等. 高寒菊科植物提取物中α-葡萄糖苷酶抑制剂的筛选[J]. 中国药科大学学报,2008,39(6):566-569.
[17] 寇彤,孟晓敏,常建涛,等. 何首乌对α-葡萄糖苷酶活性的抑制作用[J]. 大连轻工业学院学报,2006,25(4):239-241.
[18] 吴梧桐. 生物化学(第二版)[M]. 北京:中国医药科技出版社,2010. 202.
Antioxidant and Inhibitory Activities on α-Glucosidase of Ethanol Extracts from Apios americana’s Flower
ZHANG Lei1,2,ZHOU Meng3,4,NI Qin-xue3,4,CHEN Long3,4,WANG Shu3,4,SHU Xu3,4,GAO Qian-xin3,4,ZHANG You-zuo3,4*
(1. Zhejiang University of Science & Technology, Hangzh ou 310 023, China; 2. Zhejiang P rovincial Key Lab for Chem & Bio P rocessing Technology of A gricultural Products, Hangzhou 31 0023, China; 3. College of A griculture and F ood Science, Zhejiang A & F University, Lin’an 311300, China; 4. Key Lab for Quality Improvement of Agricultural Products of Zhejiang, Zhejiang A & F University, Lin’an 311300, China)
Solution of ethanol extracts from Apios american’s flower was extracted with petroleum ether, ethyl acetate and n-butanol in turn. The total saponins, polyphenols and flavonoids content of the extracts were measured by colorimetric method. Their antioxidant capacities were detected by DPPH, ABTS, FRAP method, and the inhibitory activity of α-glucosidase was detected by 96-well plate method. Results demonstrated that ethyl acetate extract had the most total saponins (29.04%), polyphenols (14.88%) and flavonoids (11.76%), and its inhibitory effect on α-glucosidase was the best ( IIC50=137.12mg/L). Besides, the antioxidant capacities were significantly stronger (IIC50of DPPH and ABTS+radicals were 77.54 mg/L and 14.42 mg/L, and the FRAP value was 6.68 mmol/L).
flower of Apios americana; effective components; antioxidant; α-glucosidase
S718.43
A
1001-3776(2014)04-0005-06
2014-03-11;
2014-06-05
浙江省大学生科技创新活动计划(2013R412042);浙江农林大学创新训练项目(201201006);浙江省农产品化学与生物加工技术重点实验室开发项目(2013KF0304)
张蕾(1981-),女,浙江杭州人,助理研究员,博士,从事药用植物功效研究;*通讯作者。
