肠膜明串珠菌6055生产低聚葡萄糖的研究
2014-05-17干苏灵张柏林
张 寅,干苏灵,张柏林,*
(1.北京林业大学生物科学与技术学院食品科学与工程系,北京100083;2.江苏绿扬现代生态农业发展有限公司,江苏扬州225105)
功能性低聚糖通常被称作“益生元”,是一类由2~10个单糖通过糖苷键连接形成的短链糖类聚合物,分子量约为 300~2000u[1]。大多数低聚糖具有整肠、低热量、增强机体免疫力等功效[2-3]。功能性低聚葡萄糖因其能够选择性刺激肠道中有益微生物的生长和活力,而被广泛应用到多种功能性食品当中[4-5]。
低聚糖可以通过多条途径获得[6-8],包括:a.从植物材料中提取(如低聚半乳糖和低聚果糖);b.多糖的限制性酶解(如低聚木糖和低聚果糖);c.酶促合成(如低聚果糖,β-低聚半乳糖,β-低聚葡萄糖和α-低聚葡萄糖)。目前,国内主要通过淀粉水解制备低聚葡萄糖,但是其制备的功能性低聚糖产物中存在较多的单糖、二糖和麦芽糊精,它们都属于能被人体消化和吸收的碳水化合物,不能够选择性的刺激肠道中有益微生物的生长和活力,极大的降低了功能性低聚糖的功效,而且该方法成本较高,导致低聚糖在工业生产中的应用受到很大的限制。
肠膜明串珠菌自身能够合成多种关键酶,如葡聚糖蔗糖酶和蔗糖磷酸化酶[9]。在有蔗糖存在的条件下,肠膜明串珠菌能够利用葡聚糖蔗糖酶催化生成聚合度不同的低聚糖[10-11]。肠膜明串珠菌NRRLB-18242代谢生成的α-低聚葡萄糖对肠道中的多种消化酶具有极高的耐受性[12]。本研究尝试采用生物发酵法制备功能性低聚糖,通过对肠膜明串珠菌6055发酵培养基的选择、培养条件的优化、产物低聚葡萄糖的纯化及其益生性等方面的研究,旨在建立利用肠道明串珠菌发酵制备功能性低聚葡萄糖的具体工艺路线。
1 材料与方法
1.1 材料与仪器
肠膜明串珠菌(Leuconostocmesenteroides subsp.mesenteroides 6055)、酿酒酵母(Saccharomyces cerevisiae BJFU9.0017)购自中国工业微生物菌种保藏管理中心(CICC);嗜酸乳杆菌NCFM(Lactobacillus acidophilus NCFM)、两歧双歧杆菌(Bifidobacterium bifidum Bb-02)商业化益生菌菌株 由上海丹尼斯克公司提供。葡萄糖、蔗糖、麦芽糖、甘露醇、果糖和潘糖(色谱级)Sigma公司;商业低聚葡萄糖(纯度95%)上海三丰生物技术有限公司;其他试剂 均为分析纯。G1362A示差折光检测器、Agilent1200高效液相色谱仪 迪马公司;UV3010紫外可见分光光度计 日立公司;PHSI-3F实验室pH计 上海雷磁仪器厂;FA1604N电子分析天平 上海天平仪器厂。
1.2 实验方法
1.2.1 低聚葡萄糖定量测定
1.2.1.1 糖标样的制备 精密称取麦芽糖、蔗糖、甘露醇、潘糖和果糖标样各100mg,加去离子水溶解,于250mL容量瓶中定容,摇匀备用。
1.2.1.2 样品溶液的制备 离心除去发酵液中的细胞,上清液经0.4μm滤膜过滤,去离子水稀释4000倍后利用Agilent1200高效液相色谱仪进行色谱分析。
1.2.1.3 色谱条件 G1362A示差折光检测器;色谱柱:Inertsil SIL-100A NH2(4.5×250mm,迪马公司);柱温:室温;流动相:乙腈∶水 =75∶25(V/V);流速:1.0mL/min;进样量:10μL。
1.2.2 菌株的培养
1.2.2.1 膜明串珠菌6055的培养 将活化三代的膜明串珠菌6055接种于MRS液体培养基中,置于30℃下恒温培养18h,测定菌体发酵液中低聚葡萄糖的产量及菌体细胞生物量。
1.2.2.2 酿酒酵母的培养 将活化三代的酿酒酵母以2%的比例接种于200mL YEPD培养基中,在30℃恒温条件下以100r/min的转速振荡培养18h。发酵液在8000×g转速下冷冻离心20min,弃去上清液保留酵母细胞。
1.2.3 细胞生物量测定 离心分离培养的菌体细胞,生理盐水洗涤后进行梯度稀释,利用UV3010紫外可见分光光度计于600nm处测其吸光度A值,同时测定细胞干重C(g/L),绘制吸光度A值与细胞干重的标准曲线。根据样品的吸光度A值,并利用标准曲线方程计算出菌体的细胞干重。
1.2.4 菌株6055产低聚葡萄糖发酵条件的优化研究1.2.4.1 菌株培养基的优化 以MRS培养基为基础培养基,分别考察蔗糖与麦芽糖比例、氮源、微量元素对膜明串珠菌6055低聚葡萄糖产量的影响。
1.2.4.2 菌株培养条件的优化 根据高莉莉等关于肠膜明串株菌6055培养的单因素实验[13]对接种量、初始pH培养、温度三个因素进行优化,分别记为变量A、B、C,每个因素取3个水平;以低聚葡萄糖产量为响应值,记为Y;利用Box-Behnken设计实验方案。按照实验方案,不同培养条件下培养肠膜明串珠菌6055。实验因素及水平见表1。
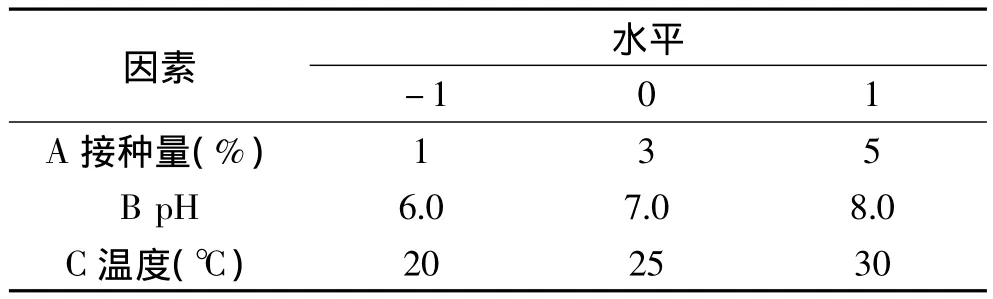
表1 响应面实验的因素和水平Table 1 Factors and levels of response surface analysis
1.2.5 低聚葡萄糖的纯化研究 菌株6055发酵液离心后取上清液进行冷冻浓缩,制备低聚葡萄糖浓缩液。以2.0%(v/v)的接种量,将活化好的酿酒酵母接入250mL低聚葡萄糖浓缩液中,30℃下100r/min振荡培养36h。每隔4h取样,HPLC法检测上清液中低聚葡萄糖、双糖和单糖的含量变化(g/L)。
1.2.6 低聚葡萄糖益生性的研究 将实验制得的低聚葡萄糖溶于MRS和TPY培养基中,配成2%低聚葡萄糖培养基,灭菌后分别接入嗜酸乳杆菌、双歧杆菌,37℃厌氧培养24h,以添加葡萄糖的培养基作为对照,采用比浊法和活菌计数法研究低聚葡萄糖对嗜酸乳杆菌、双歧杆菌生长情况的影响,菌落数表达为log CFU/mL。
1.2.7 数据统计分析 以上实验均重复3次,并通过SPSS 17.0软件进行ANOVA方差分析,利用Origin 8.0软件进行绘图。
2 结果与分析
2.1 发酵条件对低聚葡萄糖产量的影响
2.1.1 菌株培养基的优化
2.1.1.1 蔗糖与麦芽糖比例 以蔗糖和麦芽糖为碳源,在其总量为150g/L的前提下,选择蔗糖和麦芽糖的添加比例分别为 2∶1,4∶1,5∶1,7∶1,测得低聚葡萄糖的产量及菌体细胞生物量如图1所示。由图可知,当蔗糖和麦芽糖比例为2∶1时,低聚葡萄糖的产量最高,为1.82g/L;此时,菌株6055表现出最好的生长状态,菌体细胞生物量达到0.48g/L。菌体的生长情况与低聚糖产量呈正相关。

图1 不同碳源对低聚葡萄糖产量及肠膜眀串珠菌6055生长的影响Fig.1 Effect of different carbohydrates sources on synthesis of oligosaccharides and the growth of Leuconotoc mesenteroides
2.1.1.2 氮源 以1%的大豆蛋白胨、胰蛋白胨、酵母膏、蛋白胨和硫酸铵为氮源,测得低聚葡萄糖的产量及菌体细胞生物量如图2所示。由图2可知,当添加酵母膏作为氮源时,低聚葡萄糖的产量最高,为2.08g/L;此时,菌株6055表现出较好的生长状态,菌体细胞生物量达到0.47g/L。菌体的生长情况与低聚糖产量呈正相关。

图2 不同氮源对低聚糖葡萄产量和肠膜眀串珠菌生长的影响Fig.2 Effect of different nitrogen sources on synthesis of oligosaccharides and the growth of Leuconotoc mesenteroides
2.1.1.3 微量元素 在培养基中分别添加0.2%的柠檬酸钠、氯化钙、硫酸锰、硫酸镁、磷酸氢二钾、硫酸亚铁作为微量元素,测得低聚葡萄糖的产量及菌体细胞生物量如图3所示。由图3可知,当添加K2HPO4和吐温80时,低聚葡萄糖的产量会明显提高,其产量分别为2.96和2.80g/L;此时,菌株6055表现出最好的生长状态,菌体细胞生物量分别为0.51和0.50g/L。菌体的生长情况与低聚葡萄糖产量呈正相关。
综上所述,实验确定菌株6055的最适培养基为:蔗糖100g/L,麦芽糖50g/L,酵母膏5g/L,磷酸氢二钾3g/L,吐温80 2mL。
2.1.2 菌株培养条件的优化 根据高莉莉等关于肠膜明串株菌6055培养的单因素实验[13]对接种量、发酵温度和pH进行优化,设计的响应面实验共17个实验点,实验1~12为析因点,实验13~17为0点,是区域的中心点。中心实验重复5次,以减少误差。实验设计及实验结果见表2。

图3 矿物元素对低聚糖产量和肠膜眀串珠菌生长的影响Fig.3 Effect of different mineral elements on synthesis of oligosaccharides and the growth of Leuconotoc mesenteroides

表2 Box-Behnken实验设计和实验结果Table 2 The Box-Behnken experimental design and results
通过SAS软件的响应面回归过程对实验数据进行分析,建立的各实验因子与响应值之间回归方程如下所示:
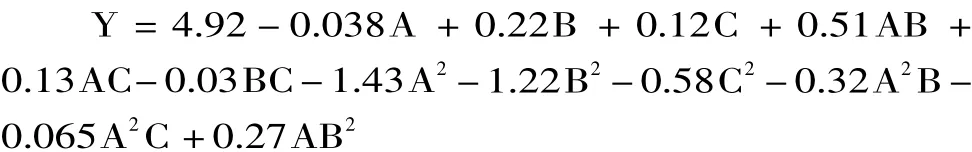
回归方程中各变量对指标(响应值)影响的显著性,由F检验来判定。pH和温度的p值小于0.05,表明其对低聚葡萄糖产量的影响显著,但接种量的p值大于0.1表明其影响不显著。温度和pH交互作用的p值小于0.05,表明其对低聚葡萄糖产量的影响显著,而接种量和pH与接种量和温度的交互影响均不显著。整体的回归方程的p值小于0.05,回归方程也是显著的。相关系数R2=0.9989,说明响应值(低聚葡萄糖产量)的变化有99.89%来源于所选变量,即接种量,培养温度和pH。因此,实验方程与实际数据之间具有非常好的拟合性。
根据回归方程,可由SAS软件作出响应面立体图(图4~图6)。由SAS响应面优化图可以看出:初始pH和温度对低聚葡萄糖产量的影响极显著;接种量对低聚葡萄糖产量也有一定影响,但不显著。

表3 变量对应值的方差分析及显著性评价Table 3 Analysis of Variance shoeing significance of variables on responses
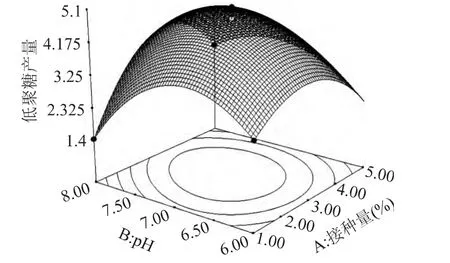
图4 接种量(A)和pH(B)对低聚葡萄糖产量的影响Fig.4 Response surface plot showing the interactive effects of inoculum concentration and initial pH on glucooligosaccharides yield at a fixed level of lincubation temperature
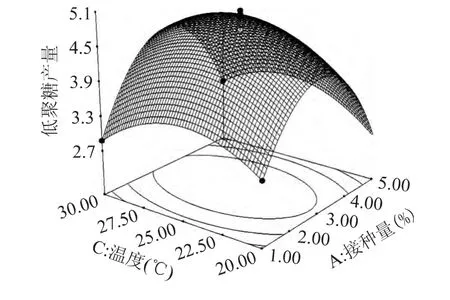
图5 接种量(A)和温度(C)对低聚葡萄糖产量的影响Fig.5 Response surface plot showing the interactive effects of inoculum concentration and lincubation temperature on glucooligosaccharides yield at a fixed level of initial pH
通过软件分析得到最优的培养条件是:接种量为3.02%,发酵温度为25.50℃,pH为7.09,在此条件下低聚葡萄糖理论产量是5.09g/L。为了检验响应面分析的可靠性,以及实际操作性,将最优参数修正为接种量3.0%,发酵温度25.0℃,pH7.10,此时低聚葡萄糖产量为5.15g/L,与预测值5.09g/L的相对误差为1.18%。

图6 pH(B)和温度(C)对低聚葡萄糖产量的影响Fig.6 Response surface plot showing the interactive effects of initial pH and lincubation temperature on glucooligosaccharides yield at a fixed level of inoculum concentration
2.2 纯化过程中低聚葡萄糖含量的变化情况
纯化后离心去除酿酒酵母细胞,HPLC检测上清液中低聚糖、双糖以及单糖的含量变化情况,结果如图7所示。

图7 利用酿酒酵母纯化低聚糖产物Fig.7 Purification of oligosaccharide by fermention with Saccharomyces cerevisiae
由图7可知,前12h,果糖和葡萄糖含量下降的速度很快;24h内,葡萄糖和果糖基本被全部清除。前4h,由于总糖度较高,酿酒酵母的发酵作用受到抑制,麦芽糖的降解速度相对较慢;4~12h之间,随着总糖度的降低,底物抑制作用解除,麦芽糖被迅速降解。前28h,可消除100%的果糖和葡萄糖,以及92.8%的麦芽糖,而低聚葡萄糖几乎不被降解,从而使低聚葡萄糖占总糖的比例升高至74.3%。因此,本实验将纯化发酵的时间确定为28h。
2.3 低聚葡萄糖益生性的研究
将嗜酸乳杆菌、双歧杆菌分别接种于以实验制得低聚葡萄糖作为碳源的培养基中,每隔4h取样,以不含低聚葡萄糖的MRS和TPY培养基为对照,测定培养液的吸光值;菌液10倍递增稀释后涂布平板,活菌计数。菌体的生长状况如图8所示。
由图8可知,以葡萄糖为碳源时,嗜酸乳杆菌和双歧杆菌在12h以后才会进入生长稳定期,其最大细胞生物量仅为0.31和0.35g/L,最大活菌数仅为8.58和8.99log CFU/mL;而以低聚葡萄糖为碳源时,菌体在8h时就已进入生长稳定期,最大细胞生物量为0.44和0.54g/L,最大活菌数为9.05和9.43log CFU/mL。
3 讨论
培养基组分明显影响肠膜明串珠菌产低聚葡萄糖的代谢过程[11,14]。Yoo等人证实蔗糖和麦芽糖的比例与低聚糖产量有较大关系[15]。本次研究中证实,蔗糖和麦芽糖比例不同(即2∶1、4∶1、5∶1 和7∶1)低聚糖产量不同,蔗糖和麦芽糖的比例越低低聚糖的产量越大,即当蔗糖和麦芽糖的比例为2∶1时低聚糖的产量最大。Martha Argüello-Morales等人证实酪蛋白、细菌蛋白胨、胰蛋白胨、酵母粉等氮源与膜明串珠菌低聚糖产量存在较大关系[16]。本次研究表明,培养基添加的氮源不同,低聚葡萄糖的产量确实存在明显的差异:当以酵母膏为氮源时菌株6055的低聚葡萄糖产量可达到最高;而以硫酸铵为无机氮源时,低聚葡萄糖产量最低。吐温80和磷酸氢二钾可增加葡聚糖蔗糖酶的活力[17]。本文研究表明,吐温80和磷酸氢二钾可以增加葡聚糖蔗糖酶的活力来增加菌株6055低聚葡萄糖的产量。这与F Mozzi等人有关葡聚糖蔗糖酶的活性越高低聚糖的产量越大的研究结果是一致的[18]。
肠膜明串株菌产低聚葡萄糖的最适培养条件与菌体的最佳生长条件基本相同[19]。而本次研究得到的菌株6055产低聚葡萄糖的最优培养条件是:接种量为3.0%,发酵温度为25.0℃,pH为7.10。由《伯杰氏细菌鉴定手册》可知,此时并没达到菌株6055的最佳生长条件,这与Bellengier等人关于肠膜明串株菌可在亚适宜条件下生成最大量低聚葡萄糖的结论是一致的[20]。
Harder等人证实利用微生物发酵法可去除蔗糖、麦芽糖、葡萄糖等非功能性低聚糖成分[21]。本实验证实在37.5%的低聚葡萄糖发酵液中接入2%的酿酒酵母,发酵28h后,可除去发酵液中100%的果糖和葡萄糖、以及92.8%的麦芽糖,使低聚葡萄糖含量升高至74.3%。因此,利用酿酒酵母除去发酵液中的糖有利于低聚葡萄糖的进一步纯化。
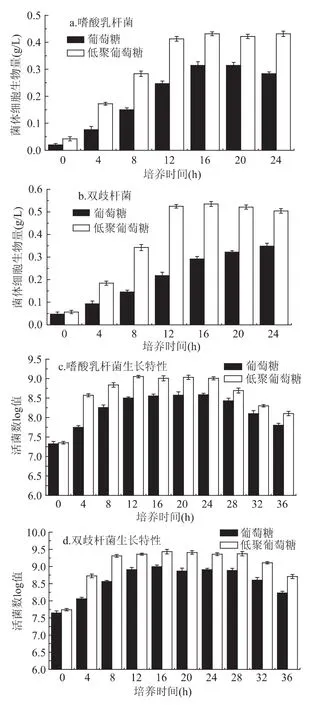
图8 低聚葡萄糖对嗜酸乳杆菌NCFM、双歧杆菌300B生长的影响Fig.8 Influences of oligosacharide sourees on the growth of Bifidobacterium bifidum 300B and Bacillus acidophilus NCFM
功能性低聚糖作为碳源时,能够较为明显的促进双歧杆菌的生长和繁殖[22-23]。采用本研究获得的低聚葡萄糖来替代葡萄糖作为碳源时,商业化嗜酸乳杆菌的最大细胞生物量和最大活菌数分别增加0.13g/L和0.47log CFU/mL,商业化双歧杆菌的最大细胞生物量和最大活菌数分别增加0.19g/L和0.44log CFU/mL,嗜酸乳杆菌和双歧杆菌分别增殖37.9%和48.6%。这一结果说明采用本篇方法获得的低聚葡萄糖具有促进肠道有益微生物生长的效果,或许可以作为潜在的益生元来应用。
4 结论
4.1 优化后肠膜明串珠菌6055发酵条件可以明显提高低聚葡萄糖产量,结合酿酒酵母除糖可以提高功能性低聚葡萄糖的纯度,从而获得了一条完整的肠膜明串珠菌6055发酵生产功能性低聚葡萄糖的工艺路线。
4.2 当采用蔗糖 100g/L,麦芽糖 50g/L,酵母膏5g/L,磷酸氢二钾3g/L,吐温80 2mL的培养基质,通过控制3.0%接种量,发酵温度25.0℃和pH为7.10发酵条件,菌株6055发酵18h生成的低聚葡萄糖量最多,为5.15g/L;进一步采用2%的酿酒酵母发酵28h可以使发酵液中低聚葡萄糖含量从37.5%升高到74.3%。
[1]Chung C.Production of glucooligosaccharides and mannitol from Leuconostoc mesenteroides B-742 fermentation and its separation from byproducts[J].Journal of Microbiolgy and Biotechnology,2006,16(2):325-329.
[2]Howard M D,Gordon D T,Pace L W.Effects of dietary supplementation with fructooligosaccharides on colonic microbiota populations and epithelial cell proliferation in neonatal pigs[J].Journal of Pediatric Gastroenterology and Nutrition,1995,21(3):297-303.
[3]Naughton P J,Lind M L,Jensen B B.Effects of nondigestible oligosaccarides on Salmonella enterica serovar typimurium and nonpathogenic Escherichia coli in the pig small intestine in vitro[J].Applied and Environmental Microbiology,2001,67(8):3391-3395.
[4]O’SullVian S M,Condon S,Cogan T M.Purification and characterization of acetolacate decarboxylase from Leuconostoc Lactis NCW1[J].FEMS Microbiology Letters,2001,194(2):245-249.
[5]Marth E H,Steele J.Applied dairy microbiology[M].New York,Basel:Marcel Dekker,Inc.,2001.
[6]Monsan P F,Paul P.Oligosaccharide feed additives[C]//R.J.Wallace and A.Chesson(Ed.).Biotechnology in Animal Feeds and Animal Feeding.Weinheim,Germany:VCH Velagsgesellshaft mbH,1995:233-245.
[7]Chesson A.Probiotics and other intestinal mediators[C]//D.J.A.Cole,J.Wiseman,and M.A.Varley(eds).Principles of Pig Science.Loughborough,UK:Nottingham University Press,1993:197-214.
[8]Morgan A J,Mul A J,Beldman G.Dietary oligosacchiharidesnew insights[J].Agro Food Industry Hi-tec,1992,5:35-38.
[9]Kobayashi M,Matsuda K.Electrophoretic analysis of the multiple forms of dextransucrase from Leuconostoc mesenteroides[J].Journal of Biochemistry,1986,l00(3):615-621.
[10]Kagan B O,Latker S M,Zfasman E M.Phosphorolysis of saccharose by cultures of Leuconostoc mesenteroidesv[J].Biokhimiya,1942,7:93-108.
[11]Cogan T M,Jordan K N.Metabolism of Leuconostoc baeteria[J].Journal of Dairy Science,1994,77(9):2704-2717.
[12]AarnikunnasJ,Ronnholm K,PalvaA.Themannitol dehydrogenase gene(mdh)from Leuconostoc mesenteroides is distinct from other known bacterial mdh genes[J].Applied Microbiology and Biotcehnology,2002,59(6):665-671.
[13]高莉莉.肠膜明串珠菌发酵生成低聚糖的研究[D].北京林业大学,2009.
[14]Cogan T M.Flavour production by dairy starter cultures[J].Journal of Applied Bacteriology Symposium Supplement,1995,79:49-64.
[15]Miller A W,Robyt J F.Stabilization of dextransucrase from Leuconostoc mesenteroides NRRL B-512F by nonionic detergents,poly(ethylene glycol)and high-molecular-weight dextran[J].Biochim Biophys Acta,1984,785(3):89-96.
[16]Arguello-Morales M,Sanchez-Gonzalez M,Canedo M.Proteolytic rnodification of leuconostoc mesenteroides B-512F dextransucrase[J].Antonie van Leeuwenhoek,2005,87(2):131-141.
[17]Neubauer H,Bauche A,Mollet B.Molecular characterization and expression analysis of the dextransucrase DsrD of Leuconostoc mesenteroides Lcc4 in homologous and heterologous Lactococcus lactis cultures[J].Microbiology,2003,149(4):973-982.
[18]Mozzi F,Oliver G,DE Giori G S.Influence of temperature on the production of exopolysaccharides by thermophilic lactic acid bacteria[J].Milchwissenschaft,1995,50(2):80-82.
[19]Demirci Y,Hemme D.Growth of Leuconostoc mesenteroides strains isolated from French raw milk cheeses in a reference milk[J].Milchwissenschaft,1994,49(9):483-485.
[20]Foucaud C.Nutritional requirements of Leuconostoc mesenteroides subsp.mesenteroidesand subsp.Dextranicum for growth in milk[J].Journal of Dairy Research,1997,64(1):95-103.
[21]ClariceM A,Chagas,Honoratp T L.Dextransucrase production using cashew apple juice as substrate:effect of phosphate and yeastextractaddition[J].Bioprocess and Biosystems Engineering,2007,30(3):207-215.
[22]Gmeiner M,Kneifel W,Kulbe K D.Influence of a synbiotic mixture consisting of Lactobacillus acidophilus 74-2 and a fructooligosaccharide preparation on the microbial ecology sustained in a simulation of the human intestinal microbial ecosystem(SHIME reactor)[J].Applied Microbiology Biotechnology,2000,53(2):219-223.
[23]Kaplan H, Hutkins R W.Fermentation of fructooligosaccharides by lactic acid bacteria and bifidobacteria[J].Applied and Environmental Microbiology,2000,66(6):2682-2684.
