彩色马蹄莲品种‘Parfait’多倍体诱导及其生物学特征变化
2014-05-11刘晓静华小平郑玉红
刘晓静,华小平,陆 波,彭 峰,邓 波,郑玉红,①
〔1.江苏省·中国科学院植物研究所(南京中山植物园),江苏南京210014; 2.东海县花卉产业合作社,江苏东海222300;3.江苏骏马农林科技股份有限公司,江苏张家港215600〕
彩色马蹄莲品种‘Parfait’多倍体诱导及其生物学特征变化
刘晓静1,华小平2,陆 波1,彭 峰1,邓 波3,郑玉红1,①
〔1.江苏省·中国科学院植物研究所(南京中山植物园),江苏南京210014; 2.东海县花卉产业合作社,江苏东海222300;3.江苏骏马农林科技股份有限公司,江苏张家港215600〕
以彩色马蹄莲品种‘Parfait’(Zantedeschia hybrid‘Parfait’)离体丛生芽块为实验材料,对其多倍体诱导过程中秋水仙素和二甲基亚砜(DMSO)浓度以及浸泡时间进行分析,并比较了多倍体与二倍体植株在叶形指数、气孔特征、叶绿素含量和染色体数的差异,最终通过回归分析确定最佳诱导条件。结果显示:随秋水仙素质量体积分数的提高及浸泡时间的缩短,各处理组的丛生芽存活率逐渐增加且均低于对照,而多倍体诱导率逐渐降低且均显著高于对照。综合考虑丛生芽存活率和多倍体诱导率等因素,根据回归分析确定‘Parfait’多倍体诱导的最佳条件为:丛生芽块在含质量体积分数0.20%秋水仙素和体积分数0.10%DMSO的MS液体培养基中浸泡24 h,多倍体诱导率可达50.02%。比较分析结果表明:多倍体植株的叶片长度、厚度和长宽比分别为二倍体植株的1.23、1.19和2.93倍,保卫细胞的长度和宽度以及每气孔叶绿体数分别为二倍体植株的1.90、1.96和2.03倍,叶绿素a和总叶绿素含量分别为二倍体植株的1.28和1.17倍;但多倍体植株的叶宽和气孔密度均较小,分别仅为二倍体植株的42.08%和61.55%。除叶绿素b含量外,多倍体植株的其他生物学特性均与二倍体植株差异显著。染色体计数结果显示:获得的多倍体大多为四倍体,染色体数为2n=64,同时还得到了一些嵌合体和六倍体。研究结果表明:彩色马蹄莲品种‘Parfait’多倍体植株的多数生物学特性优于二倍体植株,且其对环境的适应性更强。
彩色马蹄莲品种;多倍体;诱导条件;秋水仙素;生物学特性;染色体数
彩色马蹄莲(Zantedeschia hybrid Spreng.)为天南星科(Araceae)马蹄莲属(Zantedeschia Spreng.)多年生草本花卉,原产南非,具有花色绚烂、花形高雅、叶形宽大并具星点等优点,集观叶与赏花于一体,深受人们的喜爱,是21世纪的“明星”花卉。目前,彩色马蹄莲新品种的培育方式以杂交育种为主,市场上流通的彩色马蹄莲品种多通过马蹄莲属的7个原生种相互杂交及回交获得,但这种传统育种方式存在育种周期长等问题。因而,探索和研究彩色马蹄莲快速、高效的育种方式对于加快其育种进程、促进其品种更新具有重要意义。
多倍体诱导是目前公认的一种快速、高效的育种手段,并且通常情况下植物的多倍体均比二倍体开花多、茎干粗、叶片厚、花大色艳、耐储运且抗逆性强。秋水仙素是多倍体诱导过程中常用的诱导剂,但是秋水仙素对植物细胞有一定毒性,并且与植物蛋白质的亲和性也较差,因此,选择合适的秋水仙素浓度和浸泡时间对于成功诱导多倍体至关重要[1]。
彩色马蹄莲栽培过程中最常见的病害是软腐病,特别是引种至中国长江中下游地区后,梅雨季节其软腐病病害更加严重。为了能够快速、高效获得彩色马蹄莲抗软腐病品种,许多研究者采用多倍体诱导方法进行了相关研究。Cohen等[2]利用秋水仙素对彩色马蹄莲的茎尖进行多倍体离体诱导,并通过组织培养方法获得了彩色马蹄莲的四倍体植株;邵果园[3]利用秋水仙素分别对黄花马蹄莲(Z.elliotiana Engler)茎尖进行多倍体诱导并采用离体培养技术获得了四倍体植株,四倍体诱导率为13.3%,并认为诱导过程中秋水仙素的最佳质量浓度为0.5 g·L-1,且浸泡处理48 h的诱导效果最好;吴红芝等[4]也采用秋水仙素对彩色马蹄莲的不定芽块进行了多倍体诱导并获得了四倍体植株,其中诱导过程中秋水仙素的最佳质量浓度也为0.5 g·L-1,但以浸泡处理24 h的诱导效果最好,诱导率最高(52%);张锡庆等[5]采用新型除草剂Oryzalin作为彩色马蹄莲多倍体的诱导剂,发现用质量体积分数0.001 6%的Oryzalin浸泡36 h的诱导效果最好,多倍体诱导率达34%。但是,采用秋水仙素和除草剂等化学方法浸泡诱导的多倍体可能存在嵌合体、混倍体及回复突变等现象,因此有些学者对彩色马蹄莲多倍体的诱导方法进行了改良,以增加多倍体的纯合率和稳定性。李洁筠等[6]利用质量体积分数0.15%的秋水仙素浸泡彩色马蹄莲品种‘黑魔术’(‘Black magic’)和‘火烈鸟’(‘Flamingo’)的花序,并用诱导获得的2n配子进行杂交,最终诱导出‘黑魔术’的三倍体及‘黑魔术’和‘火烈鸟’的杂交种。虽然目前有关彩色马蹄莲多倍体育种的研究报道较多,但在花卉市场上并没有见到彩色马蹄莲的多倍体新品种;而且,由于不同研究涉及的彩色马蹄莲品种和诱导器官不同,采用的秋水仙素浓度和浸泡时间也各异,导致其多倍体诱导率存在很大差异。
作者所在的项目组多年来一直致力于彩色马蹄莲的栽培、矮化和不定芽诱导等方面的研究工作并已取得了一定的研究成果[7-9]。为进一步摸索彩色马蹄莲多倍体新品种的诱导条件,作者以彩色马蹄莲常见品种‘Parfait’离体培养的丛生芽块为实验材料,研究了秋水仙素浓度、助溶剂二甲基亚砜(DMSO)浓度及其浸泡时间对‘Parfait’多倍体诱导的影响,及其多倍体与二倍体的部分生物学特性差异,以确定彩色马蹄莲‘Parfait’多倍体诱导过程中秋水仙素和DMSO的最佳浓度及浸泡时间,以期为彩色马蹄莲多倍体新品种的培育提供实验依据。
1 材料和方法
1.1 材料
供试材料为彩色马蹄莲品种‘Parfait’离体培养的丛生芽块;供试秋水仙素购自美国Biosharp公司。
1.2 方法
1.2.1 多倍体诱导 采用浸泡法进行多倍体诱导,并通过预实验确定‘Parfait’丛生芽块对秋水仙素的耐受浓度,据此设置各处理组秋水仙素的质量体积分数及助溶剂二甲基亚砜(DMSO)的体积分数和浸泡时间。处理1:MS液体培养基中添加0.00%秋水仙素和0.00%DMSO,浸泡0 h;处理2:MS液体培养基中添加0.05%秋水仙素和0.20%DMSO,浸泡48 h;处理3:MS液体培养基中添加0.10%秋水仙素和0.40%DMSO,浸泡36 h;处理4:MS液体培养基中添加0.15%秋水仙素和0.10%DMSO,浸泡24 h;处理5:MS液体培养基中添加0.20%秋水仙素和0.30% DMSO,浸泡12 h。
将带有丛生芽的愈伤组织切成0.5 cm×0.5 cm× 0.5 cm的小块,分别置于按上述处理配制的MS液体培养基(不含激素)中,按各处理设置的浸泡时间在100 r·min-1摇床上进行振荡培养,每处理5个丛生芽块,各重复3次。然后将丛生芽块首先用无菌水清洗2~3次,每次10 min;再将丛生芽接种至含有2.0 mg·L-16-BA和0.1 mg·L-1NAA的MS培养基中,置于温度(25±1)℃、光照度1 000~2 000 lx、光照时间16 h·d-1的条件下进行无菌培养,30 d后统计丛生芽的存活数并观察其形态变化,计算丛生芽存活率及多倍体诱导率。计算公式分别为:存活率= (存活丛生芽块数/接种的丛生芽块数)×100%;多倍体诱导率=(诱导出多倍体的丛生芽块数/接种的丛生芽块数)×100%。
1.2.2 生物学特征分析 切取植株形态有明显变异的丛生芽,将其接种至含1.5 mg·L-16-BA和0.1 mg·L-1NAA的MS培养基上进行丛生芽增殖培养; 30 d后,将丛生芽接种至含有0.5 mg·L-16-BA和 0.5 mg·L-1NAA的MS培养基上进行继代培养,约继代10次,每次培养30 d。
选择变异明显的植株进行多倍体鉴定。随机选取培养条件一致且生长良好的多倍体和二倍体组培苗各10株,用直尺直接测量每一单株上最大叶片的长度和宽度,并用游标卡尺测量该叶片的厚度,结果取平均值。
随机选取培养条件一致且生长良好的多倍体和二倍体组培苗各10株,每株选取1片叶,撕取叶片下表皮制片,并用Nikon H550L型光学显微镜观测气孔大小,以气孔显著增大作为变异的初步鉴定标准。
随机选取培养条件一致且生长良好的多倍体和二倍体组培苗各10株,参照朱澂[10]和王敏琴等[11]的方法进行染色和压片,制成染色体装片,并用Nikon Eclipse 80i型显微镜观察和拍照。多倍体和二倍体植株均至少观察30个视野,以染色体数目判断其倍性。
采集二倍体和已知倍性的多倍体植株的叶片,按照李合生[12]的方法测定叶片中的叶绿素a及叶绿素b含量,据此计算总叶绿素含量。
1.3 数据分析
采用SPSS 13.0统计分析软件对相关数据进行显著性检验和回归分析。
2 结果和分析
2.1 多倍体诱导条件的比较分析
在MS液体培养基中添加不同质量体积分数秋水仙素和不同体积分数二甲基亚砜(DMSO)进行诱导培养,7 d后供试的丛生芽均由绿色变为浅灰色;培养12 d后,由于受到药物的毒害作用,部分丛生芽由浅灰色变为灰褐色并死亡,未死亡的丛生芽在培养1个月后萌发出小苗。
不同诱导条件对彩色马蹄莲品种‘Parfait’丛生芽存活率及多倍体诱导率的影响见表1。由表1可见:随秋水仙素质量体积分数的提高及浸泡时间的缩短,丛生芽存活率不断增加,且各处理组间的丛生芽存活率无显著差异(P>0.05),但均低于对照组,部分处理组与对照组间丛生芽存活率差异显著(P<0.05);其中,在添加质量体积分数0.05%秋水仙素和体积分数0.20%DMSO的MS液体培养基中浸泡48 h,丛生芽存活率最低,仅为55.19%。
随秋水仙素质量体积分数的提高以及浸泡时间的缩短,各处理组的多倍体诱导率逐渐降低且差异显著;而对照组多倍体诱导率为0.00%,与各处理组差异显著。其中,在添加质量体积分数0.05%秋水仙素和体积分数0.20%DMSO的MS液体培养基中浸泡48 h,多倍体诱导率最高,为65.22%;而在添加质量体积分数0.20%秋水仙素和体积分数0.30%DMSO的MS液体培养基中浸泡12 h,多倍体诱导率最低,仅为27.78%,显著低于其他处理组。
2.2 多倍体与二倍体生物学特征的比较
2.2.1 叶形指数的比较 彩色马蹄莲品种‘Parfait’多倍体与二倍体的叶形指数见表2。与二倍体植株相比,多倍体植株在株高、叶宽、叶色等方面都有较大的变异,表现为植株较矮、叶片肥大、叶色浓绿等特点。由表2可见:‘Parfait’多倍体的叶长为3.224 cm,显著(P<0.05)高于二倍体,为二倍体叶长的1.23倍;叶宽则显著小于二倍体,为0.805 cm,仅为二倍体叶宽的42.08%;多倍体叶片的长宽比为4.005,显著高于二倍体,是二倍体叶片长宽比的2.93倍;多倍体的叶片厚度为0.305 mm,也显著高于二倍体,为二倍体叶片厚度的1.19倍。总体上看,‘Parfait’多倍体与二倍体在叶长、叶宽、叶长宽比和叶厚等特征方面均有显著差异。
2.2.2 气孔特征的比较 彩色马蹄莲品种‘Parfait’多倍体与二倍体的气孔特征见表3。由表3可见:与二倍体植株相比,‘Parfait’多倍体叶片的气孔密度显著(P<0.05)减小,仅为二倍体的61.55%;但多倍体的气孔保卫细胞显著增大,其长度为二倍体的1.90倍、宽度为二倍体的1.96倍;每气孔的叶绿体数也显著增加,达到二倍体的2.03倍。
分析结果表明:彩色马蹄莲品种‘Parfait’的倍性与气孔密度可能存在负相关关系,而与保卫细胞大小及叶绿体数呈正相关关系。因此,可通过气孔特征的观测简单区分彩色马蹄莲品种‘Parfait’的二倍体和多倍体。
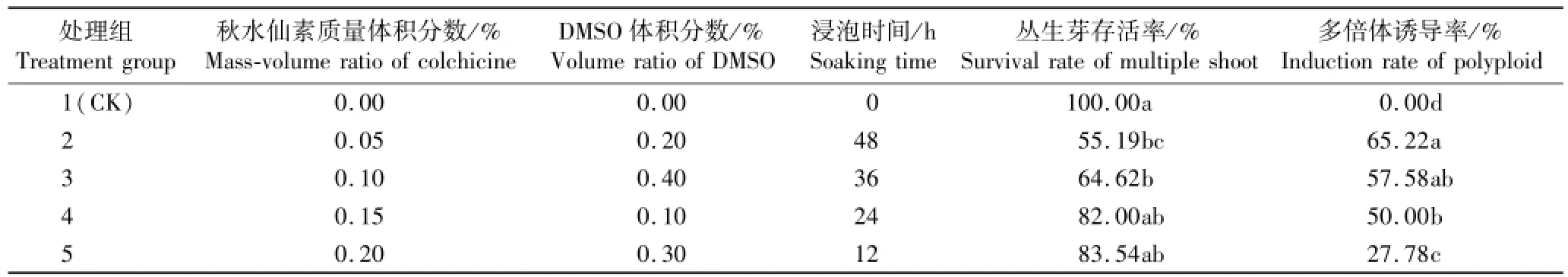
表1 不同诱导条件对彩色马蹄莲品种‘Parfait’丛生芽存活率及多倍体诱导率的影响(¯X±SE)1)Table 1 Effects of different induction conditions on survival rate of multip le shoot and induction rate of polyp loid of Zantedeschia hybrid‘Parfait’(¯X±SE)1)

表2 彩色马蹄莲品种‘Parfait’二倍体与多倍体叶形指数的比较(¯X±SE)1)Table 2 Comparison on leaf indexes between diploid and polyp loid of Zantedeschia hybrid‘Parfait’(¯X±SE)1)

表3 彩色马蹄莲品种‘Parfait’二倍体与多倍体气孔特征的比较(¯X±SE)1)Table 3 Comparison on stomatal characteristics between dip loid and polyp loid of Zantedeschia hybrid‘Parfait’(¯X±SE)1)
2.2.3 体细胞染色体数的比较 彩色马蹄莲品种‘Parfait’多倍体与二倍体的体细胞染色体形态见图1。统计结果表明:‘Parfait’二倍体的体细胞染色体数为2n=32(图1-A),与卫尊征等[13]对彩色马蹄莲二倍体染色体数的测定结果一致;而‘Parfait’多倍体的体细胞染色体数为2n=64(图1-B),为二倍体的2倍,即四倍体。另外,实验中还获得了一些‘Parfait’的嵌合体和六倍体。
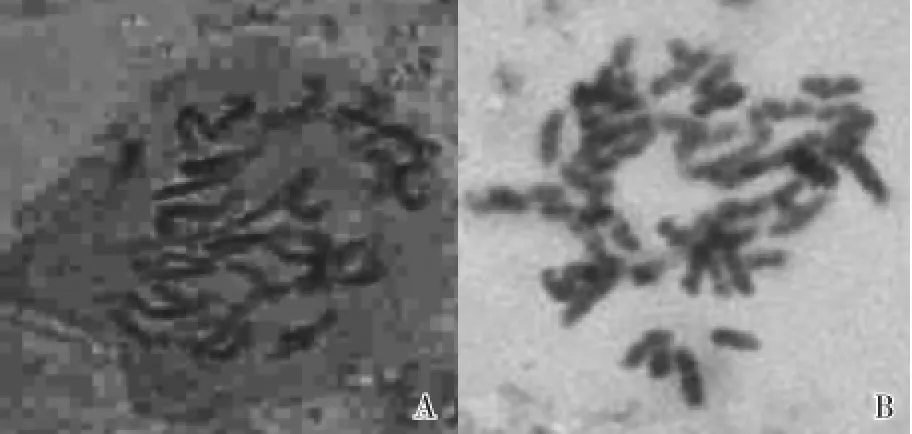
图1 彩色马蹄莲品种‘Parfait’二倍体和多倍体的染色体形态Fig.1 Chromosome morphology of diploid and polyploid of Zantedeschia hybrid‘Parfait’
2.2.4 叶绿素含量的比较 彩色马蹄莲品种‘Parfait’多倍体与二倍体叶绿素含量的测定结果见表4。结果表明:‘Parfait’多倍体的叶绿素a含量为3.2 μg·g-1,为二倍体的1.28倍;多倍体的叶绿素b含量则与二倍体相等,均为1.1μg·g-1;多倍体的总叶绿素含量为4.2μg·g-1,为二倍体的1.17倍。多倍体的叶绿素a和总叶绿素含量显著(P<0.05)高于二倍体。

表4 彩色马蹄莲品种‘Parfait’二倍体与多倍体叶绿素含量的比较(¯X±SE)1)Table 4 Comparison on chlorophy ll content between dip loid and polyp loid of Zantedeschia hybrid‘Parfait’(¯X±SE)1)
2.3 多倍体诱导的最佳条件分析
根据气孔和染色体倍性的鉴定结果,综合考虑多倍体诱导率和丛生芽存活率,对影响彩色马蹄莲品种‘Parfait’多倍体诱导的3个因素(即秋水仙素和DMSO的浓度及浸泡时间)进行线性回归分析,得到的回归方程为Y=-1.205×10-17+0.978X1-0.162X2+ 0.014X3。其中,Y代表多倍体诱导率;X1为秋水仙素浓度;X2为DMSO浓度;X3为浸泡时间。依据该回归方程得出的彩色马蹄莲品种‘Parfait’多倍体诱导的最佳条件为:离体培养的丛生芽块在添加质量体积分数0.20%秋水仙素和体积分数0.10%DMSO的MS液体培养基中浸泡24 h,多倍体诱导率高达50.02%。采用以上诱导条件进行稳定性和重现性实验,得到‘Parfait’的多倍体诱导率为50.23%,与上述回归方程得到的最佳诱导率基本吻合。
3 讨论和结论
秋水仙素是目前人工诱导染色体加倍过程中应用最为广泛的化学试剂,属于微管特异性药物,能够阻断微管蛋白组装成微管进而破坏纺锤体形成,使得细胞分裂停止在第1次减数分裂期,从而形成加倍体;并且其与植物亲和性差且毒性较强[14]。本实验利用DMSO作为秋水仙素的辅助渗透剂并藉此缩短浸泡时间,取得了理想的多倍体诱导效果。本研究中,采用添加质量体积分数0.05%秋水仙素和体积分数0.20%DMSO的MS液体培养基浸泡培养,多倍体诱导率最高(65.22%),明显高于邵果园[3]和吴红芝等[4]采用相同水平秋水仙素的多倍体诱导率。可见,在彩色马蹄莲多倍体诱导过程中,借助辅助渗透剂DMSO可提高多倍体的诱导率。但是,考虑到浸泡后丛生芽存活率等因素,彩色马蹄莲多倍体的高效诱导方法应使用较高浓度的秋水仙素但应缩短浸泡时间;根据回归方程确定的最佳诱导条件为:用添加质量体积分数0.20%秋水仙素和体积分数0.10%DMSO的MS液体培养基浸泡丛生芽块24 h。
与二倍体相比,彩色马蹄莲品种‘Parfait’多倍体的叶片长度、长宽比和厚度,保卫细胞长度、宽度和每气孔叶绿体数以及叶绿素含量均显著增加,染色体数也加倍,故确定诱导获得的多倍体为四倍体。‘Parfait’四倍体在外部形态上表现为叶色更加浓绿,叶面积增大,叶片更加肥厚。除此之外,‘Parfait’四倍体还表现出叶柄及叶脉变粗、生长旺盛等特点,其组培苗经炼苗、移栽后对环境的适应性也更强。但是,由于彩色马蹄莲品种‘Parfait’从组培苗移栽成活到植株开花需要2~3 a的时间,因而,目前‘Parfait’四倍体植株尚未能开花。因此,作为优良花卉,彩色马蹄莲品种‘Parfait’的四倍体花部性状的观赏价值变化仍需进一步观察研究。
( Continued on page 101)( Continued from page 85)
[1] 张计育,李国平,乔玉山,等.秋水仙素对草莓离体叶片再生和多倍体诱导的影响[J].植物资源与环境学报,2009,18(3): 69-73.
[2] COHEN D,YAO J L.In vitro chromosome doubling of nine Zantedeschia cultivars[J].Plant Cell,Tissue and Organ Culture, 1996,47(1):43-49.
[3] 邵果园.黄色马蹄莲(Zantedeschia elliotiana Engler)组培快繁研究及多倍体诱导初探[D].重庆:西南大学园艺园林学院, 2007.
[4] 吴红芝,张锡庆,郑思乡,等.彩色马蹄莲多倍体的诱导[J].园艺学报,2008,35(3):443-446.
[5] 张锡庆,吴红芝,周 涤,等.新型除草剂Oryzalin的浓度和处理时间对诱导彩色马蹄莲多倍体的影响[J].云南农业大学学报,2008,23(6):806-810.
[6] 李洁筠,吴红芝,陈 溪,等.彩色马蹄莲2n配子育种技术初探[J].中国农学通报,2011,27(8):108-113.
[7] 彭 峰,陈嫣嫣,郝日明,等.不同栽培措施对不同品种彩色马蹄莲高生长的影响[J].植物资源与环境学报,2003,12 (4):39-42.
[8] 彭 峰,陈嫣嫣,郝日明,等.多效唑和矮壮素对盆栽彩色马蹄莲的矮化实验[J].植物资源与环境学报,2004,13(4):32-34.
[9] 彭 峰,陈嫣嫣,郝日明,等.彩色马蹄莲‘Parfait’不定芽诱导增殖培养条件的优化和筛选[J].植物资源与环境学报,2006, 15(2):47-49.
[10] 朱 澂.植物染色体及染色体技术[M].北京:科学出版社, 1982.
[11] 王敏琴,彭振英,蔡雁峰,等.一种获得分散良好的植物染色体压片技术[J].生物学通报,2007,42(4):50.
[12] 李合生.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000:135-137.
[13] 卫尊征,殷选红,熊 敏,等.3个彩色马蹄莲引进品种的核型分析[J].植物遗传资源学报,2012,13(4):650-654.
[14] 郑永强,徐 坤.秋水仙素在植物体细胞染色体加倍中的应用研究进展[J].中国农学通报,2003,19(5):89-91,98.
(责任编辑:佟金凤)
Induction of Zantedeschia hybrid‘Parfait’polyploid and change of its biological characteristics
LIU Xiaojing1,HUA Xiaoping2,LU Bo1,PENG Feng1,DENG Bo3,ZHENG Yuhong1,①(1.Institute of Botany,Jiangsu Province and the Chinese Academy of Sciences,Nanjing210014,China;2.Donghai Flower Industry Co-operative,Donghai 222300,China;3.Jiangsu Junma Agricultural and Forestry Science and Technology Limited Company,Zhangjiagang215600,China),J.Plant Resour.&Environ. 2014,23(3):81-85,101
Taking in vitro multiple shoot clumps of Zantedeschia hybrid‘Parfait’as experimental materials,colchicine and DMSO concentrations and their soaking time during polyploid induction process were analyzed,and differences in leaf indexes,stomatal characteristics,chlorophyll content and chromosome number between polyploid and diploid were compared,finally,the optimal induction condition was confirmed by regression analysis.The results show thatwith enhancing of colchicinemassvolume ratio and shortening of soaking time,survival rate ofmultiple shoot of different treatment groups increases gradually and is lower than that of the control,while polyploid induction rate decreases gradually and is significantly higher than thatof the control.Comprehensively considering factors such as survival rate of multiple shoot and polyploid induction rate and according to regression analysis,theoptimal induction condition of Z.hybrid‘Parfait’is soakingmultiple shoot clumps in MS liquid medium containingmass-volume ratio 0.20%colchicine and volume ratio 0.10%DMSO for 24 h,its polyploid induction rate is up to 50.02%.The comparison analysis results show that leaf length,leaf thickness and ratio of leaf length to leaf width of polyploid plants are 1.23,1.19 and 2.93 times to those of diploid plants,respectively.Length and width of guard cell and chloroplast number per stoma of polyploid plants are 1.90,1.96 and 2.03 times to those of diploid plants,respectively.Contents of chl a and total chlorophyll of polyploid plants are 1.28 and 1.17 times to those of diploid plants,respectively.But leaf width and stomatal density of polyploid plants are smaller,which are only 42.08%and 61.55%of those of diploid plants,respectively.Except chl b content,there are significant differences in other biological characteristics between polyploid plants and diploid plants.The resultof chromosome counting shows that polyploids obtained mostly are tetraploid with chromosome number of 2n=64,meanwhile,some chimera and hexaploid are obtained.It is suggested thatmost biological characteristics of Z.hybrid‘Parfait’polyploids are better than those of its diploids,and the polyploids possess stronger adaptability to environment.
cultivar of Zantedeschia hybrid;polyploid;induction condition;colchicine;biological characteristics;chromosome number
Q943;S335.3;S682.2+64
A
1674-7895(2014)03-0081-05
10.3969/j.issn.1674-7895.2014.03.11
2013-09-29
江苏省科技支撑计划项目(BE2013367);江苏省农业自主创新资金项目〔2014(CX)2067〕;江苏省农业三新工程项目(SXGC [2013]161)
刘晓静(1981—),女,河北新乐人,博士,助理研究员,主要从事植物逆境生理方面的研究。
①通信作者E-mail:friend266@163.com
