洪湖湿地水鸟肝脏中有机氯农药的分布
2014-05-09祁士华袁林喜
胡 英,祁士华,袁林喜
(中国地质大学生物地质与环境地质国家重点实验室,湖北 武汉430074)
洪湖湿地水鸟肝脏中有机氯农药的分布
胡 英,祁士华*,袁林喜
(中国地质大学生物地质与环境地质国家重点实验室,湖北 武汉430074)
对我国中部地区洪湖湿地6种水鸟肝脏中20种有机氯农药进行了测量.发现DDTs是最主要的OCPs,约占总OCPs的38.3%~93.0%,其平均含量范围为2.74~121.72ng/g 湿重.HCHs和DDTs的富集形态说明洪湖湿地这些有机氯农药主要来源于历史残留.不同水鸟肝脏中∑OCPs含量差异显著(P<0.01),表现为白鹭和池鹭体内OCPs含量(37.91~137.22ng/g 湿重)要远高于其他水鸟(5.00~21.49ng/g 湿重),这种差异的产生主要与其饮食习性有关.大多数水鸟HCHs性别间基本无差异;但白鹭、池鹭雄性水鸟中总OCPs平均含量(白鹭:136.90ng/g 湿重;池鹭:52.41ng/g 湿重)高于雌性水鸟(白鹭:126.60ng/g 湿重; 池鹭:49.78ng/g 湿重).与已有研究相比,洪湖湿地水鸟体内OCPs含量处于较低水平.风险评价结果表明研究区水鸟肝脏中OCPs含量不会对该地区水鸟种群产生不利效应.
有机氯农药;水鸟;洪湖湿地
有机氯农药(OCPs)由于其高效、低成本、杀虫谱广和使用方便等特点,曾广泛用于农业、防治疟疾、斑疹伤寒、家庭卫生等方面.有机氯农药具有“三致”(致癌、致畸、致突变)作用,而且能够导致生物体内分泌紊乱、生殖及免疫机能失调、神经行为和发育紊乱等严重疾病[1].20世纪70~80年代,包括中国在内的20多个国家禁止了HCHs和DDTs等有机氯农药的生产和使用.但由于有机氯农药的使用量大和降解缓慢等特点,其仍然是目前环境中检出率较高的一类污染物[2-4].
湿地是介于水生生态系统和陆地生态系统之间的一种过渡类型,约占陆地面积的6.4%.水鸟作为湿地生态系统的重要组成部分,因其觅食活动范围较大,处于食物链相对较高的位置,是湿地环境污染状况最适宜的生物指示物[6].而且,鸟类与人类处于相近的食物链地位,因此利用水鸟可以间接评价环境污染对人群健康的潜在威胁.目前,部分学者已对我国水鸟组织中的 OCPs进行了报道,主要集中于我国南部和北部[6-8],但我国中部地区相关报道较少[9].
洪湖湿地位于我国中部,是长江中游地区重要的湿地生态区域,其在水体净化、调蓄洪水、渔业生产和提供生产、生活用水等方面发挥着巨大作用,于2008年列入《国际重要湿地名录》.同时,它也是众多湿地迁徙水禽重要的繁殖地、中途停留地和越冬地.据统计,洪湖共有鸟类133种,其中国家一级保护物种6种,国家二级保护鸟类13种,湖北省重点保护鸟类38种.作为我国重要的粮食和棉花产地之一,有机氯农药曾广泛用于洪湖地区.因此,本文的研究内容是研究洪湖湿地环境中水鸟体内有机氯农药的残留、组成特征及风险评价,这对了解该地区有机氯污染状况具有十分重要的意义.
1 材料与方法
1.1 样品采集
在洪湖保护区相关部门的帮助下,分别于2011年8月和2012年2月对洪湖湿地典型水鸟进行了采集,包括白鹭(Egretta garzetta)、池鹭(Ardeola bacchus)、骨顶鸡(Fulica atra)、绿翅鸭(Anas crecca)、绿头鸭(Anas platyrhynchos)和豆雁(Anser fabalis)共6种.所有水鸟在死亡后立即称重、确定性别,随后进行解剖将肝脏分离出来,用铝箔包好,放置于聚乙烯袋中,保存在-20℃待分析.所采集水鸟具体信息见表1.

表1 洪湖湿地水鸟的生态学数据Table1 Ecological data of waterbirds from Honghu wetland
1.2 样品的预处理
生物样品中 OCPs的分析方法参照文献[2,10].具体为:将水鸟肝脏用搅拌机破碎均匀,称取5g肝脏样品加入适量无水NaSO4,用滤纸包好,加入回收率指示物TCmX和PCB209和180mL体积比为2:1的二氯甲烷和丙酮混合液索氏抽提48h.将萃取液旋转蒸发至5mL,1mL用重量法测脂质[11],4mL加入浓硫酸净化去脂,之后过硫酸硅胶(6cm)和氧化铝(3cm)层析柱,并用体积比为2:3的二氯甲烷/正己烷混合液淋洗;淋洗液经旋转蒸发浓缩至5mL,转移到2mL细胞瓶中,然后用高纯柔和氮气浓缩至0.2mL,加入内标五氯硝基苯(PCNB)冷冻保存至上机分析.
1.3 仪器分析
用安捷伦7890型气相色谱仪(GC-ECD)对样品中的有机氯农药进行定量分析.色谱柱为HP-5石英毛细管柱(30m×0.32mm i.d.×0.25µm),高纯氮气作为载气(纯度>99.999%),流速为2.5mL/min.进样口和检测器温度分别为290℃和300℃.炉温升温程序如下:初始温度100℃,保持1min后以4℃/min升至200℃,再以2℃/min升高至230℃,最后以8℃/min升高至280℃.GC进样量2µL,采用内标法进行定量.
1.4 质量保证与质量控制
每个样品在索氏抽提前加入回收率指示物TCmX和PCB209,以监测试验过程中的损失.每批样品(n=10)分析2个空白样,其中一个空白样中加内标,空白样中目标化合物低于仪器检出限,加分析一个平行样,测试结果表明平行样中大多数化合物的相对偏差低于10%.空白样品的加标回收率范围为95%~105%.本方法样品中TCmX和PCB209的平均回收率分别为72%±7%和76%±8%,所有样品均经过回收率校正.
2 结果与讨论
2.1 水鸟肝脏中OCPs的含量
表2为洪湖湿地水鸟肝脏中各OCPs的残留含量.从表2可见,洪湖湿地水鸟肝脏中绝大多数有机氯污染物均被检出,其中 HCHs、DDTs和HCB检出率高达100%,其他OCPs如七氯、氯丹、硫丹、艾氏剂、异狄氏剂和狄氏剂也均有不同程度检出.目前关于洪湖表层水体、沉积物和水生植物中有机氯农药的研究已有相关报道[10,12],这些研究表明有机氯农药在洪湖地区广泛存在,特别是我国曾大量使用的HCHs、DDTs.
研究区20种 OCPs的总平均含量范围为6.33~129.25ng/g 湿重(ww),其中 DDTs为最主要的OCPs,占总OCPs的38.3%~93.0%(图1A),最大值出现在白鹭肝脏中(121.72ng/g ww),最小值出现在豆雁肝脏中(2.74ng/g ww).这个残留水平是 HCHs、七氯、氯丹、硫丹、HCB、艾氏剂、狄氏剂、异狄氏剂含量的1~3个数量级.关于我国其他地区水鸟体内较高的 DDTs含量也有相关报道[6,13],这些结果均表明我国水鸟体内存在高含量的DDTs残留.不同于DDTs,水鸟肝脏中 HCHs含量相对较低,其平均含量范围为0.90~3.33ng/g ww,占总 OCPs的百分比为2.3%~30.5%.历史上,我国工业 HCHs的使用量远高于DDTs,约为DDTs使用量的10倍[14].本研究中 HCHs在生物体内的低含量可能源于HCHs较低的脂溶性(HCHs: logKow=3.7~3.9; DDTs: logKow=5.3~6.2),并且HCHs在生物体中的半衰期比DDTs短[15],这些使得HCHs在很大程度上不易被生物富集.苏秋克等[10]在洪湖中的螃蟹、鲢鱼、鲫鱼体内检出了较低含量的HCHs,平均含量分别为11.40,2.95,4.95ng/g ww;而 DDTs的含量较高,对应平均含量为21.35,59.03,91.48ng/g ww,约为HCHs含量的2~20倍,与本研究结果相似.水鸟肝脏中其他OCPs,HCB、∑HEPTs、∑CHLs、∑ENDs、∑Aldrins的平均含量范围分别为 0.09-3.11,0.21-1.66,0.06-0.44, n.d.-0.83,0.42-1.49ng/g ww,分别占总OCPs的0.7%~6.0%,0.2%~26.2%,0.1%~3.9%,0~8.4%,1.1%~10.8%.
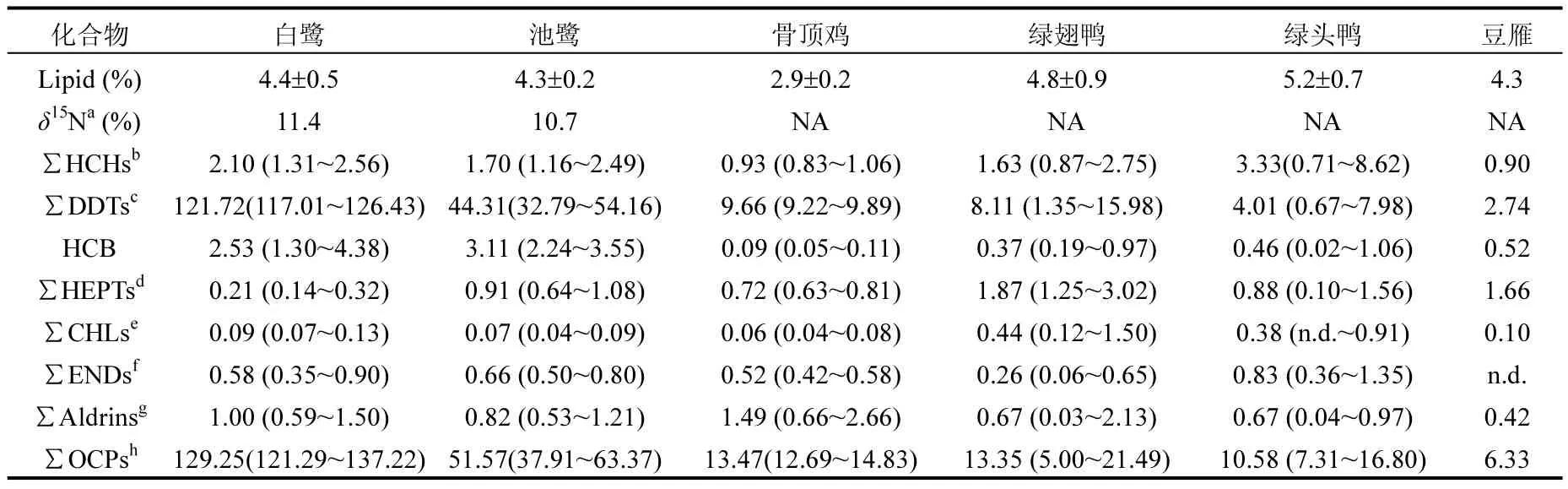
表2 洪湖湿地水鸟肝脏中有机氯农药的含量(ng/g 湿重)Table2 Concentrations of OCPs in the liver of waterbirds from Honghu wetland (ng/g wet weight)
2.2 水鸟肝脏中OCPs的组成
2.2.1 HCHs 研究区水鸟肝脏中HCHs的4种同系物α-HCH、β-HCH、γ-HCH、δ-HCH平均含量范围分别为0.15~0.29,0.24~1.37,0.15~1.08,0.17~0.69ng/g ww,分别占总 HCHs的11.1%~18.2%、26.9%~54.8%、13.9%~30.8%、16.7%~28.1%,见图1B.
在所有水鸟中,白鹭、池鹭、骨顶鸡、绿翅鸭和绿头鸭肝脏中HCHs均以β-HCH为主,但豆雁中则是以γ-HCH(31.1%)为主.其他地区水鸟肌肉、肝脏和卵中也发现β-HCH为主要的HCHs[8,16],这主要源于(1)与α-HCH和γ-HCH相比,β-HCH在水生生物体内有较高的稳定性和生物富集因子[17];(2)可能源于α-HCH和 γ-HCH在生物体内代谢为β-HCH[18].目前使用的HCH产品包括林丹(γ-HCH:99%)和工业六六六(α-HCH:60%~70%, β-HCH:5%~12%, γ-HCH:10%~15%和δ-HCH:6%~10%)[19].本研究中β-HCH高百分比以及部分鸟体内γ-HCH的存在说明研究区HCHs主要还是历史残留,另外可能还存在新的输入.据报道,我国自1983年禁止了工业HCHs的生产和使用后,林丹一直被用于农业地区的害虫防治[20].龚相宜等[21]对洪湖表层沉积物中 HCHs的分布及来源研究结果表明部分沉积物中γ-HCH所占百分比高达50%以上,从而推断存在林丹的输入,与本文研究结论类似.
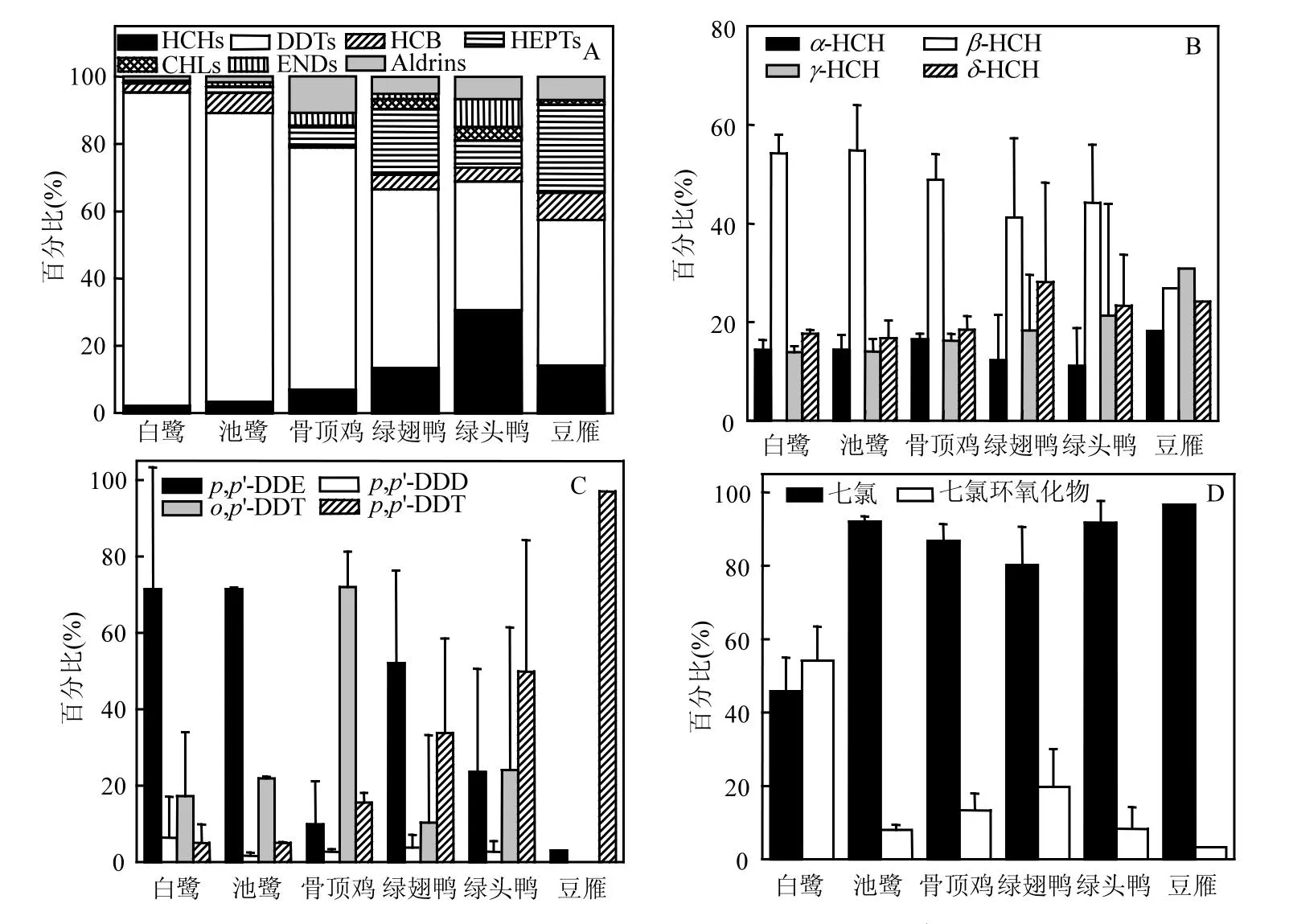
图1 洪湖湿地水鸟肝脏中有机氯农药的组成Fig.1 Composition of organochlorine pesticides in the liver of waterbirds from Honghu wetland
2.2.2 DDTs 在 DDTs中,p,p’-DDE与 p,p’-DDT在所有样品中均有检出,p,p’-DDD的检出率为88%,o,p’-DDT的检出率为60%.洪湖湿地水鸟肝脏中 DDTs的组成见图1C,p,p’-DDE、p,p’-DDD、o,p’-DDT与p,p’-DDT相应的平均含量范围分别为0.08-74.51, n.d.-1.53, n.d.-11.29,1.51-2.66ng/g ww,分别占总 DDTs的2.9%~86.6%,0~4.0%,0~71.8%,2.7%~97.1%.从图1C中可看到,白鹭、池鹭和绿翅鸭肝脏中DDTs以 p,p’-DDE为主,绿头鸭和豆雁肝脏中DDTs以p,p’-DDT为主,骨顶鸡肝脏中DDTs以o,p’-DDT为主.o,p’-DDT在DDTs四种异构体中最不稳定,而且在环境中能很快被代谢掉[22],这可能是 o,p’-DDT在部分样品中未检出的原因.本研究中大多数水鸟肝脏中高含量的 p,p’-DDE和低检出率的o,p’-DDT说明洪湖湿地DDTs主要是以历史残留为主.另外,对洪湖表层沉积物和水生生物中 DDTs的研究表明洪湖表层沉积物中DDTs主要为p,p’-DDE和o,p’-DDT,螃蟹、鲫鱼和鳙鱼肌肉中DDTs主要为p,p’-DDE[10],进一步说明洪湖湿地大多数水鸟肝脏中p,p’-DDE为主要的DDTs的原因.我国自1983年禁止工业DDT的生产和使用后,工业DDT在我国一些地区仍被用于疟疾控制和渔船抗污涂料的添加剂;另外,三氯杀螨醇被广泛用于农业生产如棉花栽培和果树病虫害防治等,成为我国东南部地区现今DDT污染最重要的来源,也是本研究中部分水鸟肝脏中DDTs以p,p’-DDT和o,p’-DDT为主的可能原因[23].
2.2.3 其他 OCPs HCB是一类广泛存在的污染物,它主要用于生产五氯酚钠和控制钉螺中血吸虫的农药.在本研究中,HCB在所有样品中均有检出,其平均含量范围为0.09~3.11ng/g ww,占总 OCPs的0.7%~6.0%.洪湖位于江汉平原东南部,是我国主要的生产粮食和棉花的产地之一,同时,洪湖市50年代也是血吸虫流行病的高发地区,20世纪曾广泛使用五氯酚钠消灭血吸虫,而HCB是生产五氯酚钠的主要中间体,这可能是该地区HCB浓度相对其他农药检出率较高的原因之一.另外,Zhou等[24]也报道了HCB是江汉平原地区河水、地下水和土壤中较频繁检出的一类污染物.
七氯和七氯环氧化物在所有样品中均有检出,其平均含量范围为0.10~1.60,0.05~0.39ng/g ww.研究表明在生物体内七氯会很快被代谢成七氯环氧化物[25].本研究水鸟肝脏中七氯/(七氯+七氯环氧化物)比值为0.46~0.97(图1D),说明研究区存在新的输入.对于其他 OCPs,除反式-九氯和硫丹Ⅰ检出率低于60%外,其他均在大多数样品中得以检出.氯丹类农药中反式-氯丹占主要,约为总氯丹含量的40%左右;硫丹类农药中则主要为硫丹硫酸盐,其次为硫丹Ⅱ.在环境中,反式-氯丹较顺式-氯丹更易被降解[20];而硫丹在生物体内可快速转化为硫丹硫酸盐,因此,本研究中氯丹和硫丹的组成特征表明氯丹可能存在新的输入,而硫丹则发生了高度降解.另外,艾氏剂、异狄氏剂和狄氏剂在洪湖湿地水鸟肝脏中均有检出,含量范围为0.05~0.19,0.04~0.15,0.33~1.22ng/g ww,分别占总OCPs的0.2%~1.4%,0.1%~1.0%,1.0%~8.8%.与HCHs和DDTs相比,这些污染物含量普遍偏低,这主要是因为七氯、氯丹、硫丹在我国使用较少,而艾氏剂、狄氏剂和异狄氏剂则未曾在我国使用.安琼等[26]检测出无锡太湖地区不同年龄夜鹭体内艾氏剂、狄氏剂和异狄氏剂残留量分别为n.d.~3.2,5.2~9.6,0.90~3.8ng/g ww;另外,龚钟明等[27]发现太湖夜鹭幼鸟食物、觅食地底泥中也检出不同含量的艾氏剂、狄氏剂和异狄氏剂,这些研究结果说明尽管我国未曾使用这类农药,但由于大气传输或其他方式,这些污染物在我国不同环境介质中广泛存在,但含量普遍较低.
2.3 种间、性别间OCPs分布差异
为了比较不同种类水鸟体内污染物的残留差异,对水鸟肝脏中∑OCPs进行了单因素方差分析(样品数量≥3).结果表明,∑OCPs含量种间差异显著(P<0.01, F=8.79),并且白鹭和池鹭肝脏中∑OCPs明显要高于骨顶鸡、绿翅鸭、绿头鸭,骨顶鸡、绿翅鸭、绿头鸭要高于豆雁,这可能主要取决于其取食习性.白鹭和池鹭属于鹭科水鸟,是食鱼性鸟类;骨顶鸡、绿翅鸭、绿头鸭为杂食性水鸟;而豆雁为植食性水鸟;因此,与其他鸟类相比,食鱼性鸟类白鹭和池鹭能够摄取和富集更多的有机污染物,其次为杂食性鸟类,最后为植食性鸟类.已有相似研究表明,食鱼性鸟类体内有机氯残留水平高于杂食性和食草性鸟类,并认为肝微粒体活性低是这些食鱼性鸟类能大量富集有机氯的原因[8,15].关于鹭科水鸟体内高含量的OCPs的研究也有相关报道[5],这源于这类水鸟以鱼为主食,在食物链中营养级相对较高.尽管白鹭和池鹭均为食鱼性鸟类,但白鹭组织中 OCPs含量明显高于池鹭,可能与其所处营养级别有关.这两类水鸟体内 δ15N含量表明(表1),白鹭的营养级别要比池鹭高.这与它们的食物组成一致.白鹭的食物主要以鲫鱼、鲢鱼和鳊鱼为主(接近100%),而池鹭的食物以小型鱼类为主(89%),兼食少量植物性食物.杂食性鸟类OCPs的残留差异不大,很大程度上与这些鸟类的食物组成相似相关.骨顶鸡植物性食物占74%,动物性食物为5%.绿翅鸭植物性食物占69%,动物性食物占12%.而绿头鸭植物性食物占79%,动物性食物占8%.
为研究性别对水鸟体内 OCPs含量的影响,选取样品数量n≥3的水鸟进行分析,研究区不同性别水鸟肝脏中各OCPs的含量见图2所示.
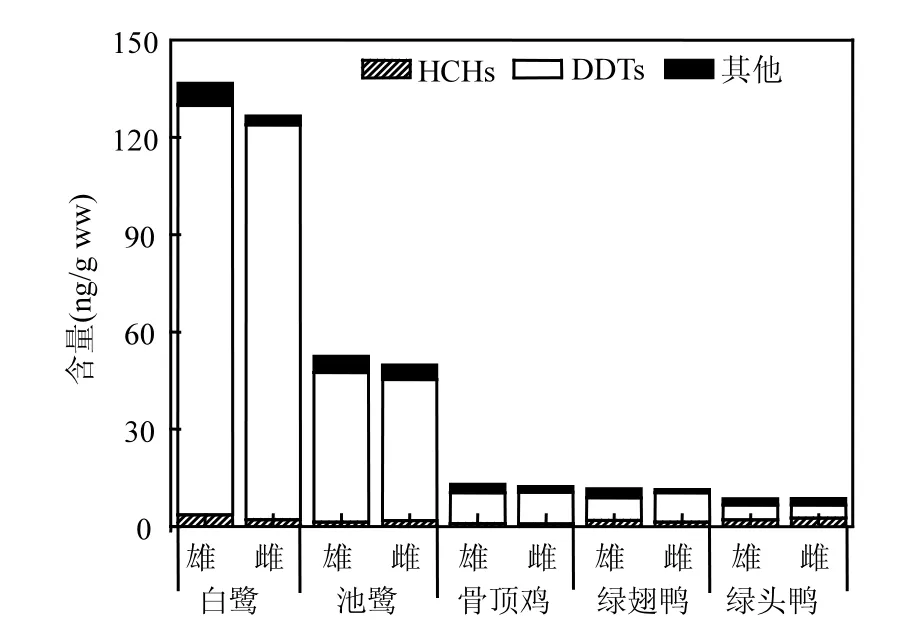
图2 洪湖湿地不同性别水鸟肝脏中OCPs的含量Fig.2 Sex-related differences in OCP concentrations in the liver of waterbirds from Honghu wetland
从图2中可看到,水鸟不同性别间HCHs基本无差异除白鹭雄性水鸟略高于雌性外;对于DDTs、∑Others和∑OCPs,白鹭、池鹭雄性水鸟中含量高于雌性水鸟,骨顶鸡、绿翅鸭和绿头鸭不同性别间 OCPs含量基本相当.这可能是因为水鸟一般于6~7月产卵,而本研究中白鹭和池鹭采集于8月份,而在此期间雌性水鸟可以通过产卵的方式将体内部分污染物排出体外,从而减轻自身污染物的负担,由此导致雌性水鸟体内有机氯含量比同类雄性水鸟低.骨顶鸡、绿翅鸭和绿头鸭于次年2月份采集,其中绿翅鸭均为幼鸟,从而这些水鸟不同性别间 OCPs含量差异不明显.部分研究表明雄性鸟类体内有机氯含量要高于雌性[15],但有些报道表明雌性鸟类体内有机污染物含量与雄性鸟类相当甚至更高[28].Donaldson等[29]发现美国雄性白鹈鹕肝脏中大多数有机氯含量要明显高于雌性鹈鹕,并认为这种差异的产生是雌性鸟类在产卵期间排泄掉了这些污染物.Buckman等[30]对于产卵期前采集的不同性别鸟类中有机氯含量差异研究发现,除肝脏中DDTs外,不同性别鸟类有机氯含量差异不明显.
2.4 水鸟肝脏中OCPs风险评价
目前,国际上关于水鸟组织中20种OCPs的研究较少,因此,本文仅对HCHs和DDTs的含量与已有报道进行了比较.与已有研究相比,洪湖池鹭肝脏中 DDTs含量与我国南部池鹭处于同一水平(1.6~370ng/g ww)[8],远低于印度南部本地迁徙鸟(67~13000ng/g ww)[28]、希腊白鹭(60.8~1590ng/g ww)[31]和西班牙游隼(379~10805ng/g ww)、燕隼(325~63381ng/g ww)[32].对于鸭科水鸟,研究区绿翅鸭和绿头鸭肝脏中 HCHs含量与白洋淀鸭子(0.9~5.0ng/g ww)[33]和伊拉克地区绿翅鸭、绿头鸭和针尾鸭等鸭科水鸟(0.5~8ng/g ww)[34]处于同一水平;DDTs含量略高于白洋淀鸭子(0.3~2.8ng/g ww)[33],但远低于伊拉克地区的绿翅鸭、绿头鸭和针尾鸭等鸭科水鸟(156~561ng/g ww)[34].希腊小苇鳽、白鹳、白鹭等水鸟肝脏中艾氏剂、异狄氏剂和狄氏剂的平均含量范围为n.d.~19.9, n.d.~3.28, n.d.~15.0ng/g ww[31],高于我国洪湖湿地水鸟肝脏中相应污染物的含量.总体而言,我国洪湖湿地水鸟肝脏中 OCPs含量处于较低水平.
水鸟体内高含量的 OCPs会导致鸟类慢性中毒、蛋壳变薄易脆、孵化率下降、繁殖能力降低、致死等[5].据报道,当环颈椎和美国红隼卵中β-HCH和γ-HCH含量分别高达10000和5500ng/g ww时会对其孵化率造成影响;食鱼型鸟类卵中p,p’-DDE含量超过2800ng/g ww会产生生殖障碍[35].成年大白鹭肝脏中 p,p’-DDE浓度达到123300ng/g ww 将导致其卵壳破裂[36];当超过569740ng/g ww时将致死[37].当鸟体内七氯含量达到1500ng/g时将会影响整个鸟群的繁殖率[38];红隼肝脏中狄氏剂含量为9000ng/g ww或异狄氏剂含量超过510ng/g时将产生致死效应[39].绿头鸭通过摄取不同狄氏剂含量的食物(0.5×10-6和3.0×10-6g/g)发现当食物中 dieldrin含量为3.0×10-6g/g时胚胎存活率下降9.6%[40].洪湖湿地水鸟肝脏中 OCPs的含量远低于上述报道的限值,因此对该地区水鸟种群产生危害较小.
3 结论
3.1 洪湖湿地水鸟肝脏中绝大多数 OCPs均被检出,其中 HCHs、DDTs和 HCB检出率高达100%,20种 OCPs的总平均含量范围为6.33~129.25ng/g ww,DDTs为最主要的 OCPs,占总OCPs的38.3%~93.0%.
3.2 在大多数水鸟肝脏中,β-HCH和p,p’-DDE分别为主要的HCHs和DDTs,不同污染物的组成及同系物比值说明HCHs、DDTs和硫丹主要为历史残留,而七氯和氯丹类农药存在新的输入,艾氏剂、异狄氏剂和狄氏剂可能通过大气传输或其他方式进入研究区.
3.3 ∑OCPs含量种间差异显著,白鹭和池鹭明显高于骨顶鸡、绿翅鸭、绿头鸭,骨顶鸡、绿翅鸭和绿头鸭高于豆雁,主要与其饮食习性相关.大多数水鸟不同性别间 HCHs基本无差异;对于DDTs、∑Others和∑OCPs,白鹭、池鹭雄性水鸟中含量高于雌性水鸟,其他水鸟性别间差异不明显,主要与其采样时间和年龄有关.
3.4 与国内外已有研究相比,洪湖湿地水鸟肝脏中 OCPs含量处于较低水平,并低于已报道的能产生不利效应的限值.
[1] 孙剑辉,王国良,张 干,等.黄河中下游表层沉积物中有机氯农药含量及分布 [J]. 环境科学,2007,28(6):1332-1337.
[2] 叶新荣,陈立红,张荣保,等.南极海鸟栖息地粪土层欧诺个持久性有机氯污染物的气相色谱测定方法及环境意义 [C]//2013中国环境科学学会学术年会浦华环保优秀论文集.北京:中国环境科学出版社,2013:147-152.
[3] 徐 昕,孙玉川,王 鹏,等.岩溶区不同水体有机氯农药对比研究 [J]. 中国环境科学,2013,33(9):1630-1637.
[4] Liu G, Li J, Yin L, et al. Distribution characteristics of organochlorine pesticides in surface and vertical sediments from the Zha Long Wetland, China [J]. Environmental Science and Pollution Research,2012,19(7):2681-2689.
[5] 付 允,孙玉川,毛海红,等.地下河流域土壤中有机氯农药分布及来源分析 [J]. 中国环境科学,2012,32(3):517-522.
[6] Jaspers V, Covaci A, Voorspoels S, et al. Brominated flame retardants and organochlorine pollutants in aquatic and terrestrial predatory birds of Belgium: levels, patterns, tissue distribution and condition factors [J]. Environmental Pollution,2006,139(2):340-352.
[7] Chen D, Zhang X, Mai B, et al. Polychlorinated biphenyls and organochlorine pesticides in various bird species from northern China [J]. Environmental Pollution,2009,157(7):2023-2029.
[8] Zhang X L, Luo X J, Liu J, et al. Polychlorinated biphenyls and organochlorinated pesticides in birds from a contaminated region in South China: association with trophic level, tissue distribution and risk assessment [J]. Environmental Science and Pollution Research,2011,18(4):556-565.
[9] 陈 静,袁林喜,祁士华,等.洪湖湿地鹭科鸟类组织中有机氯农药的分布特征及风险评价 [J]. 环境化学,2013,32(4):549-556.
[10] 苏秋克,祁士华,吴辰熙,等.洪湖特色水产品对湖水及沉积物中有机氯农药的积累模式 [J]. 地质科技情报,2007,26(4):85-90.
[11] Borgå K, Gabrielsen G, Skaare J. Biomagnification of organochlorines along a Barents Sea food chain [J]. Environmental Pollution,2001,113(2):187-198.
[12] 龚香宜.有机氯农药在湖泊水体和沉积物中的污染特征及动力学研究 [D]. 武汉:中国地质大学,2007.
[13] Wang Y, Murphy M B, Lam J C, et al. Polychlorinated biphenyls and organochlorine pesticides in local waterbird eggs from Hong Kong: Risk assessment to local waterbirds [J]. Chemosphere,2011,83(7):891-896.
[14] Yang H, Xue B, Yu P, et al. Residues and enantiomeric profiling of organochlorine pesticides in sediments from Yueqing Bay and Sanmen Bay, East China Sea [J]. Chemosphere,2010,80(6):652-659.
[15] Ólafsdóttir K. Persistent organochlorine levels in six prey species of the gyrfalcon (Falco rusticolus) in Iceland [J]. Environmental Pollution,2001,112(2):245-251.
[16] Dhananjayan V. Organochlorine pesticides and polychlorinated biphenyls in various tissues of waterbirds in Nalabana bird sanctuary, Chilika Lake, Orissa, India [J]. Bulletin of Environmental Contamination and Toxicology,2012,89(1):197-201.
[17] Wang D Q, Yu Y X, Zhang X Y, et al. Polycyclic aromatic hydrocarbons and organochlorine pesticides in fish from Taihu Lake: Their levels, sources, and biomagnification [J]. Ecotoxicology and Environmental Safety,2012,82(1):63-70.
[18] Johri A K, Dua M, Tuteja D, et al. Degradation of alpha, beta, gamma and delta-hexachlorocyclohexanes by Sphingomonas paucimobilis [J]. Biotechnology Letters,1998,20(9):885-887.
[19] Li J, Zhang G, Guo L, et al. Organochlorine pesticides in the atmosphere of Guangzhou and Hong Kong: regional sources and long-range atmospheric transport [J]. Atmospheric Environment,2007,41(18):3889-3903.
[20] Jiang Y F, Wang X T, Jia Y, et al. Occurrence, distribution and possible sources of organochlorine pesticides in agricultural soil of Shanghai, China [J]. Journal of Hazardous Materials,2009,170(2):989-997.
[21] 龚香宜,祁士华,吕春玲,等.洪湖表层沉积物中有机氯农药的含量及组成 [J]. 中国环境科学,2009,29(3):269-273.
[22] Li J, Zhang G, Qi S, et al. Concentrations, enantiomeric compositions, and sources of HCH, DDT and chlordane in soils from the Pearl River Delta, South China [J]. Science of the Total Environment,2006,372(1):215-224.
[23] Guan Y F, Wang J Z, Ni H G, et al. Organochlorine pesticides and polychlorinated biphenyls in riverine runoff of the Pearl River Delta, China: assessment of mass loading, input source and environmental fate [J]. Environmental Pollution,2009,157(2):618-624.
[24] Zhou Y, Wang Y, Zwahlen F, et al. Organochlorine Pesticide Residues in the Environment of Central Jianghan Plain, China [J]. Environmental Forensics,2011,12(1):106-119.
[25] Espín S, Martínez-López E, Gómez-Ramírez P, et al. Assessment of organochlorine pesticide exposure in a wintering population of razorbills (Alca torda) from the southwestern Mediterranean [J]. Chemosphere,2010,80(10):1190-1198.
[26] 安 琼,董元华,王 辉,等.不同年龄夜鹭卵中有机氯农药污染的生物指示 [J]. 环境科学学报,2004,24(1):139-143.
[27] 龚钟明,董元华,安 琼,等.无锡鼋头渚夜鹭卵中有机氯农药残留及其环境指示意义 [J]. 环境科学,2001,22(2):110-113.
[28] Tanabe S, Senthilkumar K, Kannan K, et al. Accumulation features of polychlorinated biphenyls and organochlorine pesticides in resident and migratory birds from South India [J]. Archives of Environmental Contamination and Toxicology,1998,34(4):387-397.
[29] Donaldson G, Braune B. Sex-related levels of selenium, heavy metals, and organochlorine compounds in American white pelicans (Pelecanus erythrorhyncos) [J]. Archives of Environmental Contamination and Toxicology,1999,37(1):110-114.
[30] Buckman A H, Norstrom R J, Hobson K A, et al. Organochlorine contaminants in seven species of Arctic seabirds from northern Baffin Bay [J]. Environmental Pollution,2004,128(3):327-338.
[31] Sakellarides T, Konstantinou I K, Hela D, et al. Accumulation profiles of persistent organochlorines in liver and fat tissues of various waterbird species from Greece [J]. Chemosphere,2006,63(8):1392-1409.
[32] van Drooge B, Mateo R, Vives Í, et al. Organochlorine residue levels in livers of birds of prey from Spain: inter-species comparison in relation with diet and migratory patterns [J]. Environmental Pollution,2008,153(1):84-91.
[33] 胡国成,许振成,戴家银,等.有机氯农药和多溴联苯醚在白洋淀鸭子组织中分布特征研究 [J]. 环境科学,2010,31(12):3081-3087.
[34] Rajaei F, Bahramifar N, Sari A E, et al. PCBs and organochlorine pesticides in ducks of Fereydoon-kenar wildlife refuge in Iran [J]. Bulletin of Environmental Contamination and Toxicology,2010,84(5):577-581.
[35] Lam J C, Murphy M B, Wang Y, et al. Risk assessment of organohalogenated compounds in water bird eggs from South China [J]. Environmental Science and Technology,2008,42(16):6296-6302.
[36] Pratt H M. Nesting success of common egrets and great blue herons in the San Francisco Bay region [J]. The Condor,1972,74(4):447-453.
[37] Call D, Shave H, Binger H, et al. DDE poisoning in wild great blue heron [J]. Bulletin of Environmental Contamination and Toxicology,1976,16(3):310-313.
[38] Henny C J, Blus L J, Stafford C J. Effects of heptachlor on American kestrels in the Columbia Basin, Oregon [J]. The Journal of Wildlife Management,1983,47(4):1080-1087.
[39] Walker C, Newton I. Effects of cyclodiene insecticides on the sparrowhawk (Accipiter nisus) in Britain–a reappraisal of the evidence [J]. Ecotoxicology,1998,7(4):185-189.
[40] Roylance K J, Jorgensen C D, Booth G M, et al. Effects of dietary endrin on reproduction of mallard ducks (Anas platyrhynchos) [J]. Archives of Environmental Contamination and Toxicology,1985,14(6):705-711.
致谢:感谢李丰、刘佳、瞿程凯等在采样、样品测试过程中给予的帮助!
Distribution of organochlorine pesticides in the liver of waterbirds from Honghu wetland, Central China.
HU Ying1, QI Shi-hua1*, YUAN Lin-xi1
(State Key Laboratory of Biogeology and Environmental Geology, China University of Geosciences, Wuhan430074, China). China Environmental Science,2014,34(8):2140~2147
Twenty organochlorine pesticides (OCPs) were measured in the liver of six waterbird species from Honghu wetland. Among OCPs, DDTs were the most prevalent compounds (38.3%~93.0%), with average concentration ranging from2.74 to121.72ng/g wet weight. The accumulation profiles of HCHs and DDTs suggested that these OCPs in the Honghu wetland were largely derived from historical usage. Significant interspecific differences were observed in the levels of sum OCPs in the liver of all waterbirds (P<0.01). Concentrations of total OCPs in little egrets (Egretta garzetta) and chinese-pond herons (Ardeola bacchus) (37.91~137.22ng/g wet weight) were higher than those in the other birds (5.00~21.49ng/g wet weight), which might be attributed to their different dietary habits. Higher average concentrations of OCPs were observed in males (little egrets:136.90ng/g wet weight; chinese-pond herons:52.41ng/g wet weight) than in females (little egrets:126.60ng/g wet weight; chinese-pond herons:49.78ng/g wet weight) for little egrets and chinese-pond herons. Compared with other regions worldwide, concentrations of OCPs in waterbirds from Honghu wetland were at low levels. The analysis of risk assessment indicated that the concentrations of OCPs detected in the present study were not expected to pose any hazard to waterbird populations.
t:organochlorine pesticides (OCPs);waterbird;Honghu wetland
X592
:A
:1000-6923(2014)08-2140-08
胡 英(1985-),女,湖北监利人,博士,主要从事环境地球化学方面的研究工作.
2013-11-15
中国博士后面上基金项目(20100480928)
* 责任作者, 教授, shihuaqi@cug.edu.cn
