离子交换树脂对藤黄果中羟基柠檬酸的分离纯化
2014-05-03易馨如张丞林曹学丽
易馨如 封 棣 王 泰 张丞林 曹学丽
YI Xin-ru 1,2,3,4 FENG Di 1,2,3,4 WANG Tai 1,2,3,4 ZH ANG Cheng-lin 1,2,3,4 CAO Xue-li 1,2,3,4
(1.北京工商大学食品学院,北京 100048;2.食品添加剂与配料北京市高等学校工程中心,北京 100048;3.北京市食品风味化学重点实验室,北京 100048;4.食品质量与安全北京实验室,北京 100048)
(1.Beijing Higher Institution Engineering Research Center of Food Additives and Ingredients,Beijing 100048,China;2.Beijing Laboratory for Food Quality and Safety,School of Food and Chemical Engineering,Beijing 100048,China;3.Beijing Key Laboratory of Food Flavor Chemistry,Beijing 100048,China;4.Beijing Technology and Business University,Beijing 100048,China)
羟基柠檬酸(hydroxycitric acid,HCA)是一种天然有机酸,主要存在于盛产于印度次大陆和斯里兰卡西部的藤黄属植物 Garcinia cambogia、Garcinia indica 和Garcinia atroviridis的果实外壳中。此外,羟基柠檬酸在木槿(Hibiscus)属植物中也有存在[1]。羟基柠檬酸易溶于水,微溶于甲醇,难溶于氯仿、石油醚和苯;分子式为C6H8O8,相对分子量为208.12,结构式见图1。研究[2]发现,羟基柠檬酸对柠檬酸裂解酶的亲和力要比天然底物(柠檬酸)强很多,会优先与酶结合,抑制柠檬酸裂解酶的活性,减少体内脂肪合成。因此,羟基柠檬酸具有降低体重[3]、降低血脂[4]、抑制食欲等功效[5],常被作为天然减肥保健品中的主要功能成分。目前国外已有14种以上含有羟基柠檬酸的减肥保健品上市[6],而中国国内市场上已有多种相关的功能性食品和保健品[7]。

图1 羟基柠檬酸的化学结构式Figure 1 The chemical structure of hydroxycitric acid
目前国内外学者对于羟基柠檬酸的分离纯化研究较少。Moffett等[8]以藤黄果皮为原料,以水为提取溶剂进行提取,提取液先通过阴离子交换树脂柱,用NaOH溶液洗脱,洗脱后的液体再通过阳离子交换树脂,最终制备得到23%~54%含量的羟基柠檬酸浓缩物。中国市场上销售的“藤黄果提取物”产品大多是依据此法进行生产的,其中羟基柠檬酸含量较低。离子交换树脂是一种有机高聚物吸附剂,在中草药有效成分的提取、分离及纯化中具有广泛的应用。其具有吸附迅速,解吸容易等良好的吸附性能,可用于水溶性化合物的分离纯化中,如小麦活性肽[9]等的分离纯化。对离子交换树脂高效分离纯化羟基柠檬酸相关研究尚未见报道。
本研究拟以藤黄果粗提物为起始原料,通过对不同的离子交换树脂进行筛选,研究静态和动态对羟基柠檬酸纯化的影响因素,以及分离纯化工艺参数的优化,探索出更适合工业化生产、操作简便、低成本、纯化效果好的工艺路线。
1 材料与方法
1.1 材料与试剂
藤黄果粗提物:购买于北京市场;
羟基柠檬酸(HCA)对照品:纯度98.70%,上海佰年诗丹德检测技术有限公司;
离子交换树脂:D315、D201、D301、335、HZ-202树脂,河北沧州宝恩吸附材料科技有限公司;
甲醇:色谱醇,美国Fisher公司;
磷酸:色谱纯,天津市光复精细化工研究所;
NaCl、NaOH、KOH:分析纯,北京化工厂;
氨水、醋酸、盐酸、硫酸:分析纯,北京化学试剂公司;
去离子水、超纯水:本实验室自制。
1.2 仪器与设备
高效液相色谱仪:Agilent 1100型,美国Agilent公司;
超声波清洗器:KQ5200DE型,昆山市超声仪器有限公司;
超纯水制备系统:Milli-Q型,美国Millipore公司。
1.3 试验方法
1.3.1 树脂预处理 树脂用去离子水不停冲洗,洗至泡沫较少,水颜色较浅为止,再用3倍体积4%NaOH浸泡3 h,去离子水洗至中性;然后用3倍体积4%HCl浸泡3 h,去离子水洗至中性;最后用3倍体积4%NaOH浸泡3 h,去离子水洗至中性;浸泡备用[10]。
1.3.2 树脂的物理参数 选择型号为 D315、D301、D201、335、HZ-202这5种离子交换树脂进行静态吸附试验,5种树脂的物理参数见表1。

表1 离子交换树脂的物理性质[11,12]Table 1 Physical properties of ion exchange resin
1.3.3 供试品试液的制备 取一定量藤黄果粗提物置于三角瓶中,加入一定量的水,超声提取20 min,过滤,其中的羟基柠檬酸含量待测。
1.3.4 高效液相色谱法对羟基柠檬酸含量及纯度的测定
(1)色谱条件:色谱柱:依利特 Zorbax C18(4.6 mm×250 mm,5μm);流动相:0.1%磷酸水—甲醇(99∶1),等度洗脱;体积流量0.8 m L/min;检测波长210 mm;柱温30℃;进样体积10μL。
(2)标准曲线的绘制:精密称取羟基柠檬酸对照品10.0 mg,置于1 m L容量瓶中,加入少量超纯水,摇匀使其充分溶解,再定容至刻度,配成质量浓度为10 mg/m L的标准品溶液,4℃冰箱储存备用。量取羟基柠檬酸标准品溶液适量,用超纯水逐级稀释成质量浓度为1.0,0.5,0.2,0.1,0.01,0.005 mg/m L的标准品溶液。用0.45μm微孔滤膜过滤后,分别进样,每个质量浓度重复3次,测定峰面积积分值。以羟基柠檬酸质量浓度对峰面积平均值进行线性回归,得回归方程Y=637.47 X+1.831 7(R2=0.999 9)在5~1 000μg/m L处与峰面积呈良好线性相关。
1.3.5 静态吸附与洗脱研究
(1)静态吸附试验筛选树脂:① 吸附率的测定[13]:分别称取2 g(湿重)预处理好的 D315、D201、D301、335、HZ-202树脂,置于5个100 m L具塞锥形瓶中,加入质量浓度为2.82 mg/m L的羟基柠檬酸溶液20 m L,静置过夜后取上清液测定羟基柠檬酸的质量浓度,按式(1)、(2)计算羟基柠檬酸的吸附量和吸附率。

式中:
q——吸附容量,mg/g;
E——吸附率,%;
C0——吸附前样液中羟基柠檬酸质量浓度,mg/m L;
C1——吸附后样液中羟基柠檬酸质量浓度,mg/m L;
V1——加入粗提液体积,m L;
W——树脂质量,g。
② 解吸率的测定[11]:取上述静态吸附饱和后的树脂,分别置于5个100 m L具塞锥形瓶中,用蒸馏水洗涤后,分别加入1 mol/L NaCl溶液20 m L,静置过夜后取上清液测定羟基柠檬酸的质量浓度,按式(3)计算树脂的解吸率。

式中:
E'——解吸率,%;
C——解吸后样液中羟基柠檬酸质量浓度,mg/m L;
C0——吸附前样液中羟基柠檬酸质量浓度,mg/m L;
C1——吸附后样液中的羟基柠檬酸质量浓度,mg/m L;
V2——加入洗脱液体积,m L;
V1——加入粗提液体积,m L。
(2)吸附动力学曲线:在100 m L具塞锥形瓶中,加入2 g(湿重)预处理好的D201树脂和浓度为2.82 mg/m L的羟基柠檬酸溶 液 20 m L,吸取 15,30,45,60,120,240,360 min时的上清液,测定羟基柠檬酸的质量浓度,按式(1)计算羟基柠檬酸的吸附容量并绘制静态吸附曲线。
(3)解吸动力学曲线:在100 m L具塞锥形瓶中,加入2 g(湿重)吸附羟基柠檬酸的D201树脂,用蒸馏水洗涤后,再加入1 mol/L的 NaCl溶液20 m L,吸取15,30,45,60,120,240,360 min时的上清液,测定羟基柠檬酸的质量浓度,按照式(3)计算树脂的解吸率并绘制静态解吸曲线。
(4)静态吸附试验选择最优p H值:分别称取5份2 g(湿重)预处理好的D201树脂,置于5个100 m L具塞锥形瓶中,加入质量浓度为2.82 mg/m L的羟基柠檬酸溶液20 m L,p H值分别调为2,3,5,7,9,测定上清液中羟基柠檬酸的质量浓度,按式(1)计算饱和吸附容量。
(5)解吸溶液的选择:在8个100 m L具塞锥形瓶中,加入2 g(湿重)吸附羟基柠檬酸的D201树脂,用蒸馏水洗涤后,分别加入1 mol/L NaOH、NaCl、KOH、氨水、醋酸、磷酸、盐酸、硫酸溶液20 m L,取上清液测定羟基柠檬酸的质量浓度,按式(3)计算树脂的解吸率。
(6)解吸液浓度的选择:分别称取2 g(湿重)吸附羟基柠檬酸的D201树脂,置于10个100 m L具塞锥形瓶中,用蒸馏水洗涤后,分别加入0.1,0.2,0.3,0.4,0.5,1.0,1.5,2.0,2.5,3.0 mol/L NaCl水溶液20 m L,取上清液测定羟基柠檬酸的质量浓度,按照式(3)计算树脂的解吸率。
1.3.6 动态吸附与洗脱研究
(1)上样浓度对树脂吸附的影响:将上样浓度分别调为3.12 mg/m L和6.81 mg/m L,均以1.0 m L/min的流速通过高径比为11(树脂20 g)的树脂。每10 m L收集一管洗脱液,测每管羟基柠檬酸含量,考察上样浓度对树脂吸附性能的影响。
(2)上样流速对树脂吸附的影响:将上样浓度调为3.12 mg/m L,分别以1.0,3.0 m L/min的流速通过高径比为11(树脂20 g)的树脂。每10 m L收集一管洗脱液,测每管羟基柠檬酸含量,考察上样流速对树脂吸附性能的影响。
(3)解吸液浓度对树脂洗脱的影响:分别配制0.4,1.0 mol/L的 NaCl溶液作为解吸液,以1.0 m L/min的流速分别洗脱吸附羟基柠檬酸的树脂,每10 m L收集一管洗脱液,测每管羟基柠檬酸含量,考察解吸液浓度对树脂洗脱的影响。
(4)解吸液流速对树脂洗脱的影响:以0.4 mol/L的NaCl溶液作为洗脱液,分别采用1.0,3.0 m L/min的流速洗脱吸附羟基柠檬酸的树脂,每10 m L收集一管洗脱液,测每管羟基柠檬酸含量,考察解吸液流速对树脂洗脱的影响。
1.3.7 羟基柠檬酸的纯化 经D201树脂吸附与解吸后,将解吸液收集,并以1 m L/min的流速通过预处理好的001×7阳离子交换树脂柱,去除解吸液中的Na+杂质离子。收集解吸液,旋转浓缩至一定体积后,真空冷冻干燥,得到较纯的羟基柠檬酸样品。
2 结果与讨论
2.1 静态吸附与洗脱结果分析
2.1.1 离子交换树脂的选择 由图2可知,D201对羟基柠檬酸的吸附率和解吸率均高于其他树脂。D201树脂对羟基柠檬酸的吸附和解吸率最高的原因可能有两个:①D201树脂为强碱性阴离子树脂,羟基柠檬酸根离子容易与树脂上带有的阴离子进行交换,并且该树脂具有交换速度快、交换容量大等特点;②D201树脂为大孔树脂,羟基柠檬酸较易进入到树脂内部而发生交换。因此选择D201树脂做后续试验。

图2 各树脂对羟基柠檬酸静态吸附率、解吸率的比较Figure 2 Adsorption and elution of HCA by different resins
2.1.2 离子交换树脂静态吸附动力学曲线 评价树脂的一个重要指标是树脂的吸附速率,所选的树脂不仅需要有高的吸附量,而且需要有快速达到吸附平衡的能力[10]。由图3可知,D201对羟基柠檬酸为快速平衡型,在2 h内基本达到平衡,其饱和吸附量为27.325 mg/g。

图3 静态吸附动力学曲线Figure 3 Static adsorption kinetic of D201 resin for HCA
2.1.3 离子交换树脂静态解吸动力学曲线 由图4可知,D201树脂在90 min左右就即将达到最高解吸率,解吸基本完全的时间为2 h,此时的静态解吸率为59.7%。

图4 静态解吸动力学曲线Figure 4 Static desorption kinetic of D201 resin for HCA
2.1.4 上样液p H值的选择 由图5可知,在p H值较低的情况下,D201树脂对羟基柠檬酸的吸附容量较低;随着p H值的升高,D201树脂对羟基柠檬酸的吸附容量逐渐增加,当p H值为5时,其吸附容量最大;而随着p H值的进一步升高,树脂的吸附容量逐渐降低。原因可能是,当p H值为5时,羟基柠檬酸的酸根离子较多,增大电荷,从而有利于树脂对羟基柠檬酸的吸附。

图5 上样液p H值对D201树脂吸附容量的影响Figure 5 Effect of p H on adsorption capacity of D201 resin
2.1.5 解吸溶剂的筛选 由图6可知,磷酸、盐酸、硫酸这3种酸对HCA的解吸率均较高,NaCl溶液也有一定的解吸率。但如果选择磷酸、盐酸、硫酸溶液作为洗脱剂,在后续操作时酸根除去难度大。因此选择NaCl溶液进行洗脱,再将洗脱液通过酸性阳离子交换树脂得到羟基柠檬酸,以达到脱盐纯化效果。该方法简单,可操作性强。所以,综合考虑,选择NaCl溶液作为解吸溶剂。

图6 不同解析溶剂解析效果比较Figure 6 Effect of different of eluent by D201 resin
2.1.6 解吸剂浓度的筛选 由图7可知,在低浓度的NaCl溶液对羟基柠檬酸的解吸率不高;随着NaCl溶液浓度的不断增高,在浓度为0.4 mol/L时解吸率达到最高,为83.24%;继续增大NaCl溶液的浓度,解吸率反而减小,因此选择0.4 mol/L NaCl溶液作为解吸剂。

图7 洗脱液浓度对羟基柠檬酸洗脱率的影响Figure 7 Effect of concentration of eluent by D201 resin
通过静态吸附与洗脱研究,得知D201离子交换树脂对羟基柠檬酸的静态吸附饱和容量为27.325 mg/g,静态解吸率为83.24%。D201树脂静态吸附的最佳条件为吸附时间2 h,上样液p H值5;解吸的最佳条件为选用0.4 mol/L NaCl溶液为解吸剂,解吸时间2 h。
2.2 动态吸附与洗脱研究结果分析
2.2.1 上样液浓度的选择 由图8可知,当上样液浓度为3.12 mg/m L时,羟基柠檬酸在D201树脂上的穿透体积为130 m L,穿 透 容 量 为 45.63 mg/g;当 上 样 液 浓 度 为6.81 mg/m L时,羟基柠檬酸在D201树脂上的穿透体积为60 m L,穿透容量为35.91 mg/g。由此可知,上样液浓度低有利于树脂交换。离子交换树脂有一定的交换容量,若上样液浓度大,树脂与吸附离子间不能够完全交换,树脂很容易出现渗漏。因此选择3.12 mg/m L做为后续试验的上样浓度。
2.2.2 上样液流速的选择 由图9可知,当上样液流速为1 m L/min时,羟基柠檬酸在D201树脂上的穿透体积为130 m L,穿透容量为45.63 mg/g;流速为3 m L/min时,羟基柠檬酸在D201树脂上的穿透体积为50 m L,穿透容量为17.8 mg/g。由此可知,较小的流速利于树脂的吸附。若流速过大,上样液与树脂之间的接触时间短,会导致树脂来不及吸附上样液就发生渗漏。因此本试验选择上样液流速为1 m L/min做后续试验。

图9 上样液流速对树脂吸附的影响Figure 9 Effect of sample rate on D201 resin adsorption of HCA
2.2.3 洗脱液浓度的选择 由图10可知,当NaCl溶液浓度为0.4 mol/L,即洗脱液浓度较小时,出峰较快,洗脱峰型较集中,洗脱峰值较高;而当NaCl溶液的浓度为1 mol/L,即洗脱液浓度较大时,峰型分布不均匀,出峰较慢,洗脱峰值较低。因此选择浓度为0.4 mol/L NaCl溶液来洗脱羟基柠檬酸。
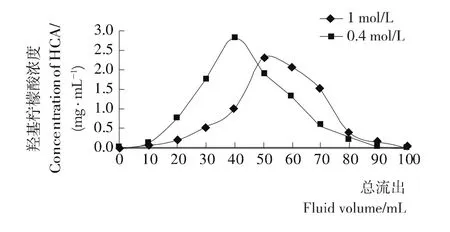
图10 不同浓度洗脱液对羟基柠檬酸的洗脱Figure 10 Effect of eluent concentration on D201 resin elution of HCA
2.2.4 洗脱液流速的选择 由图11可知,不同的洗脱流速对洗脱峰型并没有太大影响,但选择较小的洗脱液流速,洗脱液有较充分的时间与树脂交换,羟基柠檬酸的洗脱峰值较高。因此选择1.0 m L/min的洗脱液流速较为合适。

图11 不同洗脱液速度对羟基柠檬酸的洗脱Figure 11 Effect of eluent rate on D201 resin elution of HCA
通过动态吸附和洗脱研究,得知当上样液浓度3.12 mg/m L、上样液流速1 m L/min时树脂对羟基柠檬酸的吸附较完全;当洗脱液NaCl浓度为0.4 mol/L、洗脱液流速为1 m L/min时,对羟基柠檬酸的解吸效果较好,洗脱峰值较高。
2.3 离子交换树脂纯化后羟基柠檬酸纯度
羟基柠檬酸标准品经超纯水溶解,依1.3.4(1)的方法进行HPLC分析,如图12所示,保留时间5.280 min的为羟基柠檬酸,纯度大于98%。
藤黄果粗提物水溶液,依1.3.4(1)的方法进行 HPLC分析,如图13(a)所示,经保留时间及峰高增高法定性为羟基柠檬酸,通过外标定量法,计算得到粗产品中羟基柠檬酸和含量为40.3%。
经D201及001(7离子交换树脂纯化后的样品收集,依1.3.4(1)的方法进行 HPLC分析,如图13(b)所示,经外标定量法,计算得到经离子交换树脂纯化后羟基柠檬酸的纯度为91.3%。

图12 羟基柠檬酸标准品色谱图Figure 12 Chromatogram of HCA standard

图13 羟基柠檬酸纯化前后色谱图Figure 13 Chromatogram of unpurified and purified of HCA
3 结论
通过5种型号阴离子交换树脂静态吸附和解析的比较,发现D201型离子交换树脂对羟基柠檬酸的吸附量大、吸附率高,并易解吸,具有高的吸附率和解析率,适用于羟基柠檬酸的纯化研究。D201树脂纯化羟基柠檬酸的最佳工艺条件为:上样液 p H 5,上样液质量浓度3.12 mg/m L,洗脱液0.4 mol/L的 NaCl溶 液,上 样 流 速 与 洗 脱 流 速 均 为1 m L/min。结果显示:经D201型离子交换树脂纯化后羟基柠檬酸纯度由40.3%提高到了91.3%,得率为10.8%。表明,D201树脂对羟基柠檬酸的分离纯化具有良好的选择性和应用前景。
1 袁尔东.功效活性成分-羟基柠檬酸的研究进展[J].四川食品与发酵,2006,42(2):19~23.
2 李兰英,许丽,丁敏,等.HPLC检测功能食品中羟基柠檬酸主要成分和两种非法添加药物[J].食品安全质量检测学报,2012,3(1):10~16.
3 Soni M G,Burdock G A,Preuss H G,et al.Safety assessment of(-)-hydroxycitric acid and Super CitriMax,a novel calcium/potassium salt[J].Food and Chemical Toxicology,2004(42):1 513~1 529.
4 Shara M,Ohia S E,Yasmin T,et al.Dose-and time-dependent effects of a novel(-)-hydroxycitric acid extract on body weight,hepatic and testicular lipid peroxidation,DNA fragmentation and histopathological data over a period of 90 days[J].Mol Cell Biochem.,2003(254):339~346.
5 Preuss H G,Bagchi D,Bagchi M,et al.Effects of a natural extract of(-)-hydroxycitric acid(HCA-SX)and a combination of HCA-SX plus niacin-bound chromium and Gymnema sylvestre extract on weight loss[J].Diabetes Obes Metab,2004(6):171~180.
6 赵希荣.羟基柠檬酸的来源、制备方法和性质[J].中国食品添加剂,2004(4):59~63.
7 张波.羟基柠檬酸功能食品液相色谱检测[D].天津:天津大学,2012.
8 Scott Alexander Moffett,Ashok Kumar Bhandari,Bhagavahula Raindranath,et al.Hydroxycitric acid concentrate and food products prepared therefrom:United States,5656314[P].1997-08-12.
9 张亚飞,乐国伟,施用晖,等.小麦蛋白Alcalase水解物免疫活性肽的研究[J].食品与机械,2006,22(3):44~46,93.
10 赵升强,欧仕益,邱瑞霞.D201树脂对绿原酸的吸附、解析性能研究[J].食品工业科技,2013(7):1~7.
11 杨磊,刘玉,张琳,等.离子交换树脂对白扦中莽草酸的分离纯化[J].化工进展,2009,28(1):145~149.
12 刘坐镇,江邦和,徐建刚.D315大孔弱碱性阴离子交换树脂在柠檬酸精制中的应用[J].上海化工,1999,24(21):15~17.
13 孙啸涛,李柰,王昌涛.高效液相色谱法评价大孔树脂纯化甘草酸工艺[J].食品科学,2013,34(6):93~97.
