牛源大肠杆菌O157∶H7的分离鉴定及其生物学特性研究
2014-04-02程慧芳寇亚楠陈雅君刘中原张龙现王亚宾陈丽颖
程慧芳,寇亚楠,陈雅君,刘中原,张龙现,2,王亚宾,陈丽颖,胡 慧,2
肠出血性大肠杆菌(Enterohemorrhagic Escherichia coli) O157∶H7是一种重要的人兽共患传染病病原菌。感染该菌可使人患腹泻、出血性结肠炎(hemorrhagic colitis,HC),此外还可引发溶血性尿毒综合征(hemolytic uremic syndrome,HUS)及血栓性血小板减少性紫癜(thrombotic thrombocytopenic purpura,TTP)等并发症,严重者可导致死亡,致死率达5%~10%[1-2]。
自1982年美国首次暴发了由大肠杆菌O157∶H7引起的出血性肠炎以来,加拿大、英国、日本等国也相继报道了大肠杆菌O157∶H7的爆发和流行[3];我国也陆续有多个省份在食品、家禽、家畜、昆虫、腹泻病患者中检出该致病菌[4-5],肠出血性大肠杆菌O157∶H7的感染已经成为一个全球性的公共卫生问题。
大肠杆菌O157∶H7是一种以食物为主要传播途径的致病菌,牛、羊、猪和鸡等家畜家禽是其主要宿主[3,6],该菌感染后可从动物传染给人,也可由人传染给人而引起感染;同时也可以通过食物、水源而间接的传染给人[7]。我国于1987年首次从出血性结肠炎病人粪便中分离到大肠杆菌O157∶H7,此后多个省也都陆续有报道从市售食品、进口食品、家畜家禽、腹泻患者粪便中分离到该菌。因此,对动物源性大肠杆菌O157∶H7进行快速检测方法的研究、流行病学调查、生物学特性研究以及遗传变异研究就显得尤为重要,是及时有效地防控大肠杆菌O157∶H7感染流行的关键步骤。
为了解大肠杆菌O157∶H7在牛群中的流行及其病原学特性,本试验从郑州地区牛场采集粪便及牛奶样品共146份,对大肠杆菌O157∶H7进行了分离鉴定,并对其生物学特性进行了分析,为动物源大肠杆菌O157∶H7流行病学研究提供了资料,也为大肠杆菌O157∶H7的防控奠定了基础。
1 材料与方法
1.1样品采集 取自郑州地区3个不同奶牛场健康成年泌乳奶牛排出的新鲜粪便及鲜牛奶。每份新鲜粪便样品分别装入一次性的自封袋内;生鲜牛奶直接装入灭菌试管。所有的样品均放于低温冰盒中,24 h内送往实验室,每批样品均统一处理。
1.2菌种 大肠杆菌O157∶H7标准菌株ATCC 43895由河南省动物源性食品安全重点实验室提供;所用菌株均用30%甘油保存在-70 ℃。
1.3主要试剂与仪器 大肠杆菌O157∶H7选择性培养基购自广东环凯微生物科技有限公司; 2×PCR TaqMix购自北京美莱博医学科技有限公司;微量生化鉴定管购自杭州天和微生物试剂有限公司。PCR仪(Bio-rad,PTC-200 PCR扩增仪,USA)紫外凝胶成像仪(美国ALPHA INNOTECH);紫外分析仪天UV-2000(天能科技上海有限公司)。
1.4引物设计与合成 参考GenBank公布的EHEC O157∶H7的rfbE基因(参考序列S83460)、fliC基因(参考序列AF228488)、hlyA基因(参考序列EU118026.1)序列和文献报道的Stx2基因、eaeA基因序列,应用Primer Premier 5.0生物软件设计出符合多重PCR要求的5对引物。引物由上海博尚生物技术有限公司合成。各引物序列及扩增长度见表1。

表1 试验引物序列及预计扩增长度
1.5大肠杆菌O157∶H7分离、鉴定 按常规方法将样品经预增菌处理后[10],接种于大肠杆菌O157∶H7显色培养基上,筛选纯化出疑似大肠杆菌O157∶H7菌株,然后应用本试验室已建立的大肠杆菌O157∶H7双重PCR方法对疑似菌株进行鉴定。
1.6大肠杆菌O157∶H7临床分离株的生物学特性研究
1.6.1生化试验 取生长良好的红色菌落接种于营养肉汤,37 ℃温箱培养24 h ,按常规方法进行生化试验,主要包括吲哚试验、V-P试验、糖类发酵试验、尿素酶试验以及柠檬酸盐试验、硫化氢试验、丙二酸盐试验等。
1.6.2生长曲线的测定与绘制 使用分光光度计测定大肠杆菌O157∶H7标准株和临床分离株的OD600值。每隔0.5 h测量1次,并对浓度大的菌悬液用未接种的LB液体培养基适当稀释后测定,使其OD600值在0.50~1.00以内,经稀释后测得的OD值要乘以稀释倍数,才是培养液实际的OD值。重复测定3次,以上述各个测定点的时间为横坐标,OD600值为纵坐标,绘制大肠杆菌O157∶H7的生长曲线。
1.6.3生物被膜的形成 采用试管法和玻片法两种方法。
1.6.3.1试管法 将菌液于无菌条件下接种于液体LB中,37 ℃恒温箱中培养。分别于8、24、36、48和72 h时取出试管,将试管中液体弃去,用PBS漂洗3次,甲醇固定1 min,弃去,加入结晶紫染色15 min,吸取试管中多余的结晶紫染色液后,在自来水下冲洗试管3~5 min,把试管倒置在滤纸上除去过多的水,并在37 ℃烘箱中烘干,观察,记录。
1.6.3.2玻片法 菌液用LB培养基1∶200稀释, 取3 mL置6孔细胞培养板中,放入无菌盖玻片,37 ℃培养,每24 h换液一次。分别于第8、24、36、48和72 h取出盖玻片,PBS漂洗3次,除去浮游细菌,用10%甲醇将细菌固定15 min,结晶紫染色5 min,自来水冲去多余染色液,晾干后,用树胶将盖玻片粘到载玻片上,镜检。
1.7大肠杆菌O157∶H7临床分离株的毒力基因检测 为了解分离的2株大肠杆菌O157∶H7携带毒力基因的情况,针对大肠杆菌O157∶H7的细胞溶血素hlyA基因、志贺菌素stx2基因以及黏附基因eaeA设计特异性引物,应用实验室已建立的多重PCR方法对其进行检测与分析[11]。
2 结 果
2.1大肠杆菌O157∶H7临床分离株的分离鉴定 采集的样品经初步增菌培养,在麦康凯琼脂平板上进行纯化培养,然后经大肠杆菌O157∶H7选择性培养基初步分离后,再经多重PCR对其鉴定。结果表明本次从牛场采集的样品,共分离到2株大肠杆菌O157∶H7,分别命名为L1和L2,其检出率为1.4%。PCR检测结果见图1。
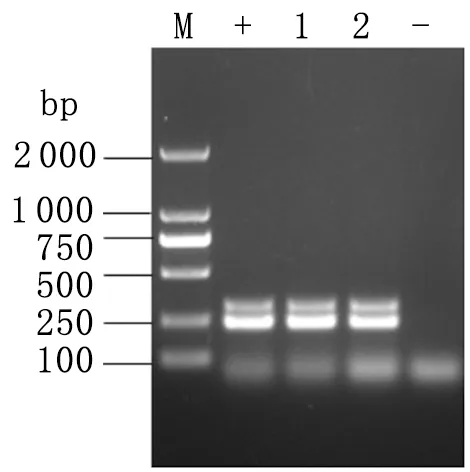
图1大肠杆菌O157∶H7PCR检测结果
Fig.1ResultsofPCRtodetecttheEscherichiacoliO157∶H7isolates
M: DL2000 DNA marker; +: Positive control;-: Negative control; 1: L1 isolate; 2: L2.
2.2大肠杆菌O157∶H7临床分离株的生物学特性试验结果
2.2.1生化试验结果 大肠杆菌O157∶H7标准株和临床分离株的生化试验结果显示:靛基质阳性,V-P阴性,不利用柠檬酸盐,不产H2S等,3株菌所得结果均相同,均符合大肠杆菌的常规生化特性。另外,尿素酶试验、精氨酸双水解酶试验、部分糖类的发酵试验结果有一定差异,试验中3株菌均发酵山梨醇并产气,这一点与文献报道的大多数大肠杆菌O157∶H7不同。具体的生化特性见表2。
2.2.2大肠杆菌O157∶H7生长曲线的测定与绘制 使用754紫外分光光度计测定细菌的OD600值,将同时接种的菌液每隔0.5 h测定1次,根据OD值测定结果绘制出生长曲线,结果如图2所示。与标准菌株相比,大肠杆菌O157∶H7 临床分离株L1和L2进入对数生长期的时间较早,进入平台期的时间也较早。L1和L2菌株的生长曲线比较一致。
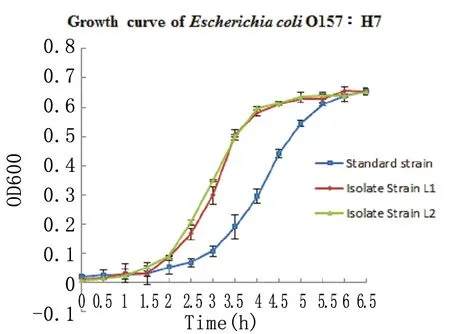
图2大肠杆菌O157∶H7在LB培养基中的生长曲线
Fig.2GrowthcurveofEscherichiacoliO157∶H7inLBculturemedium
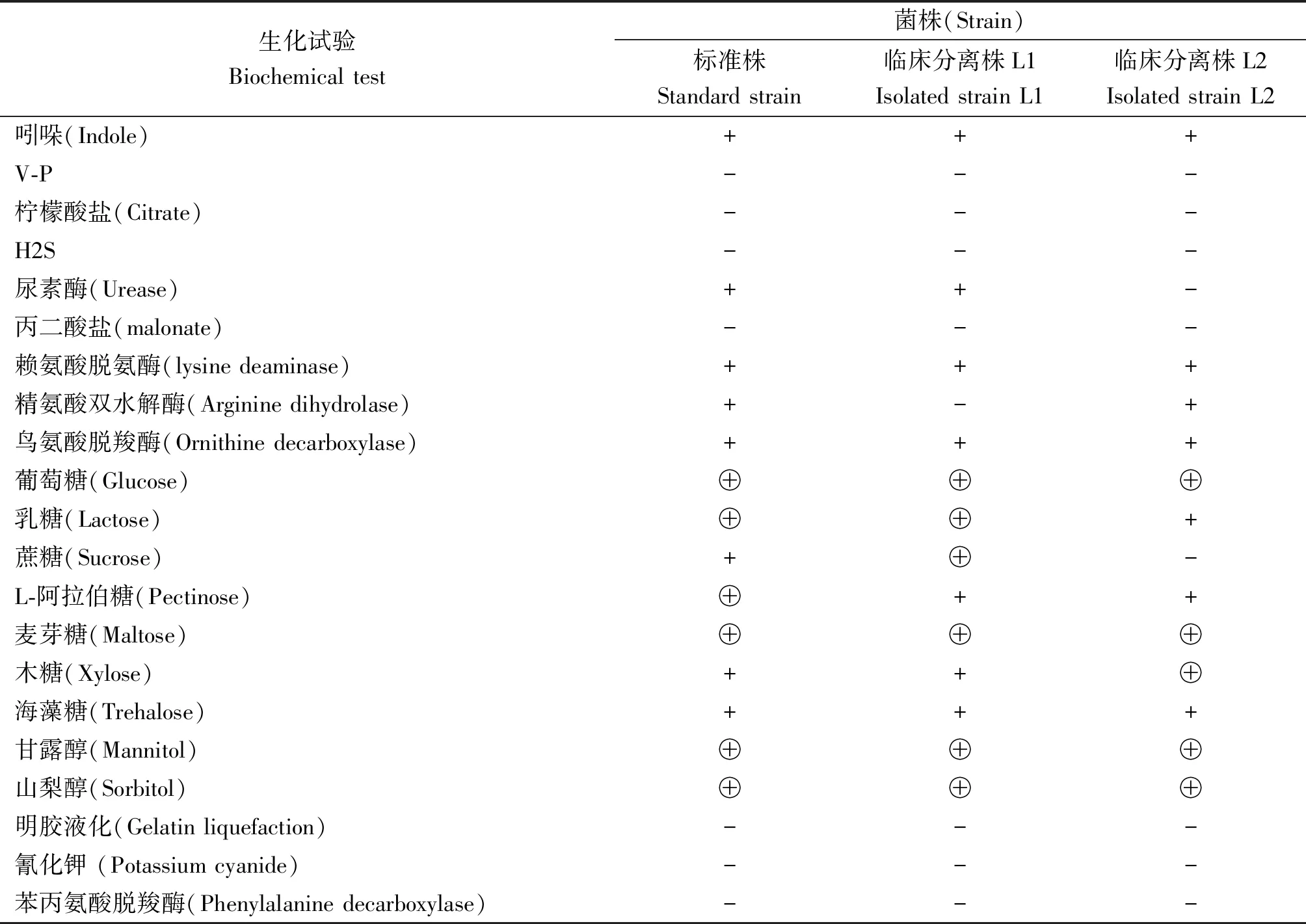
表2 大肠杆菌O157∶H7各项生化试验结果
Note: “⊕” shows producing acid and gas; “+” shows yielding acid; “-” shows negative reaction.
2.2.3大肠杆菌O157∶H7生物被膜形成的结果
2.2.3.1试管法 利用玻璃试管法直观在试管壁上观察生物被膜,可见标准株接种后24 h细菌开始粘附于试管壁,36 h形成完整的被膜,48 h后细菌开始脱落。临床分离株L1接种后36 h细菌开始明显的粘附于试管壁,48 h形成完整的被膜,72 h后细菌开始脱落。临床分离株L2接种后24 h细菌开始大量粘附于试管壁,36 h形成完整的被膜,48 h后细菌开始脱落。
2.2.3.2玻片法 应用玻片法观察生物被膜的形成(见图3A-C),结果显示标准株生物被膜在24 h处于细菌起始粘附过程,可观察到少量细菌开始粘附于载体上;至36 h已经形成成熟完整生物被膜,大量微菌落连成片状;48 h后微菌落减少,生物被膜开始脱落,结果如图3(A)。临床分离株L1生物被膜在24 h处于细菌起始粘附过程,可观察到少量细菌开始粘附于载体上;至48 h已经形成成熟完整生物被膜,大量微菌落连成片状;72 h后微菌落减少,生物被膜开始脱落,结果如图3(B)。临床分离株L2生物被膜在24 h处于细菌起始粘附过程,可观察到少量细菌开始粘附于载体上;至36 h已经形成成熟完整生物被膜,大量微菌落连成片状;48 h后微菌落减少,生物被膜开始脱落,结果如图3(C)。
2.3大肠杆菌O157∶H7临床分离株的毒力基因检测结果 对2株大肠杆菌O157∶H7临床分离株携带的毒力基因(rfbE基因、fliC基因、hlyA基因、eaeA基因和stx2基因)进行多重PCR扩增,多重PCR检测结果(见图4):2株菌株均携带有hlyA基因和eaeA基因, L1携带Stx2基因。
3 讨 论
肠出血性大肠杆菌O157∶H7感染性腹泻是近年来新发现的危害严重的肠道传染病,主要通过食物传播,牛、羊、猪和鸡等家畜家禽是其主要宿主,其中以牛的带菌率最高,而且牛一旦感染这种细菌,排菌时间至少为1年。有报道称人感染10个活菌可致病,因此,加强动物源性大肠杆菌O157∶H7的流行病学调查对该病的防治具有重大意义。为了解郑州地区牛携带大肠杆菌 O157∶H7的情况,收集粪便和新鲜牛奶共146份,应用实验室已建立的大肠杆菌 O157∶H7多重PCR方法对其进行了检测,共分离出2株大肠杆菌 O157∶H7,进一步对临床分离的动物源大肠杆菌O157∶H7的生物学特性以及携带的毒力基因情况进行了检测分析,为大肠杆菌O157的流行病学调查研究奠定基础。
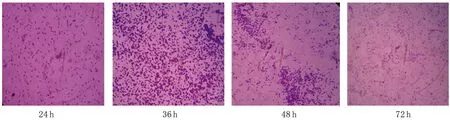
图3(A) 动物源大肠杆菌O157∶H7标准株生物被膜形成(400×)
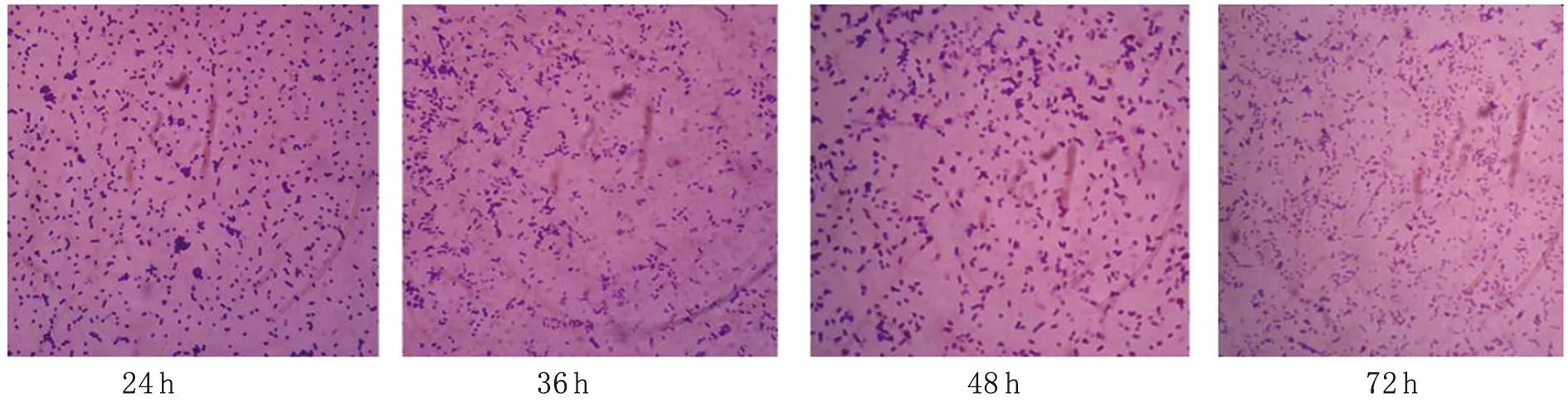
图3(B) 动物源大肠杆菌O157∶H7临床分离株L1生物被膜形成(400×)
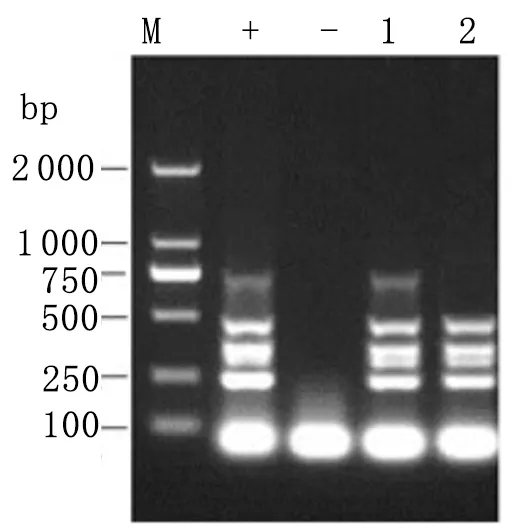
图4大肠杆菌O157∶H7毒力基因的多重PCR检测结果
Fig.4ResultsofmultiplexPCRtodetectthevirulencegenesoftheEscherichiacoliO157∶H7isolates
M: DL2000 DNA marker; +: Positive control;-: Negative control; 1: L1 isolate; 2: L2 isolate.
3.1生化试验 细菌生化试验是细菌生物学特性中的重要一环,通过生化试验可以初步鉴别不同菌株的差异。尿素酶、精氨酸双水解酶试验,乳糖、蔗糖、L-阿拉伯糖和木糖这些糖类发酵试验大肠杆菌O157∶H7的3株菌之间均有差异,这可能与菌株来源和携带毒力因子有一定关系,从而表现出一定的差异,为进一步研究提供了初步依据。
许多文献报道大肠杆菌O157∶H7均为山梨醇阴性或迟缓阳性,本生化试验中山梨醇试验O157∶H7标准株和临床分离株均为阳性并产气,根据这一特性,可以选用山梨醇麦康凯琼脂鉴定其准确性。2006年,范放等[12]分离到一株山梨醇阳性菌株,2011年,张书萧[13]研究中又分离到一株分解山梨醇的大肠杆菌O157∶H7菌株,因此在进行大肠杆菌O157∶H7初筛时,需要慎重选择培养基,在出现此类情况时应反复进行验证。
3.2生长曲线 不同来源的细菌有其各自不同的生长规律,同一种细菌不同的表现型也会有不同的生长规律。大肠杆菌O157∶H7生长曲线的测定结果表明,动物源大肠杆菌O157∶H7临床分离株L1、L2比标准株的迟缓期短,较早的进入对数生长期;大肠杆菌O157∶H7标准株生长曲线的斜率小于临床分离株L1、L2的斜率;大肠杆菌O157∶H7标准株比临床分离株L1、L2的稳定期短。从而说明携带不同毒力基因的动物源性大肠杆菌O157∶H7之间的生长曲线存在差异,不同来源的菌株及有无携带毒力因子的菌株生长曲线对数末期的不同,选择合适的时间用于如小鼠灌毒试验、细胞粘附试验等试验的研究。
3.3生物被膜 生物被膜作为自然界中细菌主要的生存方式,给人类的生产生活带来了严重危害。许多研究表明生物被膜中菌体表现出对抗生素的高度不敏感[14],生物被膜一旦形成, 被膜深层细菌对抗生素的抗性最高可达浮游细菌的1 000倍[15],且成为潜在的感染源, 被膜向周围环境缓慢释放浮游菌, 引起反复性和难治性感染。本试验采用试管法和玻片法对临床分离的携带不同毒力基因的大肠杆菌O157∶H7生物被膜的生长情况进行了72 h的连续观察,生物培养膜片和玻璃试管上的生物被膜生长周期是一致的。
结果显示携带不同毒力基因的大肠杆菌O157∶H7生物被膜形成时间有差异,标准株和L2形成生物被膜较早,L1较晚,即标准株和L2完整的生物被膜是在36 h时形成的,L1菌株完整生物被膜是在48 h。此现象可能为其来自不同的宿主,所携带的毒力因子不同,毒力因子在大肠杆菌O157∶H7的免疫致病过程中起着重要作用,不同宿主来源的大肠杆菌O157∶H7其携带的毒力因子也不完全相同,因此,不同来源的大肠杆菌O157∶H7菌株其生物学特性、粘附特性等均有一定差别。
3.4毒力基因的检测 由于大肠杆菌O157∶H7的致病力取决于其携带的毒力基因,所以对大肠杆菌O157∶H7毒力基因的检测非常必要。大肠杆菌O157∶H7的毒力基因主要有:产生细胞溶血素的hylA基因,产生志贺菌素的stx1和stx2基因,产生大肠杆菌黏附毒素的eaeA基因等。据报道人类感染大肠杆菌后发病多与stxl、stx2和eaeA等有关[13, 15],因此本试验从牛源样品中分离大肠杆菌O157∶H7,并根据GenBank中编码大肠杆菌O157的O抗原的rfbE基因、H抗原的fliC基因、细胞溶血素的hlyA基因、志贺菌素的stx2基因以及大肠杆菌黏附素的eaeA基因为靶基因的5种基因的特异性序列,设计并合成5对引物,运用多重PCR方法快速的检测大肠杆菌O157∶H7临床分离株所携带的毒力基因,结果表明2株大肠杆菌O157∶H7均带有hlyA、eaeA基因,一株还带有Stx2毒力基因,为进一步研究大肠杆菌O157∶H7的致病机制奠定了基础。关于各毒力基因之间的关系,以及各毒力基因在大肠杆菌O157∶H7致病过程中的作用机制,尚待进一步研究。
参考文献:
[1]Guo Y,Liu D,Bian Z,et al. Down-regulation of platelet surface CD47 expression inEscherichiacoliO157∶H7 infection-induced thrombocytopenia[J]. PLoS One,2009, 4(9): e7131. DOI: 10.1371/journal.pone.0007131
[2]Luo P, Zeng H,Yi Y,et al. Construction, expression, and immunogenicity identification of STX2 A1 subunit protein of EHEC O157∶H7[J]. Immunol J, 2008,24(3): 287-290. (in Chinese)
罗萍, 曾浩, 易勇, 等.EHECO157∶H7 志贺毒素ⅡA1亚单位蛋白的构建表达与免疫原性鉴定 [J]. 免疫学杂志, 2008, 24(3): 287-290.
[3]Pan QX, Wang YS, Liu H, et al. Expression and identification of rfbE and fliC genes of enterohemorrhagicE.coli(EHEC) O157∶H7[J]. Jiangsu J Agr Sci, 2009, 25(3): 568-571. (in Chinese)
潘群兴, 王永山, 刘洁, 等. 肠出血性大肠杆菌 O157∶H7 rfbE 与 fliC 基因的表达及鉴定[J]. 江苏农业学报, 2009, 25(3): 568-571.
[4]Ye Q,Shi MK,Liu B,et al.Etiological and epidemic analysis ofEscherichiacoliO157∶H7 in Hebei Province[J]. Chin J Public Health, 2000,16(7): 613-614. DOI: 10. 1007/s00192-011-1474-4
叶青,史明坤,刘波,等. 河北省 O157∶H7大肠杆菌病原学和流行病学研究[J]. 中国公共卫生, 2000,16(7): 613-614. DOI: 10. 1007/s00192-011-1474-4
[5]Chao QG, Yang XM, Ge Y, et al. PCR for detecting animal-derivedEscherichiacoliO157∶H7[J]. Food Sci, 2010, 31(8): 212-215. (in Chinese)
巢强国,杨学明,葛宇,等. PCR法检测食品中大肠杆菌O157∶H7[J]. 食品科学, 2010, 31(8): 212-215.
[6]Slutsker L, Ries AA, Greene KD, et al.EscherichiacoliO157∶H7 diarrhea in the United States: clinical and epidemiologic features[J]. Ann Internal Med, 1997, 126 (7): 505-513. DOI: 10.7326/0003-4819-126-7-199704010-00002
[7]Ye J, Zhan L, Lu Q, et al. Surveillance and molecular characterization ofEscherichiacoliO157 in Zhejiang province[J]. Chin J Zoonoses, 2008,24(3): 247-251. DOI: 10.3969/j.issn.1002-2694.2008.03.015 (in Chinese)
叶菊莲, 占利, 陆群英, 等. 浙江省O157大肠杆菌监测及其分子生物学特性[J]. 中国人兽共患病学报, 2008,24(3): 247-251. DOI: 10.3969/j.issn.1002-2694.2008.03.015
[8]Wang G, Clark CG, Rodgers FG. Detection inEscherichiacoliof the genes encoding the major virulence factors, the genes defining the O157∶H7 serotype, and components of the type 2 Shiga toxin family by multiplex PCR[J]. J Clin Microbiol, 2002, 40(10): 3613-3619.
[9]Fagan PK, Hornitzky MA, Bettelheim KA, et al. Detection of Shiga-like toxin (stx1 andstx2), intimin (eaeA), and enterohemorrhagicEscherichiacoli(EHEC) hemolysin (EHEC hlyA) genes in animal feces by multiplex PCR[J]. Appl Environ Microbiol, 1999, 65(2): 868-872.
[10]Shen P, Chen X, Wei B. Microbiolgy[M]. Beijing: Higher Education Press, 2009. (in Chinese)
沈萍, 陈向东, 卫扬保. 微生物学[M]. 北京:高等教育出版社, 2009.
[11]Chen Y, Hu H, Duan Z, et al. A preliminary study on multiplex PCR for detecting animal-derivedEscherichiacoliO157∶H7[J]. Acta Agriculturae Boreali-Sinica, 2011, 26(5): 87-91. (in Chinese)
陈雅君, 胡慧, 段志刚, 等. 动物源大肠杆菌 O157∶H7 多重PCR检测方法的初步研究[J]. 华北农学报, 2011, 26(5): 87-91.
[12]Fan F, Situ C, Huang L, et al. Detection of entro-hemorrhagucE.coliO157∶H7 with sorbitol-positive and analysis[J]. Chin J Pest Ctrl, 2006, 2: 4. (in Chinese)
范放, 司徒翠华, 黄李华, 等. 检出山梨醇阳性肠出血性大肠杆菌 O157∶H7一例及特征分析[J]. 医学动物防制, 2006,2:4.
[13]Zhang SX, Liu G, Shao DH, et al. Isolation and identification of Shiga toxin type 2 producing and sorbitol-positiveEscherichiacoliO157∶H7[J]. Chin J Anim Infect Dis, 2011, 19(4): 30-34. (in Chinese)
张书萧, 刘姑, 邵东华, 等. 一株产志贺毒素 Ⅱ 且山梨醇阳性的大肠杆菌 O157∶H7 的分离与鉴定[J]. 中国动物传染病学报, 2011,19(4):30-34.
[14]Walters MC, Roe F, Bugnicourt A, et al. Contributions of antibiotic penetration, oxygen limitation, and low metabolic activity to tolerance ofPseudomonasaeruginosabiofilms to ciprofloxacin and tobramycin[J]. Antimicrob Agents Chemother, 2003, 47(1): 317-323. DOI: 10.1128/AAC.47.1.317-323.2003
[15]Mah TC, O'Toole GA. Mechanisms of biofilm resistance to antimicrobial agents[J]. Trends Microbiol, 2001, 9(1): 34-39. DOI: 10.1016/S0966-842X(00)01913-2
