吡格列酮对大鼠颅脑损伤后核转录因子、肿瘤坏死因子-α和细胞凋亡的影响
2014-03-18陈慧慧王永青彭余江邵波朱良才段红宇何玺君李慧勇杨鹏翔杨帆
陈慧慧,王永青,彭余江,邵波,朱良才,段红宇,何玺君,李慧勇,杨鹏翔,杨帆
吡格列酮对大鼠颅脑损伤后核转录因子、肿瘤坏死因子-α和细胞凋亡的影响
陈慧慧,王永青,彭余江,邵波,朱良才,段红宇,何玺君,李慧勇,杨鹏翔,杨帆
目的探讨吡格列酮(PGZ)干预对大鼠颅脑损伤后脑组织中核转录因子NF-B、肿瘤坏死因子-(TNF-)和细胞凋亡的变化及其可能机制。方法84只健康雄性SD大鼠随机分为PGZ组(=42)及对照组(=42),前者通过改良Feeney法建立颅脑损伤模型后立即予以腹腔注射PGZ 10mg/kg,对照组则建立模型后予腹腔静脉注射0.9%氯化钠注射液2m l/kg,以后各组分别每24小时腹腔注射一次等量PGZ或0.9%氯化钠注射液,直至动物被处死,根据伤后处死时间随机分为1 h、3 h、6 h、12 h、24 h、3 d和7 d共7个亚组,每亚组各6只。取损伤灶周围组织采用免疫组织化学方法检测并比较挫伤灶周围脑组织中NF-B及TNF-蛋白表达情况,同时采用TUNEL法观察并比较脑挫伤灶周围细胞凋亡情况。结果PGZ组NF-B及TNF-蛋白表达水平较对照组均明显下降(均Ρ<0.05)。以NF-B含量水平为自变量,TNF-含量水平为应变量,回归方程Y(PGZ组)=-0.432+0.271X,2=0.947(Ρ<0.01);Y(对照组)=-4.168+0.748X,2=0.961(Ρ<0.01)。结论颅脑损伤后PGZ可能通过降低NF-B活性,控制炎症反应,减少细胞凋亡,从而发挥对颅脑损伤后的神经细胞发挥保护作用。
吡格列酮;颅脑损伤;核转录因子肿瘤坏死因子;细胞凋亡
吡格列酮(PGZ)是一种人工合成的胰岛素增敏剂噻唑烷二酮类药,临床上广泛应用于II型糖尿病的治疗。目前有报道提示PGZ能通过激活PPARΥ,
从而增强神经元的存活能力,促进神经祖细胞的增殖、控制炎症反应和抑制凋亡等,在中枢神经系统损伤后起一定的神经保护作用[1],但具体保护机制尚未完全阐明。本研究采用改良Feeney法制备颅脑损伤模型后予以PGZ干预后观察核转录因子NF-ΚB表达的变化,以及肿瘤坏死因子-α(TNF-α)表达及细胞凋亡的变化,探讨颅脑损伤后PGZ对继发性脑损伤的影响及可能机制,为进一步的临床应用提供理论依据。报道如下。
1 资料与方法
1.1 动物分组清洁级SD雄性大鼠84只(浙江大学医学院动物实验中心提供),体质量250~280 g。术前12 h禁食,不禁水,随机数字法将84只大鼠分为PGZ组(n=42)及对照组(n=42),上述两组再根据伤后处死时间分为1 h、3h、6 h、12h、24 h、3 d和7 d共7个亚组,每亚组各6只。
1.2 试剂PGZ及10%二甲基亚砜(DMSO)(Sigma公司,美国);NF-ΚB-p65及TNF-α免疫组化试剂盒(R&D Systems公司,美国);原位末端标记(TUNEL)试剂盒(Promega公司,美国);电子显微镜(OLYMPUS,日本)等。
1.3 动物模型制备及处置采用改良的霍永强等[2]自由落体脑创伤模型制作闭合性颅脑损伤模型。模型成功标志[3]:存在不同程度的瞳孔改变、肢体抽搐及意识障碍,伤后各项反射消失并在30m in内恢复。待大鼠自然苏醒后PGZ组立即予以腹腔注射PGZ 10 mg/kg,对照组则经腹腔注射0.9%氯化钠注射液2m l/kg,以后各组分别每24小时腹腔注射一次等量PGZ或0.9%氯化钠注射液,直至动物被处死。
1.4 指标检测
1.4.1 脑组织中NF-ΚB-p65及TNF-α的表达将大鼠麻醉,以0.9%氯化钠注射液进行心脏灌洗,用4℃10%多聚甲醛灌洗固定,并迅速断头取脑。选取的距脑挫伤灶边缘约5mm处脑皮质作为损伤脑组织,制成蜡块。自前往后连续冠状位切片,厚约5μm。每个标本取2张切片,严格按相关试剂盒检测要求进行操作,在显微镜(×400)下随机取损伤灶周围5个不重复视野观察,计数阳性细胞数,并求其平均值。
1.4.2 TUNEL染色严格按照试剂盒检测步骤进行操作。TUNEL染色在光镜下(×400)观察凋亡细胞(以胞核出现棕黄染色颗粒代表),计算TUNEL阳性率,即TUNEL阳性细胞数占总细胞数的比值并采图。1.5统计方法应用SPSS17.0软件进行统计分析。计量资料采用均数±标准差表示,两组间均数比较采用独立样本检验。回归分析采用一元线性回归分析。P<0.05为差异有统计学意义。
2 结果
2.1 损伤灶周围脑组织中NF-KB蛋白表达的变化情况PGZ组1h时NF-KB在损伤灶周围组织细胞核中开始表达,1~12h阳性细胞比例逐渐增高,24 h时阳性细胞比率达到高峰,3~7 d阳性细胞比率有所下降,但处于高表达状态;与对照组比较,PGZ组各时间点均低于对照组,差异均有统计学意义(≥3.47 ,均P<0.05)。见表1及封三彩图1。
2.2 颅脑损伤后损伤灶周围脑组织中TNF-α蛋白表达的变化情况PGZ组在损伤后1h损伤灶周围组织中TNF-α开始表达,3 h大量表达;6~24 h处于高度表达状态,损伤后3 d TNF-α呈强表达,至7 d
TNF-α表达下降。与对照组比较,PGZ组各时间点阳性细胞率较低(≥4.27,均Ρ<0.05)。见表1及封三彩图2。
2.3 损伤灶周围脑组织中细胞凋亡变化情况TUNEL染色后细胞核呈棕褐色提示为凋亡细胞,PGZ组1 h损伤灶周围开始出现凋亡细胞,3~24h随时间递增,凋亡细胞数逐渐增多,3 d达到高峰,7 d凋亡细胞有所减少,与对照组变化规律一致,但各时间凋亡细胞数较对照组低,差异均有统计学意义(≥4.30,均<0.05)。见表1及封三彩图3。
2.4 NF-ΚB含量水平与TNF-α蛋白表达的回归方程
以NF-ΚB含量水平为自变量,用X表示。TNF-α含量水平为应变量,用Y表示。回归方程Y(PGZ组)=-0.432+0.271X,Υ2=0.947(Ρ<0.001);Y(对照组)=-4.168+0.748X,Υ2=0.961(Ρ<0.001)。
3 讨论
目前颅脑损伤的发病率呈持续升高的趋势[4],如何阻止颅脑损伤后继发性损伤的出现和发展,一直是众多科研工作者和临床医师研究的热点。国内外实验研究证实,颅脑损伤灶和周围组织存在炎性反应,是继发性脑损伤的重要环节[5-7],其中TNF-α被认为是脑损伤后最早出现的细胞因子,且是一种多效性促炎性细胞因子,可由小胶质细胞、星形细胞、神经细胞和血管内皮细胞产生,在触发炎性反应及神经损伤过程中处于中心地位[8]。因此,如何降低炎症因子的表达,从而减少神经细胞的凋亡,保护受损细胞,是目前治疗颅脑损伤后继发性损伤的一大靶点。
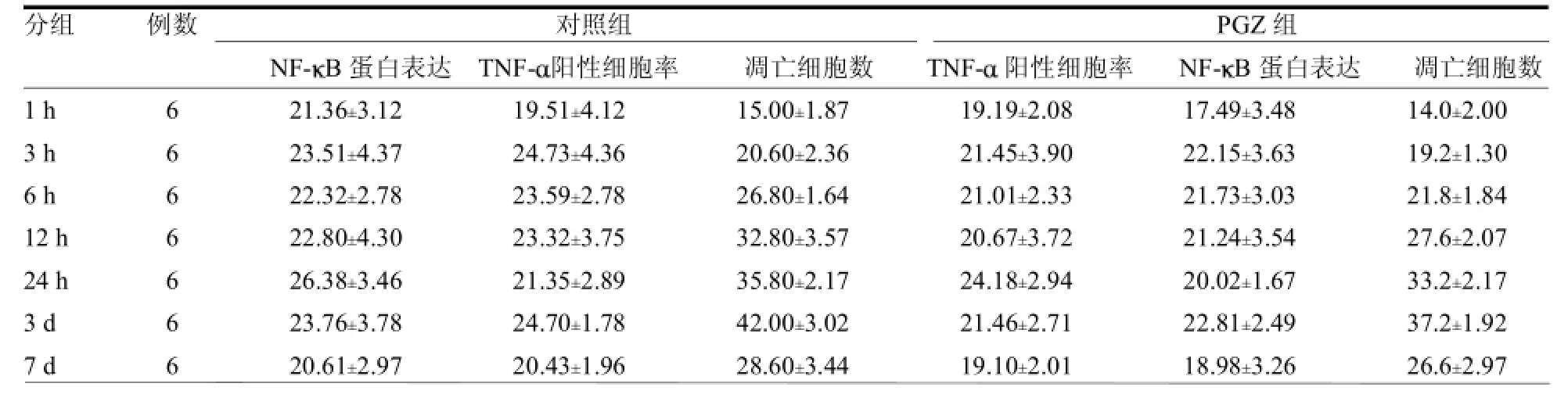
表1 PGZ组与对照组TNF-阳性细胞率、NF-B蛋白表达及细胞凋亡情况比较%
有研究发现,PPARΥ激动剂能活化细胞外信号调节激酶而抑制NF-ΚB的激活[9]。PGZ作为PPARΥ特异性激动剂,目前在临床主要用于治疗II型糖尿病。国内有研究报道,PGZ促进PPARΥmRNA和蛋白的表达,增强其对损伤的神经细胞具有保护作用,并且与剂量成正比[10]。本研究发现颅脑损伤后予以PGZ组干预后TNF-α水平较对照组明显下降,提示PGZ组干预后可一定程度抑制TNF-α的表达,减轻炎症反应。
此外,细胞凋亡是细胞在体内外多种因素刺激诱导下,由多种基因调控的主动死亡过程。有研究人员证实,颅脑损伤后细胞凋亡广泛存在并参与了继发性脑损伤的发展过程[11]。本实验采用T'UNEL技术检测了神经细胞的凋亡情况,结果发现发现经PGZ预处理后的大鼠细胞凋亡较对照组明显改善,NF-ΚB和TNF-α的含量水平显著降低且二者含量水平成显著正相关,颅脑损伤后损伤灶周围脑组织中神经细胞凋亡数量明显减少(Ρ<0.05)。由此笔者认为PGZ可通过降低诱发NF-kB的释放能力,进而减少促炎介质的含量水平,从而发挥减少细胞凋亡的作用。
综上所述,PGZ可通过激活PPARΥ负性调节脑组织中NF-ΚB的含量水平,进一步减少TNF-α的释放,减轻了大鼠颅脑损伤后继发性脑损伤,从而很好的减少细胞凋亡,为该药在颅脑损伤的治疗提供更为广阔的前景。
[1]Sundararajan JL,Gamboa NA,Victor EW,etal.Peroxisome proliferator-activated receptor-ligands reduce inflammation and infarction size in transient ischem ia[J].Neuroscience,2005,130(3): 685-696.
[2]霍永强,谭源福.一种改进的落体脑创伤模型[J].广西医科大学学报,2007,24(2):217-219.
[3]KilbourneM,Kuehn R,Tosun C,etal.Novelmodel of frontal impact closed head injury in the rat[J].JNeurotrauma,2009,26(12): 2233-2243.
[4]Park E,Bell JD,Baker AJ.Traumatic brain injury:can the conse quences be stopped[J].CMAJ,2008,178(9):1163-1170.
[5]Shojo H,Kaneko Y,M abuchi T,et al.Genetic and histologic evidence implicates roleof inflammation in traumatic brain injury-induced apoptosis in the ratcerebral cortex follow ingmoderate fluid percussion injury[J].Neuroscience,2010,171(4):1273-1282.
[6]Ramlackhansingh AF,Brooks DJ,Greenwood RJ,etal.Inflammation after trauma:microglialactivation and traumatic brain injury[J]. Ann Neurol,2011,70(3):374-383.
[7]Cederberg D,Siesjo P.W hathas inflammation to dowith traumatic brain injury[J].ChildsNerv Syst,2010,26(2):221-226.
[8]Chen J,Wu X,Shao B,etal.Increased expression of TNF receptorassociated factor6after rattraumaticbrain injury[J].CellMolNeurobiol,2011,31(2):269-275.
[9]Chen F,Wang MO,Connor JP,etal.Phosphorylation of PPARgammaviaactive ERKI/2 leads to itsphysicalassociationwith P65 and inhibitionofNF-kappabeta[J].JCellBioehem,2003,90(4):732-744.
[10]刘尊敬,杨期东,刘运海,等.脑梗死患者周围学淋巴细胞PPAR mRNA动态变化[J].中风与神经疾病杂志,2004,21(6):521-522.
[11]Villa P,BiginiP,MenniniT,etal.Erythropoietin selectively attenuates cytokine production and inflammation in cerebral ischem ia by targeting neuronalapoptosis[J].JExp Med,2003,198(6):971-975.
Influenceof pioglitazoneon tissuenuclear transcription factor,tumornecrosis factor-and cellapoptosisafter traumatic brain injury in rats
Objective To investigate the changes of tissue nuclear transcription factor (NF-KB), tumor necrosis factor-(TNF- ) and cell apoptosis after traumatic brain injury and the influence of pioglitazone on these para-meters in rats. MethodsEighty-four male SD rats were randomly divided into two groups randomly: pioglitazone group ( n=42) and the controlgroup ( n=42).The pioglitazone group were induced by improved Feeney method and were received abdominal injectionsof pioglitazone (10 mg/kg) immediately after injury, and the control group were received abdominal injections of sodiumchloride injection (2 ml/kg) immediately after injury and one time everyday until the rats was killed. Each group wasdivided into seven subgroups by sacrificed time after injury, 1 h, 3 h, 6 h, 12 h, 24 h, 3 d, and 7 d group, each subgroup gotsix rats. Each subgroup were randomly selected three rats after being killed, detected the expression of NF- B and TNF of tissues around contusion by immunohistochemical methods, while TUNEL method was used to observe the cell apoptosisafter brain contusion.Results The expressions of NF- B and TNF- in each pioglitazone group were significantly decreased compared with the control group ( P< 0.05), and they showed significant positive correlations in both groups ( P<0.01). At the same time, the number of apoptotic cells was decreasing ( P< 0.05).Conclusions Pioglitazone can protect of neurocytes through the route of relieving inflammation response, reducing the change of secondary brain injury after traumaticbrain injury and decreasing neural cell apoptosis.
Pioglitazone;TraumaticBrain Injury;Nucleartranscription factor;Tumornecrosisfactor-;Cellapoptosis
10.3969/j.issn.1671-0800.2014.06.004
R741
A
1671-0800(2014)06-0656-03
浙江省温岭市科技局基金资助项目(2011W LCB0093)
317500 浙江省温岭,温岭市第一人民医院
杨帆,Email:yangfan5091448@163.com
