马铃薯青枯病病原的鉴定
2014-02-10郑雪坳宋波涛谭晓丹陈惠兰
郑雪坳,宋波涛,谭晓丹,陈惠兰
(华中农业大学园艺林学学院/华中农业大学园艺植物生物学教育部重点实验室/
国家蔬菜改良中心华中分中心,湖北武汉430070)
病虫防治
马铃薯青枯病病原的鉴定
郑雪坳,宋波涛,谭晓丹,陈惠兰*
(华中农业大学园艺林学学院/华中农业大学园艺植物生物学教育部重点实验室/
国家蔬菜改良中心华中分中心,湖北武汉430070)
利用湖北省四个地点的马铃薯青枯病样本,对其病原物的菌落形态、碳水化合物利用、显微形态、鞭毛引物序列、演化型以及致病力等方面进行了分析。结果显示,在2,3,5-氯化三苯基四氮唑培养基上检测得到16个病原物菌落符合青枯菌菌落形态特征,包括菌落圆形,隆起,中间红色,乳白色分泌物,并伴有褐色物质;显微观察16个病原物中仅有6个病原物具有短杆状、两端钝圆的特点;而其中能够通过PCR扩增得到鞭毛序列的病原物仅有源自武汉的HZ4-14和HZ5-1,序列比对发现两者序列一致且与GMI1000等已测序青枯菌株同源性达到99%;演化型测定结果显示HZ4-14和HZ5-1均能得到144 bp的目标条带,为演化II型;利用四种不同马铃薯材料试管苗伤根接种鉴定结果显示两个菌株均具有一定致病力。结果表明,引起湖北省武汉市青枯病的病原物为雷尔氏青枯菌Ralstonia solanacearum,生理小种2号,演化II型(美洲组)。
马铃薯;青枯菌;病原鉴定
马铃薯(Solanum tuberosum L.)是世界第四大粮食作物,在保障粮食安全发展方面具有不可替代的作用[1]。2012年,中国马铃薯种植面积521万hm2,总产量8 154万t,单产15.7 t∕hm2;种植面积占世界马铃薯种植面积的1∕4[2]。而青枯病是由茄科雷尔氏细菌(Ralstonia solanacearum)引起的一种常见、易发和传播迅速的土传病害,在世界范围内广泛存在[3],该细菌寄主广泛,可侵染54个科的450种植物[4]。随着中国南方冬作区和西南混作区马铃薯种植面积的进一步扩大,青枯病有进一步扩大的趋势。近年来随着农业产业结构的调整,湖北省低山平原马铃薯种植有了较大的发展,青枯病也在这个过程中迅速蔓延,但目前青枯病病原菌分布尚不十分明确,因此,进行湖北省的青枯病调查与鉴定对马铃薯生产及抗病防治具有重要的指导意义。
此外,青枯病茄科雷尔氏菌是一个复杂而多变的细菌[5],传统的青枯菌鉴定方法是通过使用2,3, 5-氯化三苯基四氮唑(TTC)的青枯菌培养基进行菌落挑选,并依据它们对6种碳水化合物(甘露醇、山梨醇、卫矛醇、乳糖、麦芽糖、纤维二糖)的利用能力不同分为5个生化变种[6]。此后,随着检测技术的发展,酶联免疫吸附测定(ELISA)和免疫荧光抗体染色(IF)等基于抗原抗体反应的青枯病菌的鉴定技术陆续发展起来。近年来,随着核酸检测技术的不断发展与完善,基于PCR的各种分子检测方法也逐渐建立起来[7]。因此,本研究拟利用传统菌落显色、生化小种鉴定、PCR检测等技术对湖北省马铃薯青枯病进行了分离与调查,并利用不同抗性的马铃薯材料对分离物的致病能力进行了测定,为湖北省马铃薯青枯病的防治与研究提供基础数据。
1 材料与方法
1.1 材料
病原菌:马铃薯发病植株、块茎及土壤等病原物样品分别取自湖北省武汉市、长阳土家族苗族自治县、随州市和恩施市4个马铃薯生产试验田。对照细菌茄科雷尔氏菌HA4-1(演化型I)和G1(演化型I)分别由中国农业科学院油料作物研究所晏立英老师及山东省农业科学院李广存老师惠赠。
植物材料:二倍体野生种马铃薯S.chacoense 9701由本实验室保存,二倍体栽培种马铃薯S. tuberosum 10908-05由加拿大农业及农业食品部惠赠,二倍体野生种马铃薯S.chacoense 40-3(PI320285)和已测序品系二倍体原始栽培种S. phureja DM1-3均来自美国马铃薯种质资源库NPSP-6。
1.2 马铃薯病原物分离及BGT培养基的观察
病原物自植株及薯块的分离方法:将病样植株和薯块的表面清洗完后,用75%酒精的进行消毒,如从疑似感病的植株茎部分离,则将茎部距根部的1∕3处剪断,然后插入灭菌水中,静置3~5 min,如果症状明显,可以看到有白色的菌脓流出;而从疑似感病的薯块分离时,则可将薯块切开,直接浸入无菌水中,浸泡2 h后的菌液备用;而从土壤中分离时,则直接将无菌水按10∶1加入土壤中,搅拌均匀后,沉淀2 h后备用。
将菌液梯度稀释后,涂布于BGT平板(蛋白胨10 g∕L,葡萄糖2.5 g∕L,酸水解酪蛋白1 g∕L,琼脂粉15 g∕L,2,3,5-氯化三苯基四氮唑0.05 g∕L)上,28℃培养36 h,观察其形态特征[8]。
1.3 病原菌生化小种的鉴定及显微观察
生化小种鉴定:配制青枯菌生化小种鉴定培养基(磷酸二氢铵1 g∕L,七水硫酸镁0.2 g∕L,氯化钾0.2 g∕L,蛋白胨1.0 g∕L,溴百里香酚蓝0.03 g∕L,琼脂3.0 g∕L),调节pH值至7.0~7.1,121℃高温灭菌20 min备用。在培养基凝固前,分别加入过滤灭菌的碳源甘露醇、山梨醇、卫矛醇、乳糖、麦芽糖或纤维二糖,使其浓度达到10%,同时以无菌水为空白对照(CK),每个碳源设置3次重复。试验时每管接入浓度为108cfu∕mL的菌液100 μL,置于28℃恒温培养箱中培养。生化变种的分类是根据菌株对3种双糖和3种己醇的氧化利用情况划分为四种生化型或变种,即不能氧化3种双糖和3种己醇的为生化变种1号;只能氧化3种双糖、不能氧化3种已醇的为生化变种2号;能氧化3种双糖和3种己醇的为生化变种3号;只能氧化3种己醇、不能氧化3种双糖的为生化变种4号[6]。
显微观察:将细菌划线于BG培养基上,24 h后用无菌水清洗,制备悬浮液,将悬浮液染色后置于100倍显微镜下,观察其形态特征。
1.4 病原菌的PCR鉴定及演化型鉴定
青枯菌特异性鞭毛基因的扩增:BG平板培养24h后挑选单个克隆作为DNA模板。使用Schönfeld等[9]报道的鞭毛基因特异引物进行PCR扩增,其引物序列如下:Rsol-fliC-for:GAACGCCAACGGTG CGAACT;Rsol-fliC-rev:GGCGGCCTTCAGGGAGGTC。PCR反应体系:扩增反应采用20 μL体系(Taq酶1U,MgCl22.0 mmol∕L,dNTPs 0.15 mmol∕L,引物0.4 μmol∕L)。
青枯菌演化型的鉴定:参照Fegan等[10]的方法测定5种细菌的演化型,所用PCR引物有Nmult:21:1F(CGTTGATGAGGCGCGCAATT演化型I);Nmult:21: 2F(AAGTTATGGACGGTGGAAGTC演化型II);Nmult: 23:AF(ATTACCAGAGCAA TCGAAAGATT演化型IV);
Nmult:22:InF(ATTGCCAAGACGAGAGAAGTA演化型III);
Nmult:22:RR(TCGCTTGACCCTATAACGAGTA)。试验所用引物均由上海生物工程有限公司合成。PCR反应体系:25 μL反应体系(Taq酶2 U,MgCl22.0 mmol∕L,dNTPs 0.2 mmol∕L,引物Nmult:21:1F,Nmult:21:2F和Nmult:22:InF各6 pmol∕L,Nmult:23:AF和Nmult:22: RR各1.8 μmol∕L)。
两个反应程序仅在退火温度略不同,预变性95℃3 min,变性94℃30 s,退火分别为55℃和59℃30 s,延伸72℃30 s,30个循环;72℃延伸10 min。扩增后的PCR产物于2.0%的琼脂糖凝胶中电泳,通过海尔凝胶成像仪观察结果。
1.5 目标序列测序及比对
用琼脂糖凝胶电泳分离以上扩增的基因或DNA片段,使用TaKaRa DNA gel回收试剂盒回收目标片段,送武汉Sunny测序公司进行测序,并将获得的序列进行网上BLAST比对分析(www.ncbi. nlm.nih.gov)。
1.6 不同病原菌的致病力检测及比较
致病力检测采用试管苗接种法,使用HZ4-14、HZ5-1、G1、HA4-1四种细菌,选用40-3、DM1-3、9701、10908-05四种马铃薯材料。采用正交试验设计,每种细菌每份材料12株重复,待植株生长3周后,使用手术刀于无菌环境下伤根,每盒材料加入5 mL的108cfu∕mL菌液,在接种后第9 d统计发病指数,发病等级分为0到4等级(0级无感病症状、1级少于或等于25%植株部分萎蔫,2级25%~50%植株部分萎蔫,3级50%~75%部分植株萎蔫,4级大于75%部分植株萎蔫或植株死亡)。
2 结果与分析
2.1 病原菌BGT培养基的形态观察及生化小种的鉴定
为了验证湖北省马铃薯青枯病的分布情况,研究者对湖北省武汉、长阳、随州、恩施等地的疑似病株、块茎和土壤等进行了取样。通过BGT培养基分离得到了78个疑似分离物,并从中挑选了16个中间红色具有不同形态的分离物(图1),以G1和HA4-1为对照,再划BGT培养基平板,观察不同分离物菌落形态的差异。结果表明,16个分离物中(表1),HZ1-8等10个分离物的菌落与对照细菌相似,表现为淡红色,而H1-2等6个菌落中心呈现为深红色;从周围白色分泌物的有无来看,对照菌株HA4-1的菌落中央及周边有大量的白色分泌物,而对照菌株G1仅有少量白色分泌物,而分离物中有9个能够看到分泌白色物质;此外,从褐色物质产生来看,有5个分离物与HA4-1相似,在菌落周围有褐色物质产生,而另外11个分离物则与G1相似,没有观察到褐色物质。
2.2 病原菌在显微镜下的形态观察
为了进一步明确这些分离物的特征,以G1和HA4-1两个菌株为对照,在100倍显微镜下对分离物的形态进行了观察,结果表明,HZ4-14,HZ5-1等6个菌与G1和HA4-1的形态相对一致,均为杆状细菌,两头钝圆,而HZ3-17等10个分离物的形状为球状(图2)。而青枯菌为革兰氏阴性菌,属于变形菌门中的β变形菌纲薄壁菌目假单胞菌科茄科雷尔氏属,菌体应为两端钝圆的短杆状,尽管HZ3-17等分离物虽然能在传统分类的BGT培养基以及生化变种的鉴定的实验中得到与阳性对照一致性的结果,但它们并非青枯菌。
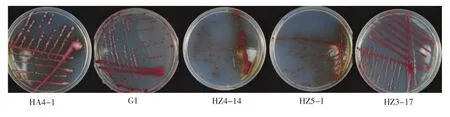
图1 青枯菌在培养基上的形态学观察Figure 1Morphology observation ofR.solanacearumon BGT plating
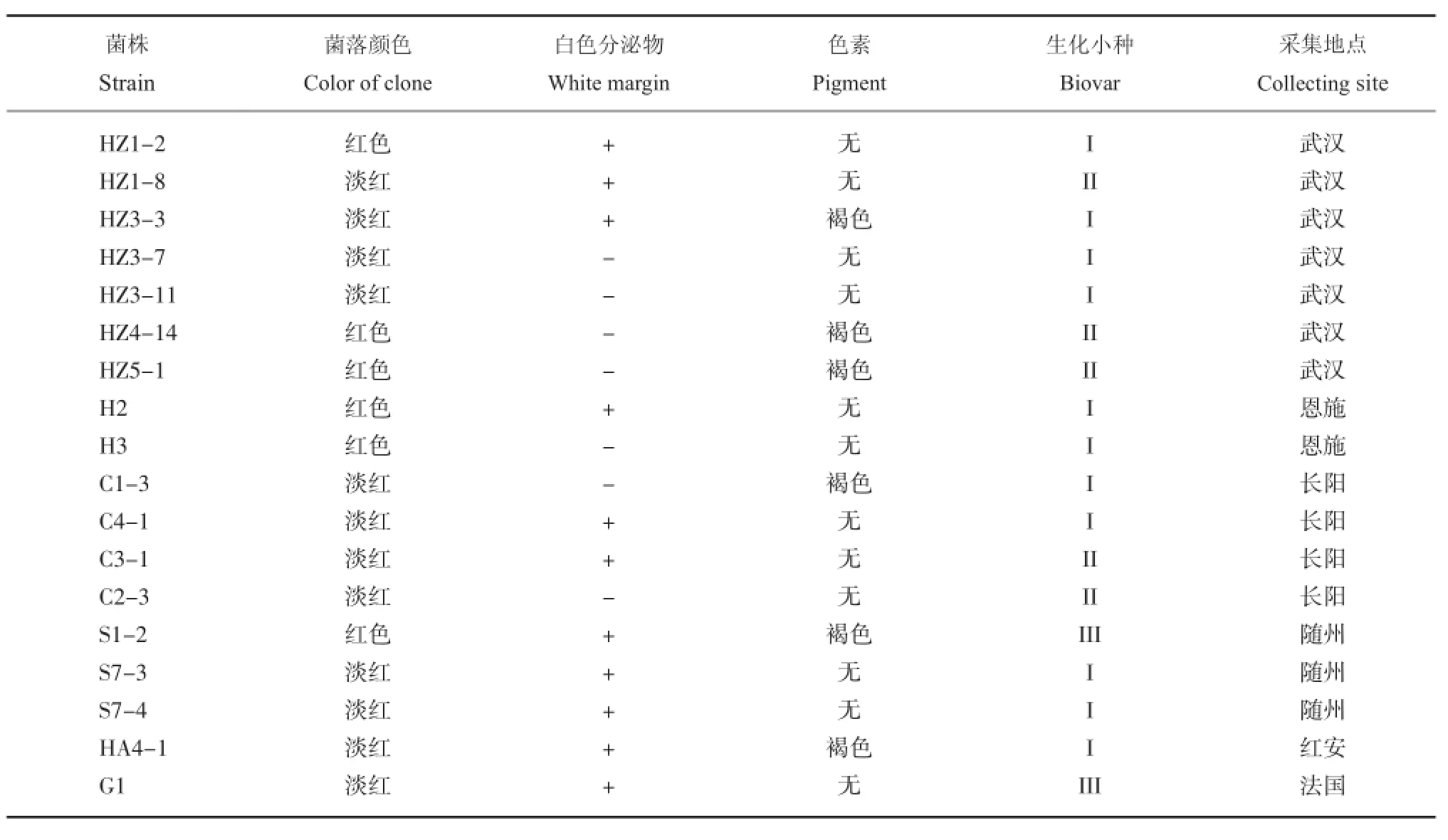
表1 BGT培养基形态学特征及生化小种鉴定Table 1Morphology ofR.solanacearumon BGT plating and biovar identification
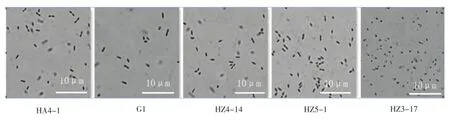
图2 青枯菌在显微镜下的形态学特征Figure 2Morphology ofR.solanacearumby microscope
2.3 PCR检测与序列比对
为准确地鉴定马铃薯青枯病原菌,选取了鞭毛基因特异引物进行了16个分离物的PCR扩增,结果表明,仅有HZ4-14、HZ5-1、G1和HA4-1 4个菌株扩增得到了相应大小的目标条带,其他菌株均没有得到目标条带(图3),由此说明研究者仅从武汉取样点分离到了茄科雷尔氏菌。
为了保证扩增序列的种间特异性与种内保守性,研究者对鞭毛基因特异引物扩增序列进行了测序验证。对HZ4-14、HZ5-1的测序结果显示,HZ4-14及HZ5-1序列同源性为100%,表明这两种细菌可能是同一个细菌不同克隆。同时选取了9个已测序菌株及分离获得的菌株的鞭毛基因序列进行比对分析,结果表明,HZ4-14、HZ5-1的鞭毛基因序列与9个测序菌株的相应基因的同源性均在99%以上(图4);而进一步利用NCBI数据库blast结果显示,R.picketti,R.mannitolytica等近缘种的序列相似性均低于95%,这表示雷尔氏菌的鞭毛序列在种内高度保守性,且具有一定的种间特异性。
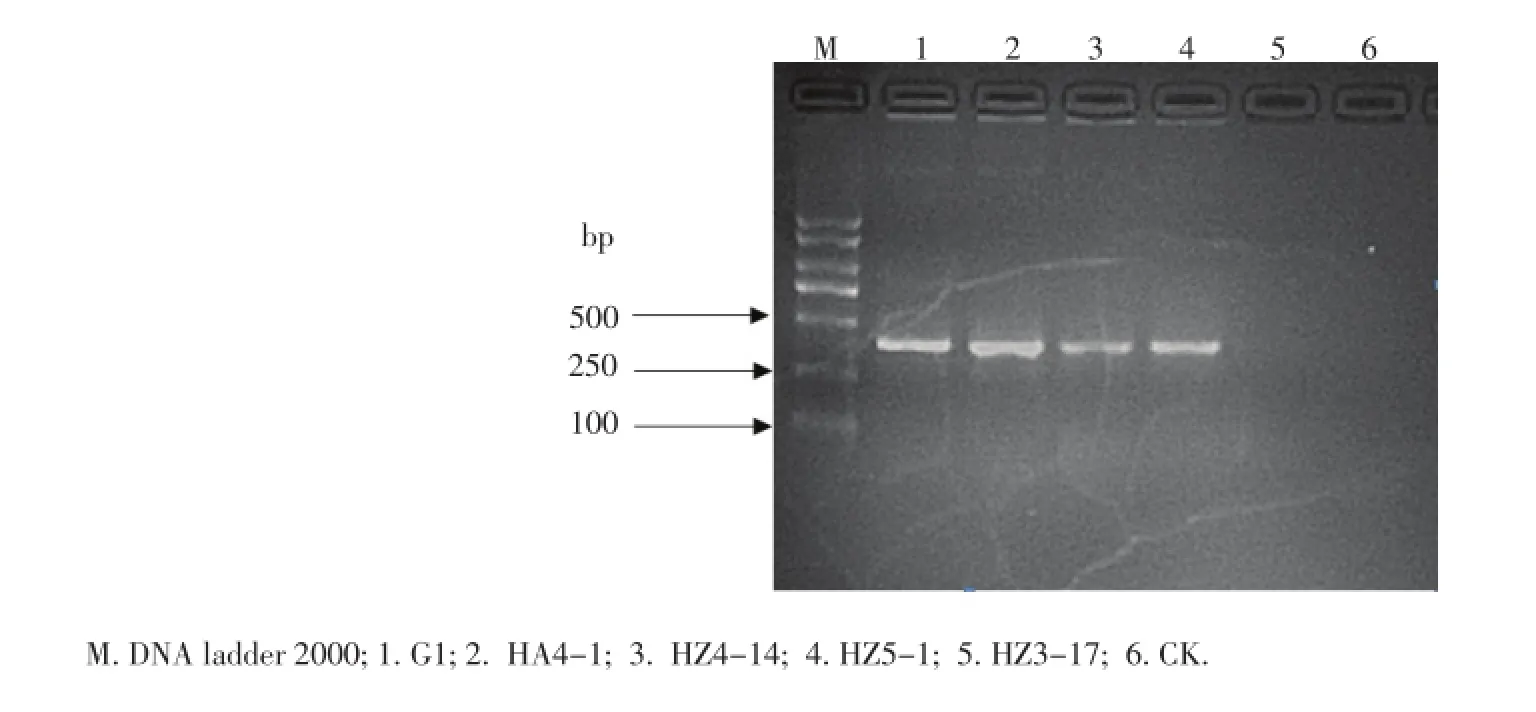
图3 青枯菌分离物的PCR扩增Figure 3PCR amplification ofR.solanacearum

图4 不同青枯菌的FliC序列比较Figure 4Comparison of FliC sequences of differentR.solanacearumstrains
2.4 HZ5-1、HZ4-14的演化型鉴定
演化型测定结果显示HZ5-1、HZ4-14演化型序列扩增均得到280 bp的条带,G1、HA4-1则得到了144 bp的条带(图5),根据Prior和Fegan的划分标准,HZ5-1、HZ4-14为演化型II(美洲组),G1、HA4-1为演化型I(亚洲型),因此,导致武汉市马铃薯青枯病的病原菌可能大部分为演化型II,即美洲组。
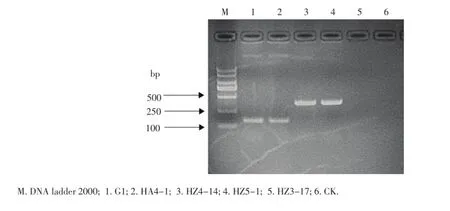
图5 多重PCR鉴定青枯菌的演化型Figure 5Phylotype of R.solanacearum identified by multiplex-PCR
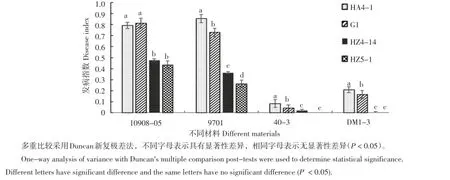
图6 不同马铃薯不同菌株的病情指数比较Figure 6Comparison of disease index of different potatoes inoculated with differentR.solanacearum
2.5 不同病原菌致病力检测及比较
为了研究分离的病原菌的致病力,本研究利用DM1-3、40-3等对青枯病具有不同抗性的材料对不同病原菌致病力进行了检测,结果表明,整体上看HZ4-14、HZ5-1致病力显著弱于HA4-1、G1,而且除了在9701的材料外,HZ4-14和HZ5-1之间的致病力上均无显著性差异。而就材料抗性而言,以DM1-3和40-3的抗性相对较强(图6)。
3 讨论
本研究通过对湖北省4个点的马铃薯病样进行了青枯菌的分离、生化变种鉴定、显微观察、PCR检测、测序比对以及致病性检测,在武汉点分离得到了2个分离物HZ4-14和HZ5-1为薄壁菌门雷尔氏菌属茄科雷尔氏菌,属生化变种II,演化型II(美洲组)。同时对比HZ4-14和HZ5-1,它们虽来自不同的取样点,但其生化变种及演化型相同,同时序列比对结果也显示出其鞭毛序列同源性为100%,因此,推测两种细菌可能为相同菌株,可能为湖北省武汉点的优势菌株。已有的研究表明,中国的青枯菌群体具有非常丰富的遗传多样性[11],而研究者从其他采样点采集到的疑似感病植株中并未分离得到阳性分离物,其中原因仍有待研究。
传统的青枯菌分离方法依据BGT培养基进行分离,并根据6种化合物的利用能力进行生化小种的划分。而本研究使用BGT培养基观察发现78个病原物中仅有16个病原物具有青枯菌菌落形态特征,这16种病原物均能对6种碳水化合物有不同程度的利用,而显微观察发现这其中仅有6个呈现短杆状,两端钝圆的特征,而其中通过PCR鉴定的仅有2个病原物,这说明传统的分离鉴定方法在准确性方面仍旧需要改进。随着生物技术的发展,各种各样的检测方法竞相报道,而其中PCR检测方法又以灵敏、快速、低成本而被广泛接受,但目前青枯菌PCR鉴定方法主要采用的具有高度保守型的16S及23S rDNA,其中16S的rDNA的部分种间的特异性较差,很难区分开R.picketti等菌株[8],因此目标序列的种间特异性及种内保守性是PCR鉴定的关键问题。目前已有13株不同的青枯菌已完成了测序[12],研究者可以通过生物信息学的方法进一步优化PCR鉴定体系,兼顾目标序列的种间特异性及种内保守性。因此,将传统鉴定方法与分子生物学及生物信息学方法结合将更加全面、准确地鉴定出青枯病病原菌。
从致病力的角度看,源于花生的HA4-1青枯菌(演化型I)和番茄的G1(演化性I)的致病力显著强于本研究中从马铃薯上分离到的HZ4-14(演化型II)和HZ5-1(演化型II),已有部分研究报道青枯菌在非寄主植物比寄主植物具有更强的致病力,例如源于香蕉的青枯菌RUN292比源于马铃薯青枯菌Po82在马铃薯上具有更强的致病力[13]。除此之外,造成该情况的原因还有可能与不同的接种方法和接种条件相关。本文采用了试管苗伤根接种法,此方法具有快速、方便、简洁的特点,但由于培养基生长环境的单一性及试管苗的苗龄短的特点,该方法与田间接种具有一定的差异。在接种温度条件方面,青枯菌一般适宜的发病温度为28~35℃,而前人的研究表明,一些马铃薯的青枯菌在最适宜生长的温度18~22℃情况下发病更为严重[14],而本研究采用了26℃作为发病温度,该温度超过低温响应的青枯菌发病温度,因此本研究所分离的青枯菌HZ4-14、HZ5-1的最适发病温度仍需进一步的研究。
[1]谢从华.马铃薯产业的现状与发展[J].华中农业大学学报:社会科学版,2012(1):1-4.
[2]中国食品安全报综合报道.凝聚共识推进马铃薯全产业链科学发展[EB∕OL].(2013-08-22)[2014-03-18].http:∕∕www.cfsn. cn∕industry∕2013-08∕22∕content_146990.htm.
[3]Wicker E,Grassart L,Coranson-Beaudu R,et al.Ralstonia solanacearum strains from Martinique(French West Indies) exhibiting a new pathogenic potential[J].Applied and environmental microbiology,2007,73(21):6790-6801.
[4]Genin S,Boucher C.Lessons learned from the genome analysis of Ralstonia solanacearum[J].Annu Rev Phytopathol,2004,42: 107-134.
[5]Hayward A C.Biology and epidemiology of bacterial wilt caused by Pseudomonas solanacearum[J].Annual Review of Phytopathology, 1991,29(1):65-87.
[6]Hayward A C.Characteristics of Pseudomonas solanacearum[J]. Journal of Applied Microbiology,1964,27(2):265-277.
[7]陈永芳,何礼远,徐进.马铃薯青枯病的PCR检测[J].植物保护学报,2005,32(2):129-130.
[8]Boucher C A,Barberis P A,Demery D A.Transposon mutagenesis of Pseudomonas solanacearum:isolation of Tn5-induced avirulent mutants[J].Journal of general Microbiology,1985,131(9): 2449-2457.
[9]Schönfeld J,Heuer H,Van Elsas J D,et al.Specific and sensitive detection of Ralstonia solanacearum in soil on the basis of PCR amplification of fliC fragments[J].Applied and environmental microbiology,2003,69(12):7248-7256.
[10]Fegan M,Prior P,Allen C,et al.How complex is the"Ralstonia solanacearum species complex"?[M].Bacterial wilt disease and the Ralstonia solanacearum species complex,2005:449-461.
[11]徐进,冯洁.植物青枯菌遗传多样性及致病基因组学研究进展[J].中国农业科学,2013,14:2902-2909.
[12]Peeters N,Guidot A,Vailleau F,et al.Ralstonia solanacearum,a widespread bacterial plant pathogen in the post-genomic era[J]. Molecular Plant Pathology,2013,14(7):651-662.
[13]潘哲超.植物青枯菌遗传多样性及致病力分化研究[D].北京:中国农业科学院,2010.
[14]Carmeille A,Caranta C,Dintinger J,et al.Identification of QTLs for Ralstonia solanacearum race 3-phylotype II resistance in tomato[J].Theoretical and Applied Genetics,2006,113(1): 110-121.
Identification of Potato Bacterial Wilt Pathogens
ZHENG Xueao,SONG Botao,TAN Xiaodan,CHEN Huilan*
(College of Horticulture and Forestry Sciences/Key Laboratory of Horticultural Plant Biology(HAU),Ministry of Education/National
Center for Vegetable Improvement(Central China),Huazhong Agricultural University,Wuhan,Hubei 430070,China)
The colony morphology,carbohydrate utilization,microscopy,fliC sequence,phylotype and pathogenicity of RalstoniasolanacearumwerestudiedbyusingthediseasedpotatofromfourcitiesofHubeiProvinceinordertoinvestigatethe etiology of the disease bacterial wilt.Sixteen strains exhibited irregular round,upheaval,pink colonies with white margin differentially on BG medium with 2,3,5-triphenyl tetrazolium chloride.Six strains of them showed the targeted morphology of R.solanacearum by microscope.Only two strains had targeted fragments,which were amplified by the specific fliC primers. The targeted fragments were sequenced.The results revealed that HZ4-14 and HZ5-1 had 99%nucleotide matching with the fliC gene of R.solanacearum GMI1000.The results of phylotype multiple PCR indicated that the specific 144 bp fragments were amplified from two strains.HZ4-14 and HZ5-1 were virulent to potato and showed the typical bacterial wilt symptom. TheseresultsdemonstratethatthepathogenofbacterialwiltinWuhanbelongs toBivoarII,PhylotypeIIofR.solanacearum.
potato;Ralstonia solanacearum;identification
S532
A
1672-3635(2014)02-0083-07
2014-02-22
华中农业大学自主科技创新基金项目“转录组结合快速基因定位策略解析马铃薯青枯病抗性的调控网络”(2013PY080);新进高层次人才科研启动基金项目“马铃薯抗青枯病基因的定位和挖掘”(201209)。
郑雪坳(1989-),男,硕士研究生,研究方向为植物抗病生物学。
陈惠兰,教授,从事植物逆境生物学和遗传育种方面的研究,E-mail:chenhuilan@mail.hzau.edu.cn。
