有机反应中的亲核性和碱性
2014-01-26吕萍王彦广
吕萍 王彦广
(浙江大学化学系 浙江杭州 310027)
有机反应中的亲核性和碱性
吕萍 王彦广
(浙江大学化学系 浙江杭州 310027)
本文系统讨论了有机化学教学中经常遇到的亲核性与碱性关系的问题,并介绍了亲核性和碱性在预测有机反应区域选择性方面的应用。
亲核性 碱性 软硬酸碱理论 前线分子轨道理论 有机化学教学
亲核取代反应、亲核加成反应和碱催化的消除反应是基础有机化学教学的重要内容,因此,掌握试剂的亲核性和碱性规律对于学好有机化学至关重要。亲核试剂的亲核性在许多情况下与碱性的大小顺序一致,但在一些情况下却相反,这往往会给初学者带来很大困惑。为此,本文试图从碱和亲核试剂的定义出发,通过热力学和动力学概念阐述碱性和亲核性的本质区别,并通过实例介绍亲核性和碱性在预测有机反应选择性方面的应用。
1 基本概念
1.1 酸和碱
有关酸和碱的理论主要有两种,即Brønsted酸碱理论和Lewis酸碱理论[1]。按照Brønsted酸碱理论,酸是质子的给体,碱是质子的接受体;而按照Lewis酸碱理论,酸是电子对的接受体,碱是电子对的给体。与Brønsted酸碱相比,Lewis酸碱的范围更广,几乎所有离子型的有机反应均可以认为是Lewis酸碱的反应。例如,在烯烃的亲电加成中,烯烃在成键时给出电子,所以是Lewis碱,亲电试剂在成键时接受电子,因而属于Lewis酸;在羰基的亲核加成中,亲核试剂在成键时给出电子,属于Lewis碱,而羰基化合物在成键时接受电子,则是Lewis酸。
1.2 亲核试剂和亲电试剂
亲核试剂(nucleophile)指的是一个原子、离子或分子拥有电子对,具有富电子性,在与缺电性物种反应时,能提供电子对而成键;物种所拥有的这种性质称为亲核性(nucleophilicity)。亲电试剂(electrophile)指的是一个原子、离子或分子缺少电子对,具有缺电子性,在与富电性物种反应时,能够接受电子对而成键;物种所拥有的这种性质称为亲电性(electrophilicity)。由此看来,亲核试剂是Lewis碱,亲电试剂是Lewis酸。据此,人们就容易得出“碱性越强亲核性就越强”的结论。
1.3 亲核性和碱性的相对强弱
当一个富电性物种与质子反应时,会表现出碱性(basicity);而当这个富电性物种亲核进攻缺电性碳时,则会表现出亲核性。显然,试剂的亲核性和碱性是不同的,而且在反应中有竞争,竞争的结果直接导致了有机反应的化学选择性。例如,富电性物种试剂在与卤代烷发生反应时,如果它夺取碳正离子中间体β-碳上的质子,表现出碱性,生成消除产物(图1,途径a);如果它与碳正离子结合,则表现出亲核性,生成取代产物(图1,途径b)。我们可以用碱性较强但亲核性较弱的试剂来选择性地得到消除产物,亦可用亲核性较强但碱性较弱的试剂来选择性地得到取代产物。
如何评价碱性和亲核性的强弱?对碱(B)的碱性,常用其共轭酸(HB)的pKa值来评价其强弱。同一分子既可以是酸,也可以是碱。如水分子,它不仅能提供质子,还能接受质子。如果我们用水做标准来评价酸碱性,碱(B-)、水(H2O)、共轭酸(HB)和共轭碱(OH-)之间存在一定的平衡,由此平衡我们可
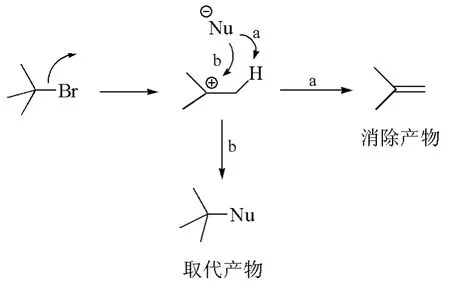
图1 消除反应与取代反应的竞争途径
以得出平衡常数Ka和pKa。Ka越大,pKa就越小,表明共轭酸(HB)的酸性越强,碱(B)的碱性越弱,如下所示:
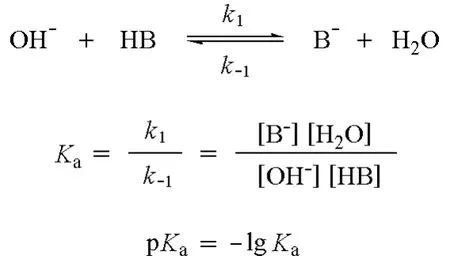
常见碱的pKa数据如表1所示。
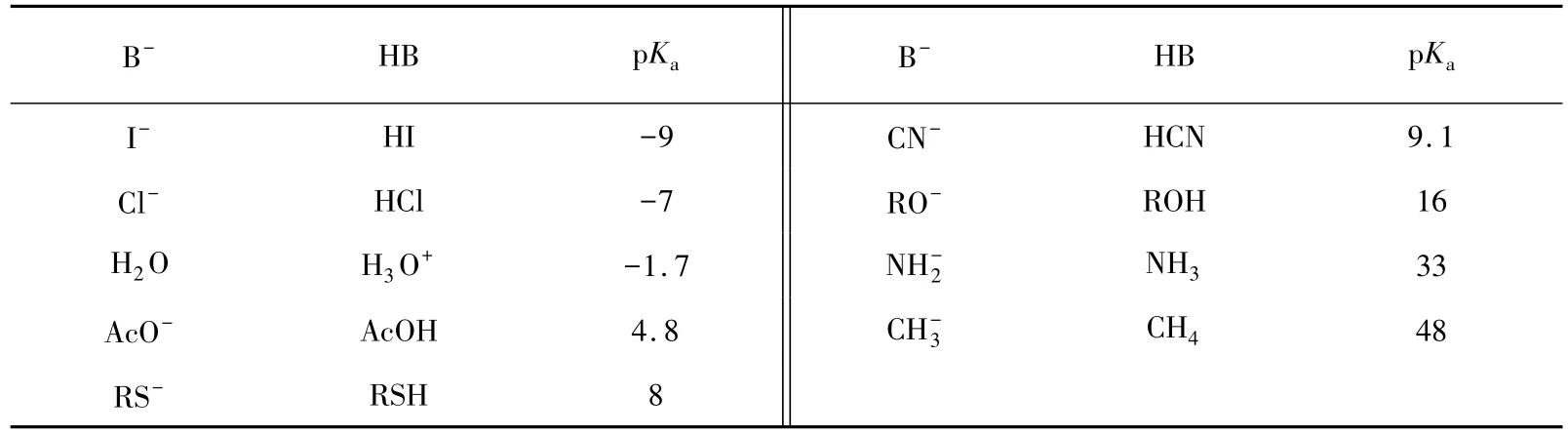
表1 一些碱的共轭酸的pKa数据
最早提出评价亲核性强弱是Swain和Scott[2],他们的理论基于溴甲烷在水中的亲核取代反应:

将溴甲烷在25℃条件下的水解看成一个标准反应,速度常数为k0,用s代表亲电物质对亲核试剂的敏感性(标准反应的s=1)。加入一定浓度不同的亲核试剂,卤代烃被亲核取代的速度常数为k,用n代表亲核性的强弱,也称亲核常数(标准反应的n=0)。由此,卤代烃与不同亲核试剂反应的线性自由能关系可以用Swain-Scott方程来表示:
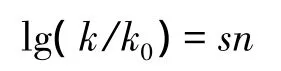
通过动力学跟踪和计算,固定底物,得出不同亲核试剂的亲核常数n,数值越大,亲核性越强,亲核取代反应的速度也就越快。固定亲核试剂,则可得出不同的卤代烃对亲核试剂的敏感性s,数值越大,对亲核试剂越敏感,亲核取代反应的速度也就越快(表2)。
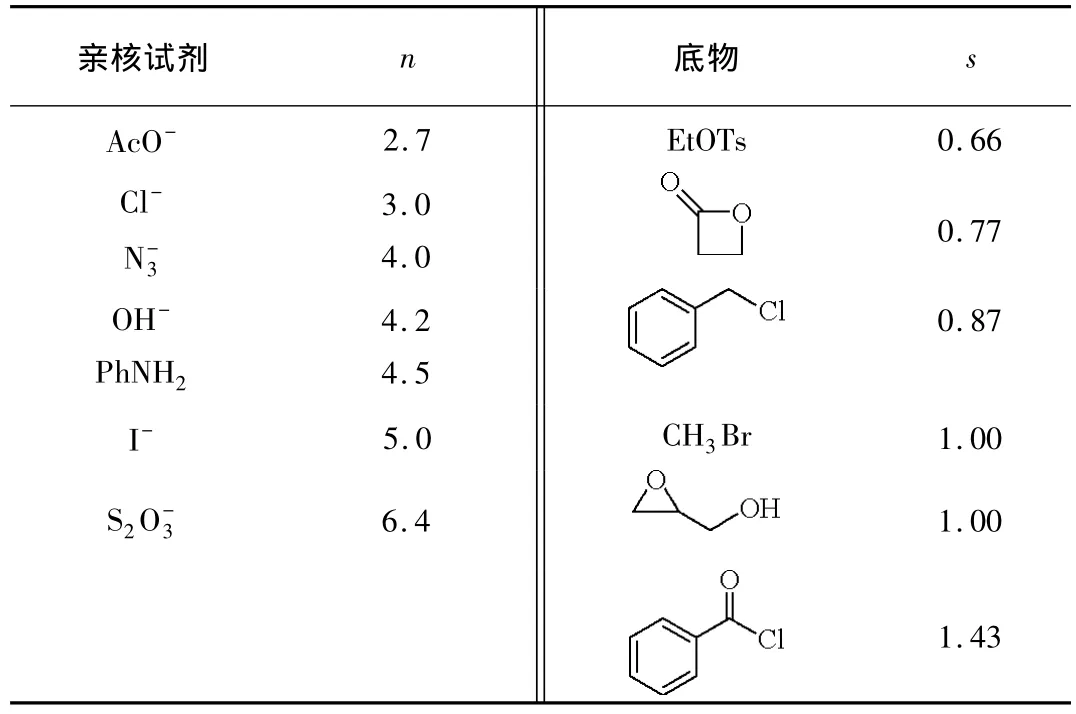
表2 Swain-Scott方程中的参数
评价亲核性强弱的方法还有很多,如Ritchie方程[3-4]、Edwards方程[5-6]、Mayr方程等[7-10]。总之,一个富电性物种的亲核性可以相对量化,选定一个亲核加成或亲核取代的模型,就可以对亲核性的强弱进行评价。一些常用亲核试剂的亲核性强弱顺序如下:
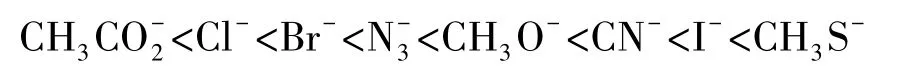
2 亲核性和碱性的关系
虽然碱和亲核试剂都是给出电子对成键,但二者有本质的区别。碱性是基于酸碱平衡的评价,与平衡常数有关;而亲核性是基于亲核试剂和亲电试剂反应性的评价,与反应速度有关。前者是热力学概念,后者则是动力学概念。从反应进程图中可以看出这一本质的不同(图2)。碱性描述的是碱夺得质子前后的相对稳定性(反应放出的热);亲核性描述的是亲核试剂和底物的作用能力(反应所需要克服的活化能)。
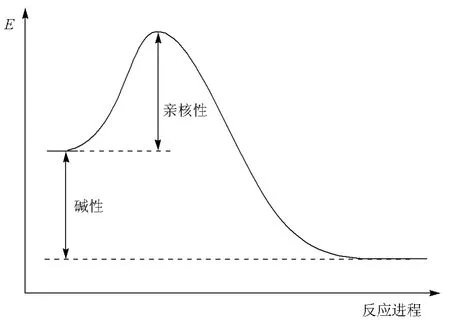
图2 反应进程中亲核性与碱性的关系
由此,我们不难理解为什么表1和表2中亲核性与碱性的次序不完全一致,如碘负离子的碱性比氯负离子弱,但它的亲核性比氯负离子强。大量研究表明,亲核性和碱性的强弱主要有以下规律[11]:
(1)对于亲核进攻元素是同一个元素来讲,负电性物种的亲核性大于中性物种的亲核性,如:OH->H2O,NH>NH3。
(2)对于亲核进攻元素是同一周期元素来讲,亲核性和碱性基本一致,如:CH3O->OH->PhO->CH3COO->TsO-;CH>NH>OH->F-。
(3)对于亲核进攻元素是同一族元素来讲,碱性由上到下依次减弱(即F->Cl->Br->I-),亲核性由上到下依次增强(即F-<Cl-<Br-<I-)。
(4)α-效应:当亲核原子的邻位有杂原子时,亲核性增强。例如,虽然OH-(共轭酸的pKa=15.7)的碱性比OOH-(共轭酸的pKa=11.6)大,但OH-的溶剂化作用比OOH-强,降低了其亲核能力,相应地,OOH-的亲核性强。同样,氨(共轭酸的pKa=9.3)的碱性比肼(共轭酸的pKa=8.0)大,但肼的亲核性比胺强。
(5)立体效应:如EtOH、i-PrOH和t-BuOH的pKa分别为16.0、17.1和19.2,它们共轭碱的碱性强弱为t-BuO->i-PrO->EtO-;但它们的亲核性受到空间位阻的影响,亲核性强弱为EtO->i-PrO->t-BuO-。有趣的是,1,8-双(二乙基氨基)-2,7-二甲氧基萘是一个很强的碱(其共轭酸的pKa为16.3),被称为“质子海绵”,但由于高位阻原因,其亲核性很弱。
在有机合成中,为了避免亲核取代或亲核加成负反应发生,常使用一些高位阻的碱来夺取质子,如2,6-二甲基吡啶、2,6-二叔丁基吡啶、二异丙基胺基锂(LDA)等。
(6)溶剂效应:当亲核试剂与溶剂之间发生作用,如图3所示,质子性溶剂甲醇将阴离子包络在中心,稳定阴离子,使阴离子失去亲核能力;极性非质子性溶剂二甲基亚砜(DMSO)将阳离子包络在中心,稳定阳离子,阴离子成裸露离子,从而提高了阴离子的亲核能力。
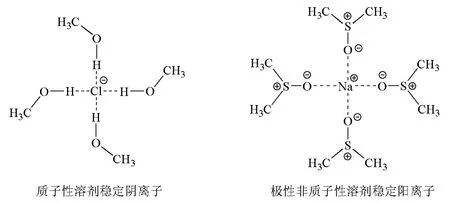
图3 氯离子和钠离子的溶剂化作用
在DMSO溶剂中,一些常见亲核试剂的亲核性强弱顺序如下:
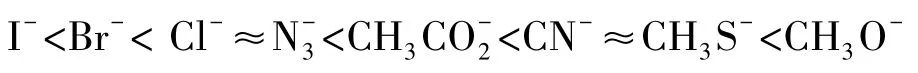
溶剂效应还能改变两可亲核试剂(ambident nucleophiles)反应的区域选择性。如图4所示,2-萘酚的钠盐与苄基溴反应时,在非质子极性溶剂DMF和DMSO中,钠离子的强溶剂化作用导致了氧原子的亲核性增强,从而取代反应主要生成氧烷基化产物(A)。在水或三氟乙醇等极性质子性溶剂中,由于酚氧负离子的溶剂化作用大大增强,其亲核性减弱,结果邻位碳原子亲核取代的产物(B)显著增加[12]。由此可见,可以通过选择合适的反应溶剂来调控两可亲核试剂反应的区域选择性。
必须指出的是,尽管亲核性是动力学概念,但一些两可亲核试剂反应的最终结果有时取决于产物的热力学稳定性。如图5所示,在1-巯基-8-辛胺与碘甲烷的反应中,巯基的亲核性比氨基强,易于进攻碘甲烷;但氨基的碱性比巯基强,而且C—N键比C—S键稳定,从而有利于生成热力学稳定的铵盐。在这个过程中,氨基最终被甲基化,而巯基相当于一个催化剂。
有些两可亲电试剂(ambident electrophiles)的反应性同样取决于产物的热力学稳定性。如图6所示,α,β-不饱和酮与CN-发生亲核加成时,在低温时主要生成动力学控制的1,2-加成产物,升高温度则有利于生成热力学控制的1,4-加成产物[13]。
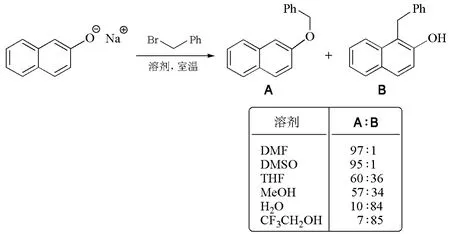
图4 溶剂效应对反应区域选择性的影响
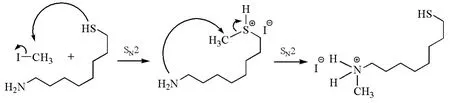
图5 热力学控制的硫醇胺的区域选择性亲核取代
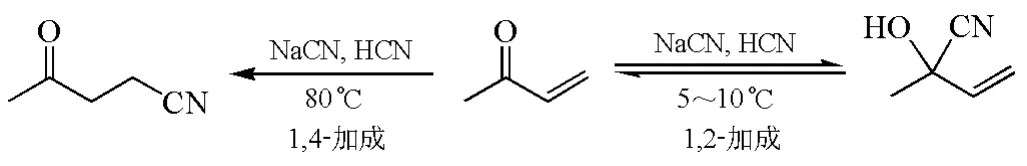
图6 热力学控制的α,β-不饱和酮的区域选择性亲核加成
3 亲核性的理论解释
不论是亲核取代还是亲核加成,对亲核性相对强弱的解释可以归纳为两种,一种是Klopman-Salem理论[14-16],另一种是软硬酸碱理论[17-21]。
3.1 Klopman-Salem理论
Klopman-Salem提出有机反应受3个因素制约[22]:闭壳层排斥力(the closed-shell repulsion)、库仑或静电相互作用力和电荷转移能力。闭壳层排斥力指的是分子或离子有很多填充在满轨道中的电子,这些电子之间的排斥导致分子或离子间的排斥,最终导致分子或离子的碰撞并不都是有效碰撞;只有当分子或离子有足够的能量克服反应的活化能,才是真正的有效碰撞,才能发生反应。库仑或静电相互作用力指的是极性分子或离子有一定的偶极矩,它们靠近的时候是有方向性的,带正电的和带负电的相互吸引而发生反应。电荷转移能力指的是富电性物种的HOMO和缺电性物种的LUMO之间的相互作用能。
当亲核进攻的原子相同时,可以用静电作用解释亲核性的相对强弱。如上述有关氧作为反应中心的亲核性强弱:CH3O->OH->PhO->CH3COO->TsO-。在这个序列中,甲氧基中的氧原子拥有的电荷密度最大,而对甲苯磺酸根阴离子中的氧原子拥有的电荷密度最小,由此从前往后亲核能力降低。这与碱性的次序是一致的。
当亲核进攻原子不同时,可以用亲核试剂LUMO和底物HOMO之间的相互作用来解释。如图7所示,硫代乙酸根阴离子有两个共振结构(Ⅰ和Ⅱ),进攻伯卤代烃可分别得到硫取代产物和氧取代产物。事实证明,硫的亲核性强,反应能选择性地得到硫取代产物。用电荷转移能力来解释,就是硫孤对电子所占据的非键轨道n和卤代烃中反键轨道σ*能量间隙小,容易给出电子而成键(图8)[23]。
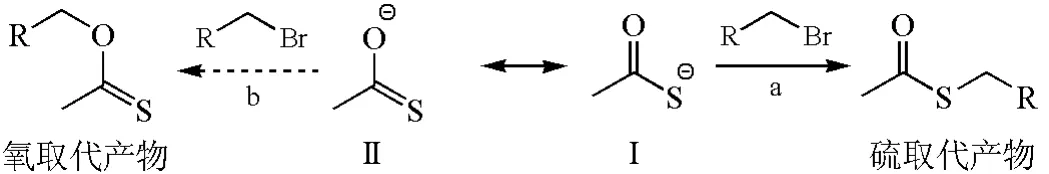
图7 硫代乙酸根阴离子与溴代烷的选择性亲核取代
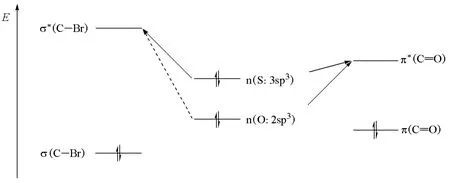
图8 硫代乙酸根阴离子亲核取代反应的电荷转移能力示意图
当缺电性物种是羰基时,由于羰基的π*轨道比卤代烃的σ*轨道能量低(图8),此时由于氧的n轨道与羰基的π*轨道能量间隙减小,硫和氧都能作为亲核试剂,故羰基对硫和氧的选择性要低得多。
3.2 软硬酸碱理论
Pearson提出了软硬酸碱(HSAB)理论,根据IUPAC定义,“软酸”指的是一个缺电子的、可以接受电子的Lewis酸,它具有易极化的性质;相应地,“软碱”指的是一个富电子的、可以给出电子的Lewis碱,它具有易极化的性质。软硬酸碱理论认为:软酸易与软碱作用,即“软亲软”;而硬酸易与硬碱作用,即“硬亲硬”。虽然文献中也有关于软硬度的评价,但HSAB理论仅限于定性判断化合物的稳定性或反应的可行性。
具体来讲,硬酸和硬碱具有小尺寸、高氧化态、低极化、大的电负性等特性,作为硬碱具有低的HOMO轨道能级,作为硬酸具有高的LUMO轨道能级;软酸和软碱具有大尺寸、低氧化态、高极化、小的电负性等特性,作为软碱比硬碱有更高的HOMO轨道能级,作为软酸比硬酸有更低的LUMO轨道能级。一些常见离子或分子的软硬酸碱分类列于表3。
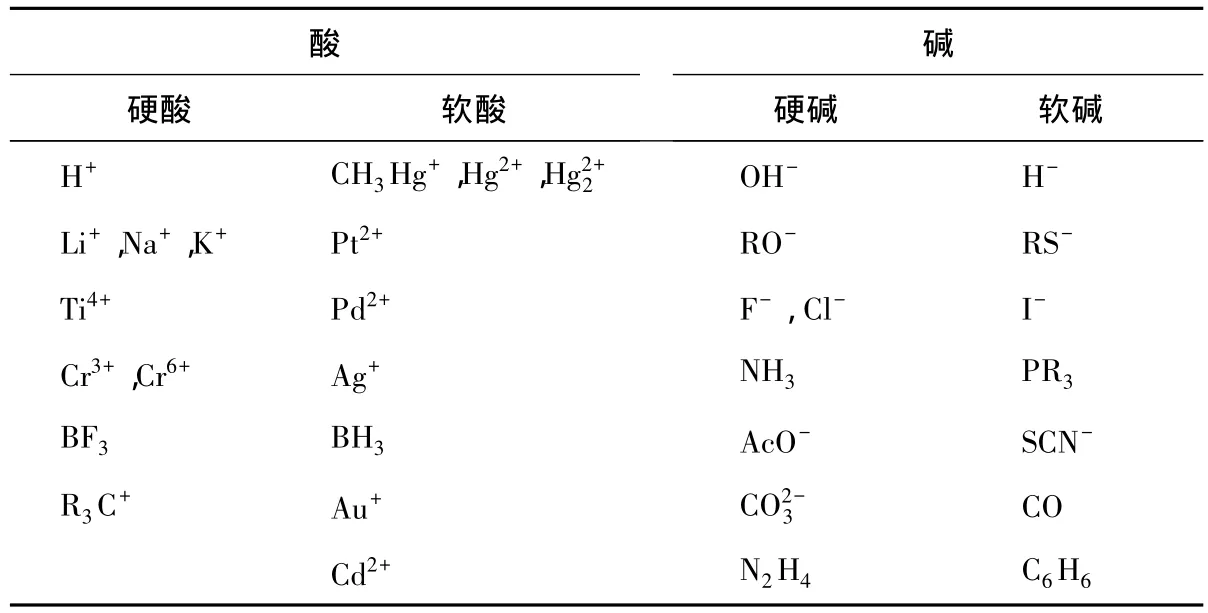
表3 一些常见的软硬酸碱
与软硬酸碱相对应,亲核试剂也分为硬亲核试剂和软亲核试剂,处于两者之间的称“边界”亲核试剂,列于表4。反应时,硬亲核试剂和硬亲电试剂受静电作用控制而成键,软亲核试剂和软亲电试剂受轨道作用控制而成键。
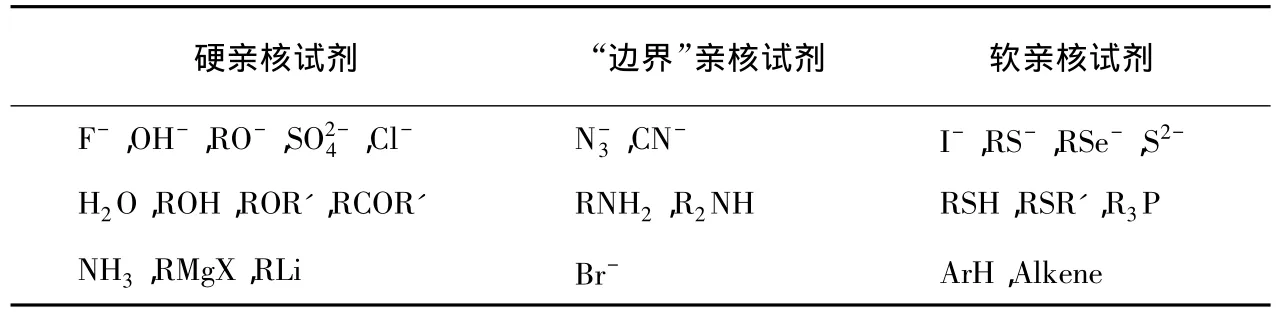
表4 一些常见的软硬亲核试剂
很多两可亲核试剂在进行亲核反应时具有一定的区域选择性,这种选择性可用HSAB理论来解释。如图9所示,在SN1反应中,较硬的亲核试剂有利于进攻较硬的亲电试剂,即碳正离子;而在SN2反应中,较软的亲核试剂有利于进攻较软的带部分正电荷的碳原子[11]。
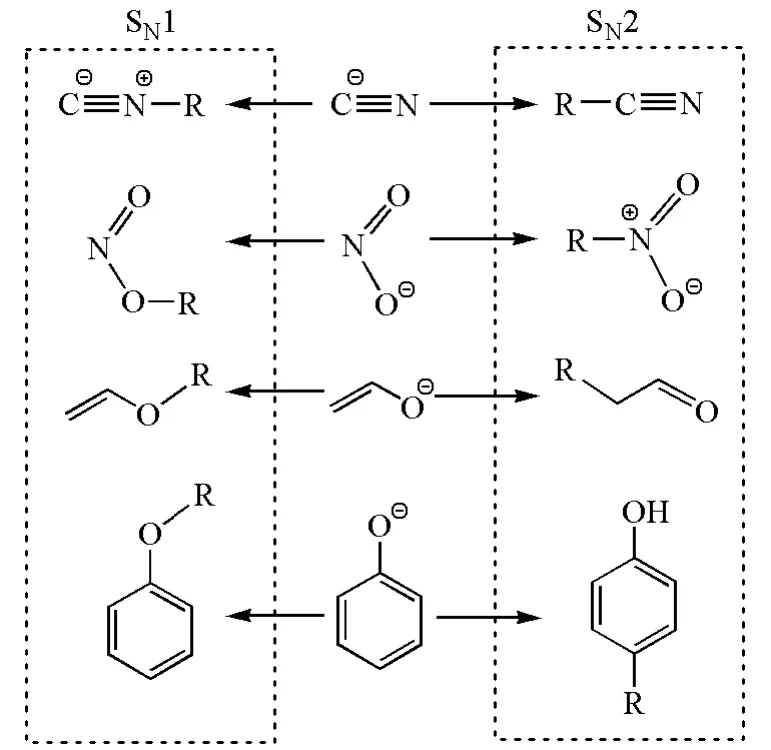
图9 一些两可亲核试剂的区域选择性亲核取代反应
对于典型的两可离子CN-来说,当NaCN与碘代烷反应时,CN-的碳原子(软亲核试剂)进攻软的亲电试剂碘代烷,得到腈(图10)。然而,当使用AgCN时,CN-的氮原子(硬亲核试剂)倾向于与碘代烷产生的碳正离子“硬亲硬”,生成异腈[24]。
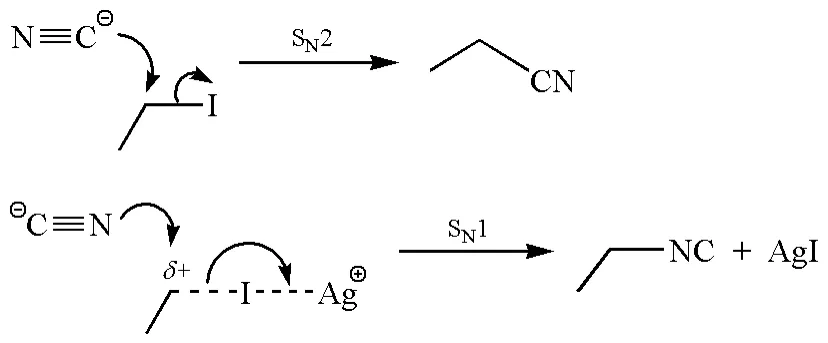
图10 碘代烷与NaCN或AgCN反应的区域选择性
HSAB理论还可解释一些两可亲电试剂的反应性。α,β-不饱和羰基化合物是典型的两可亲电试剂,其α-C和β-C相比较,α-C比较“硬”,是硬亲电试剂,与有机锂、Grignard试剂等硬亲核试剂作用时,受静电作用的控制,容易发生1,2-加成;β-C比较“软”,与软亲核试剂作用时,受轨道的控制,容易发生共轭加成。例如,α,β-不饱和醛与烷基锂试剂反应主要发生1,2-加成,而与硫醇反应则主要发生1,4-共轭加成(图11)。
最近的一个例子是α-二卤代砜(PhSO2CX2H)在强碱LiN(SiMe3)2(LHMDS)存在下与α,β-不饱和酮的亲核加成反应[25]。反应中所形成的碳负离子PhSO2CF是较“硬”的碱,而PhSO2CCl是较“软”的碱,因此PhSO2CF与α,β-不饱和酮反应生成1,2-加成产物,PhSO2CCl则生成1,4-加成产物(图12),体现了“软亲软”、“硬亲硬”规律。
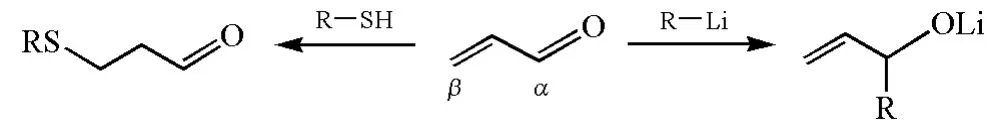
图11 α,β不饱和醛与烷基锂或硫醇反应的区域选择性
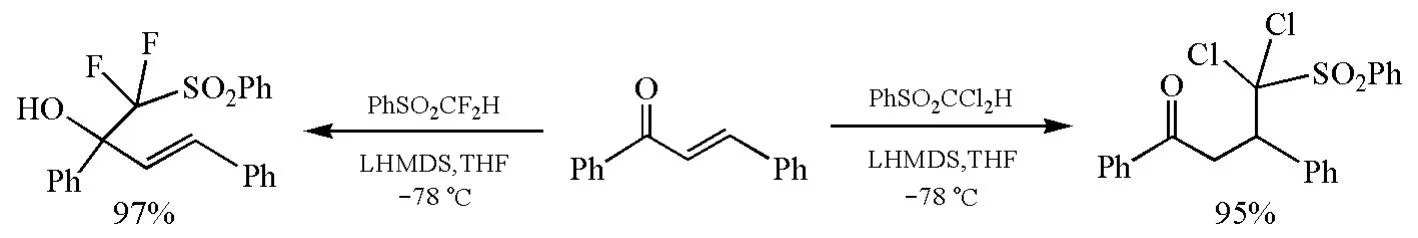
图12 α,β-不饱和酮与PhSO2CF或PhSO2CC反应的区域选择性
4 结束语
亲核性和碱性是富电性分子或离子所具有的特性,二者既有共性,又有本质区别。尽管人们对碱性的相对强弱已能够用其共轭酸的pKa进行定量描述,但迄今尚未找到可被普遍应用的定量描述亲核性相对强弱的参数。在有机反应过程中,试剂最终体现亲核性还是碱性,一般取决于其电子效应、立体效应、溶剂化作用等多种因素。HSAB理论在解释一些两可亲核试剂反应的区域选择性方面比较成功,但仍有很多现象难以用该理论进行解释[24]。
[1]Muller P.Pure Appl Chem,1994,66:1077
[2]Swain C G,Scott C B.J Am Chem Soc,1953,75:141
[3]Ritchie C D.Acc Chem Res,1972,348
[4]Ritchie C D.J Am Chem Soc,1975,1170
[5]Edwards J O.J Am Chm Soc,1954,76:1540
[6]Edwards J O.J Am Chem Soc,1956,78:1819
[7]Mayr H,Bug T,Gotta M F,et al.J Am Chem Soc,2001,123:9500
[8]Mayr H,Ofial A R.Pure Appl Chem,2005,77:1807
[9]Phan T B,Breugst M,Mayr H.Angew Chem Int Ed,2006,45:3869
[10]Mayr H,Ofial A R.J Phys Org Chem,2008,21:584
[11]Smith M B,March J.March's Advanced Organic Chemistry,Reactions,Mechanisms,and Structure.6th ed.New York:John Wiley&Sons Inc,2007
[12]Kornblum N,Seltzer R,Haberfield P.J Am Chem Soc,1963,85:1148
[13]Clayden J,Greeves N,Warren S,et al.Organic Chemistry.Oxford:Oxford University Press,2001
[14]Klopman G.J Am Chem Soc,1968,90:223
[15]Salem L.J Am Chem Soc,1968,90:543
[16]Fleming I.Frontier Orbitals and Organic Chemical Reactions.Chichester:Wiley,1976
[17]Pearson R G.J Am Chem Soc,1963,85:3533
[18]Pearson R G.Science,1966,151:172
[19]Pearson R G,Songstad J.J Am Chem Soc,1967,89:1827
[20]Pearson R G.J Chem Edu,1968,45:581
[21]Pearson R G.J Chem Edu,1968,45:643
[22]Stone A J,Erskine R W.J Am Chem Soc,1980,102:7185
[23]Clayden J,Greeves N,Warren S,et al.Organic Chemistry.Oxford:Oxford University Press,2009
[24]Mayr H,Breugst M,Ofial A R.Angew Chem Int Ed,2011,50:6470
[25]Ni C F,Zhang L J,Hu J B.J Org Chem,2008,73:5699
