南瓜籽中一种抗真菌蛋白的提取及抗菌活性研究
2014-01-09王丽波于泽源徐雅琴郝永峰肖振平张晓松
王丽波 于泽源 徐雅琴 郝永峰 肖振平 张晓松
南瓜籽中一种抗真菌蛋白的提取及抗菌活性研究
王丽波 于泽源 徐雅琴 郝永峰 肖振平 张晓松
(东北农业大学理学院,哈尔滨 150030)
裸仁南瓜籽经破碎,磷酸缓冲液4℃浸提,硫酸铵沉淀,上清液透析,SP-Sepharose FF阳离子交换层析,Sephadex G-75凝胶层析柱,冻干等步骤纯化得到一种新的抗真菌蛋白,命名为Pw-1,并对其抗菌活性进行初步鉴定。SDS-PAGE分析显示Pw-1蛋白的分子质量约为14.8 ku。抗菌活性鉴定表明,该蛋白对黄瓜枯萎病菌、大豆灰斑病菌和链格孢霉菌3株真菌具有显著的生长抑制活性,并呈现出剂量依赖的特征,IC50值分别为16.64、20.91和21.22μmol/L。加入胰蛋白酶后Pw-1蛋白的抗菌活性消失,表现出蛋白类物质所具有的对于蛋白酶的敏感性。
南瓜籽 抗真菌蛋白 纯化
南瓜籽又名南瓜仁,白瓜籽,金瓜籽,为葫芦科植物南瓜的成熟种子。南瓜籽中含有大量的脂肪、蛋白质、植物甾醇以及各种矿物质等营养成分[1-3]。中医学认为南瓜籽味甘性温,归脾胃大肠经,有驱虫、下乳、健脾利水之功效,是一味药食两用的中药[4]。
现代研究表明南瓜籽中含有多种具有离体抑制真菌生长增殖能力的活性蛋白,如Xia等[5]从南瓜籽中提取出分子质量约为29 ku的活性蛋白,具有N-糖苷酶活性,并对人类黑色素瘤细胞的增殖表现出较强的抑制作用。Ng等[6]从南瓜籽中提取出2种分子质量均为12 ku的小分子蛋白,都有抑制蛋白质合成的活性。Wang等[7]从黑南瓜籽中提取到富含精氨酸、谷氨酸和甘氨酸的分子质量为8 ku的抗真菌蛋白。这些活性蛋白未来可作为天然防腐剂用于食品保鲜和保藏,以及用于抗农作物病虫害和医药的研究和应用等,具有广泛的研究意义。
本研究以裸仁南瓜籽为材料提取其总蛋白,通过两步层析分离,纯化得到一种抗真菌蛋白,并对该蛋白的分子质量和抗菌活性进行研究,为深入开展制备植物种子来源的抗真菌蛋白提供理论参考。
1 材料与方法
1.1 菌种、材料与仪器
宝库1号裸仁南瓜籽:讷河市宝库良种繁育研究所;SP交联琼脂糖凝胶、G-75葡聚糖凝胶:浙江争光实业股份有限公司;标准分子质量蛋白(14.4~116 ku):加拿大Pharmacia公司;黄瓜枯萎病菌(Fusarium oxysporum)、大豆灰斑病菌(Cercospora sojina Hara)和链格孢菌(Alternaria alternata):东北农业大学农学院。所用试剂均为分析纯。
Z36型高速冷冻离心机:德国Hermle公司;Fdu-1100冷冻干燥机:日本Eyela公司;FW80型高速万能粉碎机:天津市泰斯特仪器有限公司;lhs-25sc恒温恒湿培养箱:上海一恒科技有限公司。
1.2 方法
1.2.1 南瓜籽抗真菌蛋白的纯化
500 g南瓜籽经过低温干燥后粉碎,过0.2 mm孔径筛网,加入2 L磷酸盐缓冲液(10 mmol/L,pH 7.0,含0.15 mol NaCl)、4℃匀浆,浸提6 h(同一样品反复浸提3次),离心(4℃,12 000 r/min,15 min),上清液加入硫酸铵至30%饱和度,置于4℃ 10 h,12 000 r/min冷冻离心,收集上清液。加入硫酸铵至80%饱和度,12 000 r/min离心,沉沉淀用少量浸提缓冲液溶解后透析(MW 3.5 ku),12 000 r/min离心 10 min,收集上清液,冷冻干燥,所得蛋白为南瓜籽粗蛋白。
将上述粗蛋白0.5 mL(30 mg/mL)用平衡缓冲液充分透析平衡后,上样于SP-Sepharose FF阳离子交换柱上(1.0 cm×30 cm),在10 mmol/L醋酸(pH 4.5)缓冲体系中,用0~1 mol/L NaCl梯度洗脱,流速为1.0 mL/min,280 nm检测。将各收集管组分透析冷冻干燥,以黄瓜枯萎病菌作为指示菌检测抗菌活性。
将有活性的洗脱组分充分透析,冷冻干燥后0.5 mL(30 mg/mL)进一步用 Sephadex G-75凝胶层析柱(1.5 cm×20 cm)分离,pH 6.5,5 mmol/L的 PB缓冲液洗脱,控制流速为0.5 mL/min。收集洗脱峰,以黄瓜枯萎病菌作为指示菌测定各洗脱组分的抗真菌活性。
1.2.2 SDS-PAGE测定分子质量
SDS-PAGE参考 Laemmli等[8]方法,用 Tris-HCl缓冲液,分离胶浓度15%,浓缩胶浓度5%,含0.1%SDS,恒压200 V,电泳3 h。电泳后用考马斯亮蓝R-250染色。
1.2.3 真菌生长抑制活性测定
采用牛津杯法[9]测定各层析收集组分的真菌生长抑制活性。受检真菌为黄瓜枯萎病菌、大豆灰斑病菌和链格孢菌。将供试菌株点植于PDA(马铃薯葡萄糖琼脂培养基)平板中心,于28℃培养至菌落直径达到1~2 cm,在距离菌落边缘1 cm处放置灭菌的牛津杯,各取100μL样品组(含目的蛋白)和对照组(0.02 mol/L、pH 6.6 PBs缓冲液 100μL),用0.22μm微孔滤膜过滤除菌后加入牛津杯内,4℃预扩散24 h,28℃继续培养72 h,观察有无抗菌作用。
1.2.4 抑真菌半抑制浓度(IC50)的测定
参照Liu等[10]方法,将抗真菌蛋白混入约45℃的马铃薯葡萄糖琼脂液体,每份总体积为15 mL,浓度分别为 0、5、10、20μmol/L。迅速混匀后分别倒入平皿(9 cm)待冷却后接入少量等量菌体,放入28℃培养箱培养,待菌体生长5 d后,测量加入空白对照的菌圈直径(D c)和加入样品的菌圈直径(D n)。抑制率I=(D c-D n)/D c,根据抑制率和样品浓度绘制曲线,可求得半抑制浓度IC50,本试验检测了抗真菌蛋白对黄瓜枯萎菌、大豆灰斑菌、链格孢菌3种菌的半抑制浓度,每个浓度平行3次,测量时取其菌圈的平均值。
1.3 数据处理
采用quantity one软件定量分析了SDS-PAGE图谱。
2 结果和分析
2.1 南瓜籽抗菌蛋白的分离纯化
南瓜籽粗蛋白经SP-Sepharose阳离子交换柱分离,得到 A、B、C、D、E、F共 6个蛋白洗脱峰(图1),用黄瓜枯萎病菌为指示菌,用平板扩散法测定各峰抗菌活性,结果显示C和E峰具有抗真菌活性。且E峰活性较高,所以选择E峰进一步纯化。
将E峰组分上样于Sephadex G-75凝胶层析柱进一步分离,得到两个洗脱峰分别称为I、II(图2),抗菌活性检测结果表明,峰I具有较高的抗真菌活性,峰II没有抗菌活性。
经磷酸缓冲液浸提,硫酸铵盐析,透析和冷冻干燥,从500 g南瓜籽中提取到1.9 g粗蛋白,E峰组分经透析冻干后总质量为70.4 mg,I峰洗脱液透析冻干后得到21.7 mg的终蛋白。
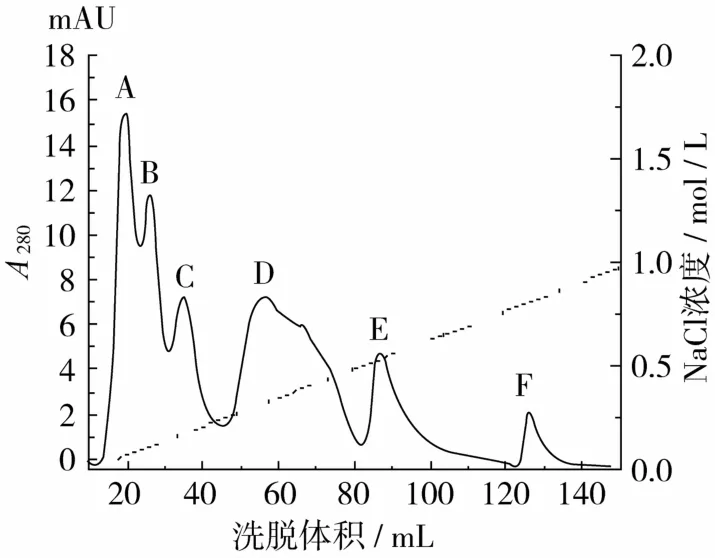
图1 南瓜籽抗真菌蛋白的SP-Sepharose FF阳离子交换层析

图2 阳离子交换层析活性洗脱峰E的Sephadex G-75凝胶排阻层析
2.2 抗真菌蛋白分子质量测定
SDS-PAGE结果如图3所示,所提取的南瓜籽粗蛋白(泳道B)组分较多,经过两步层析之后,I峰蛋白(泳道A)呈单一条带,说明其已达到电泳纯。具有抗真菌活性的I峰蛋白命名为Pw-1。
以标准蛋白质的相对迁移率Rf为横坐标(y),标准蛋白质分子质量的对数lg Mr为纵坐标(x),进行线性回归,得回归方程:y=-1.112 7x+2.017 9,R2=0.990 6,根据Pw-1蛋白的相对迁移率0.818,得出其分子质量为14.8 ku。
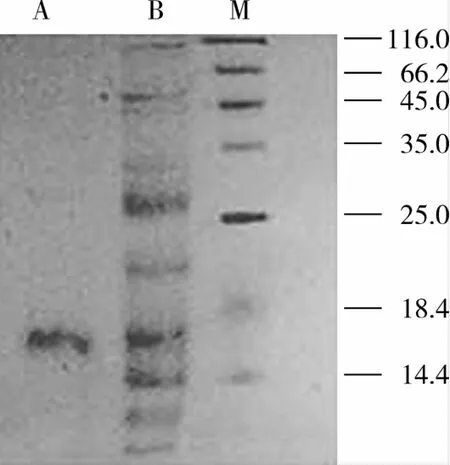
图3 南瓜籽抗真菌蛋白Pw-1的SDS-PAGE分析
2.3 真菌生长抑制活性检测
Pw-1蛋白抗菌效果如图4所示,其对黄瓜枯萎病菌、大豆灰斑病菌和链格孢霉菌均有抑制作用(图4a、b、c)。由表1的抑菌圈的直径大小可以说明,Pw-1蛋白对黄瓜枯萎病菌和大豆灰斑病菌的效果更显著一些,随着抗真菌蛋白浓度增加抗菌活性更高,呈现清晰的剂量依赖效应。而在相同条件下,对照组菌丝扩散没有受到影响,菌落边缘呈现规则的圆形。并且由图4d可知,加入胰蛋白酶后抗菌活性消失,Pw-1蛋白表现出蛋白类物质所具有的对于蛋白酶的敏感性。

图4 Pw-1蛋白的抗真菌效果
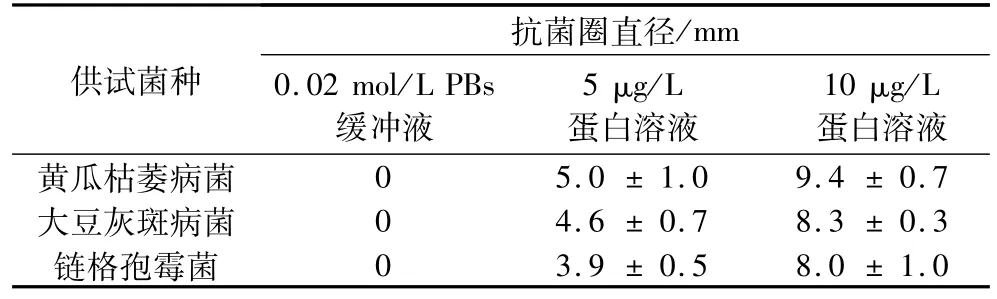
表1 Pw-1蛋白对3种菌的抗菌作用对比
2.4 半抑制浓度
不同浓度的Pw-1蛋白对三种菌的抑制效果如图5,根据抑制率(y)和浓度(x)做曲线,分别求得黄瓜枯萎病菌、大豆灰斑病菌、链格孢菌的IC50回归方程。分别为 y=0.028 1x+0.034 7(R2=0.991 8)、y=0.023 4x+0.019(R2=0.989 5)、y=0.023 7x+0.012 1(R2=0.992 5)。根据各自的回归曲线测得Pw-1蛋白对黄瓜枯萎病菌的 IC50值为16.64 μmol/L,对大豆灰斑病菌的 IC50值为 20.91μmol/L,对链格孢菌的IC50值为21.22μmol/L。
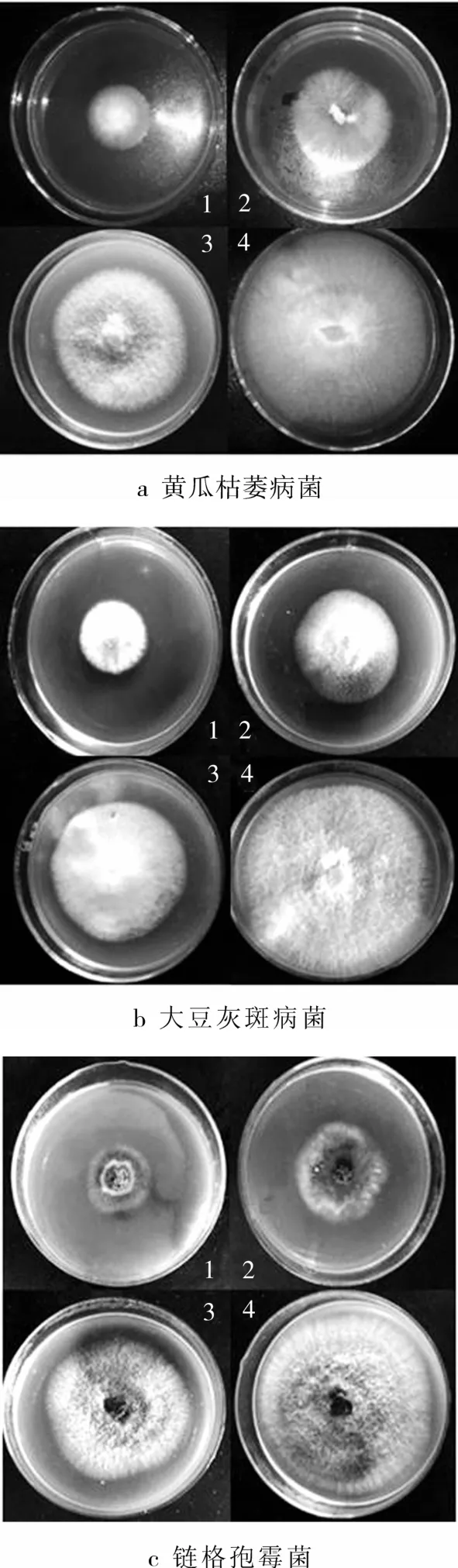
图5 Pw-1蛋白对3种菌的IC50
3 结论
本试验从裸仁南瓜籽中提取出了一种抗真菌蛋白Pw-1,通过 SDS-PAGE分析,分子质量为14.8 ku,不同于已报道的分子质量分别为8、12 ku的南瓜籽抗真菌蛋白,是一种新的抗真菌蛋白。Pw-1蛋白对3株常见的农业致病真菌黄瓜枯萎病菌、大豆灰斑病菌和链格孢霉菌有显著的生长抑制作用,当蛋白溶液浓度为10μg/L时,抗菌圈直径分别为9.4、8.3和8.0 mm,IC50值分别为 16.64、20.91和 21.22 μmol/L。这些数据将为进一步研究Pw-1蛋白的氨基酸序列、其他生物活性以及抗菌机理奠定基础。
[1]孙欣,徐雅琴,崔崇士.南瓜籽油的化学组成及开发利用[J].中国粮油学报,2008,23(2):124-126
[2]Murkovic'M,Piironen V,Lampi A M,et al.Changes in chemical composition of pumpkin seeds during roasting process for production of pumpkin seed oil(Part 1:non-volatile compounds)[J].Food Chemistry,2004,84:359-365
[3]Xanthopoulou M N,Nomikos T,Fragopoulou E,et al.Antioxidant and lipoxygenase inhibitory activities of pumpkin seed extracts[J].Food Research International,2009,42:641-646
[4]田代华.实用中药辞典 [M].北京:人民卫生出版社,2002:1321-1323
[5]Xia H C,Li F,Li Z.Purification and characterization of Moschatin,a novel type Iribosome-inactivating protein from the mature seeds of pumpkin(Cucurbita moschata),and preparation of its immunotoxin against human melanoma cells[J].Cell Research,2003,13:369-374
[6]Ng T B,Parkash A,Tso W W.Purification and characterization of moschins,arginine-glutamate-rich proteins with translation-inhibiting activity from brown pumpkin(Cucurbita moschata)seeds[J].Protein Expression and Purification,2002,26:9-13
[7]Wang H X,Ng T B.Isolation of cucurmoschina novel antifungal peptide abundant in arginine,glutamate and glycine residues from black pumpkin seeds[J].Peptides,2003,24:969-972
[8]Laemmli U K,Favre M.Gel electrophoresis of proteins[J].Journal of Molecular Biology,1973,80:573-599
[9]李晨,白承之,李玉英等.一种薏苡抗真菌蛋白的制备及抑菌活性研究 [J].食品科学,2012,33(5):46-48
[10]Liu B,Huang L L,Buchenauer H,et al.Isolation and partial characterization of an antifungal protein from the endophytic Bacillus subtilis strain EDR4[J].Pesticide Biochemistry and Physiology,2010,98:305-311
[11]Yang B,Yang H,Li J.Amino acid composition,molecular weight distribution and antioxidant activity of protein hydrolysates of soy sauce lees[J].Food Chemistry,2011,24(1):551-555
[12]陈贝.苦瓜籽中生物活性物质的分离纯化及表征 [D].福州:福州大学,2006.
Isolation and Characterization of a Novel Antifungal Protein from Pumpkin Seeds
Wang Libo Yu Zeyuan Xu Yaqin Hao Yongfeng Xiao Zhenping Zhang Xiaosong
(College of Science,Northeast Agricultural University,Harbin 150030)
A novel antifungal protein is measured to be isolated from pumpkin seeds and designated Pw-1.The purification procedure consists of extraction with phosphoric acid buffer at 4℃,ammonium sulfate precipitation,dialysis,SP-Sepharose FF column,Sephadex G-75 column,freeze drying and other processes.Partial characterization and antifungal activity are assayed in the paper.The molecular mass of the purified Pw-1 was determined as 14.8 ku by SDS-PAGE.The protein exhibited antifungal activity to the Fusarium oxysporum,Cercospora sojina Hara,and Alternaria alternata in a dose-dependent with IC50values of 16.64,20.91,and 21.22μmol/L respectively.The antifungal activity of Pw-1 protein disappeared after trypsin addition,showing the protease sensitivity of protein.
pumpkin seeds,antifungal protein,purification
Q516
A
1003-0174(2014)03-0063-04
黑龙江省教育厅科学技术研究(12531052),东北农业大学青年启动基金(2011QN208)
2013-04-24
王丽波,女,1979年出生,讲师,天然产物开发与应用
于泽源,男,1961年出生,教授,园艺作物的采后加工和处理
