维生素C并EPO对大鼠肾脏缺血再灌注损伤保护作用
2013-12-23,,,,
,,,,
(青岛大学医学院附属医院肾内科,山东 青岛 266003)
研究表明,肾脏缺血再灌注损伤(IRI)与氧化应激反应密切相关,而肾脏IRI的可逆性可能与生物体内的抗氧化机制有关,血红素加氧酶-1(HO-1)是生物体内一种重要的抗氧化蛋白[1],氧化应激反应时能够显著表达。维生素C(VitC)和促红细胞生成素(EPO)是两种抗氧化剂[2],两种药物联合应用是否能够增强HO-1的表达,减轻肾脏病理损伤,国内外尚未有该方面的研究报道。本研究拟通过建立大鼠肾脏IRI模型,观察两种抗氧化剂对肾脏IRI保护作用及其可能的机制,从而为临床肾脏IRI的防治提供理论依据和防治策略。
1 材料和方法
1.1 材料来源
健康雄性Wistar大鼠50只,8周龄,体质量200~300 g(青岛市药检所动物实验中心提供)。适应性喂养1周后,随机分为假手术组(A组)、缺血再灌注组(B组)、VitC预处理组(C组)、EPO预处理组(D组)、VitC并EPO预处理组(E组)共5组,每组10只大鼠。
1.2 仪器与和试剂
重组人EPO、VitC(上海信谊药厂有限公司),兔抗鼠HO-1抗体、Envision二步法免疫组化检测试剂盒及二氨基联苯胺(DAB)显色液(北京中山生物技术有限公司),丙二醛(MDA)、HO-1 ELISA试剂盒(青岛沃尔森生物技术有限公司)。
1.3 动物模型的建立及各组的处理
A组只打开腹腔,游离双侧肾蒂但不夹闭。B组大鼠在实验前禁食12 h、饮水不限,建立肾脏IR模型[3]。C组和D组分别在夹闭肾蒂前2 h腹腔注射VitC(2 mmol/kg)和EPO(5 000 U/kg)。E组给予维生素C和EPO,其用药方法分别与C、D组相同。
1.4 标本收集及检测方法
各组大鼠于肾脏IR后24 h,麻醉后摘眼球取血,并尽快留取肾组织。于收集标本24 h内检测各组血清肌酐(Scr)、尿素氮(BUN)水平;采用HO-1、MDA的ELISA试剂盒分别检测血清HO-1、MDA的水平;苏木精-伊红(HE)染色光的镜下观察肾组织的形态学变化;按照JABLONSKI等[4]方法,依据近端肾小管损伤的程度分为5级,每组选取50个视野,计数各个等级所在视野的个数,即记为各个等级的分数,计分越高,表示肾小管损伤越严重。采用HPIAS-1000彩色图像分析仪测定肾组织HO-1的表达,测定选定目标区域的阳性密度(选定区域的阳性面积/选定区域)及阳性点的平均吸光度值,两者的乘积即为各选定区域的阳性表达总量,取其平均值为每例标本的阳性表达量。
1.5 统计学方法
2 结 果
2.1 各组大鼠肾功能变化
与A组大鼠比较,B、C、D、E组血清BUN、Scr水平均明显升高(F=414.63、387.89,q=9.58~6 388.47,P<0.05),E组大鼠血清BUN、Scr水平与B、C、D组比较,差异有显著意义(q=18.33~5 572.02,P<0.05)。见表1。
2.2 各组血清HO-1、MDA水平比较
与A组相比,B、C、D、E组血清中HO-1、MDA水平均有明显升高(F=315.73、38.97,q=16.83~55.52,P<0.05);C、D、E组血清中HO-1水平均较B组明显升高(q=51.39~169.43,P<0.05),而MDA均较B组明显下降(q=5.59~10.62,P<0.05);与C、D组比较,E组HO-1水平显著升高(q=118.03、119.17,P<0.05),而MDA水平明显下降(q=5.03、3.74,P<0.05)。见表1。
2.3 各组肾组织形态学变化及肾小管损伤评分
光镜下A组肾小球和肾小管结构基本完整。与A组相比,B组弥漫大片状肾小管上皮细胞崩解,细胞碎屑堵塞管腔但肾小球结构基本正常,C、D组见到小灶状肾小管上皮细胞坏死,E组仅见部分肾小管上皮细胞轻度水肿。B、C、D、E组肾小管损伤评分与A组相比,差异有显著意义(Hc=129.77,q=10.26~15.37,P<0.05);C、D组肾小管损伤评分与E组相比,差异有显著意义(q=12.07、16.91,P<0.05);C组肾小管损伤评分与D组相比,差异无显著性(P>0.05)。见表2。
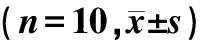
表1 各组大鼠血清BUN、Scr、HO-1、MDA水平比较
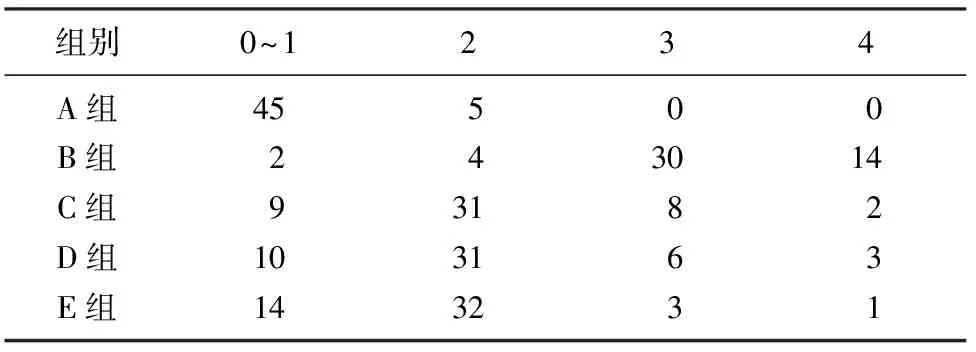
表2 各组大鼠肾小管损伤程度计分比较(视野)
2.4 各组肾组织HO-1的表达与定量分析
肉眼观察A组肾组织HO-1只有微量表达;B组与A组相比,HO-1表达稍增加,且胞浆局灶着色轻;C、D、E组呈弥漫性染色、且染色较重,其中E组最显著。A、B、C、D、E组HO-1的表达水平分别为(7.01±0.50)%、(27.33±1.54)%、(56.22±1.55)%、(59.06±1.39)%、(92.99±2.44)%;与A组大鼠比较,其他4组HO-1的表达水平均明显升高(F=2 040.00,q=28.23~119.32,P<0.05);与B组大鼠比较,C、D、E组HO-1的表达水平均显著升高(q=40.14~91.08,P<0.05),其中E组升高最显著,C、D两组HO-1的表达比较差异无显著性(P>0.05)。
3 讨 论
肾脏IRI是指多种原因导致血液中断或不足使肾脏缺血,恢复血流灌注时肾脏功能障碍和结构破坏反而加重的现象[5],临床上肾移植、部分肾切除术等均会引起肾脏IRI。IR阶段氧自由基大量释放,引起组织损伤。MDA是一种过氧化终末产物,其水平可反映肾组织脂质过氧化的程度[6]。本研究结果显示,B组血清中MDA的水平明显升高,提示氧化应激增强可能是导致肾脏IRI的重要原因之一。
肾脏IR时大量氧自由基的释放造成组织损伤,同时也启动了机体的内在抗氧化机制,其中HO-1是一种重要的抗氧化蛋白[7],它作为一种重要的诱导型蛋白,在生理状况下,HO-1在部分肾小管上皮细胞中有少量表达,当IRI时能够大量表达,与本研究结果一致。HO-1是催化血红素的起始酶和限速酶,HO-1本身及其催化血红素的代谢产物可以通过多层次、多方面的作用机制减轻氧化应激带来的损伤[8]。GUELER等[9]研究显示,在肾脏缺血前给予HO-1阻断剂锡原卟啉,单核巨噬细胞中HO-1的表达减少,肾组织损伤严重。另有研究显示,诱导型HO-1表达具有一定的时效性,在夹闭大鼠双侧肾动脉30 min后再灌注24 h时HO-1表达达到高峰,超过24 h后HO-1表达开始下降[10],因此,在肾脏IR早期诱导HO-1的表达对保护肾脏功能至关重要。
VitC和EPO是两种重要的抗氧化剂,探索其能否诱导HO-1高表达有重要的临床意义。本研究结果显示,与B组相比,VitC组能够增强肾组织HO-1的表达,降低血中MDA的水平,肾脏病理损伤减轻。VitC对于肾脏IRI的保护机制较复杂,GENC等[11]认为氧化应激能够使转录因子Nrf2与细胞骨架蛋白Keap 1解离、活化、转位进入胞核,启动HO-1等抗氧化酶基因的表达,阻止脂质过氧化反应。本研究结果还显示,EPO组也能够增强肾组织HO-1的表达,减轻肾脏病理损伤。关于EPO诱导HO-1表达的确切机制尚不明确,CAL等[12]研究认为,IR时EPO能够与其受体特异性结合,引起蛋白酪氨酸激酶-2(Jak2)发生自体磷酸化,Jak2的激活可以引起包括促分裂原活化蛋白激酶途径的磷酸化,而HO-1的诱导性表达也与促分裂原活化蛋白激酶途径的磷酸化有关,推测EPO可能通过促分裂原活化蛋白激酶途径诱导HO-1的表达。
此外,本研究还进一步探讨了VitC和EPO联合应用对肾脏IRI的作用。结果表明,与单用VitC或EPO相比,E组大鼠肾组织HO-1表达量显著升高,血清MDA水平明显降低,肾脏病理损伤程度明显减轻,提示两者联合预处理对肾脏IRI具有协同保护作用,而其具体作用机制有待进一步研究。
总之,VitC和EPO能通过多种途径诱导肾组织HO-1表达增加,抑制氧化应激,从而在肾脏IRI中发挥保护作用,且两者联合应用时这一作用更为显著,这为临床肾脏IRI的防治提供了更加广阔的思路。
[1] NAITO Y, TAKAGI T, UCHIYAMA K, et al. Heme oxygenase-1: a novel therapeutic target for gastrointestinal diseases[J]. J Clin Biochem Nutr, 2011,48(2):126-133.
[2] VISWANATHA S A H, WANGIKAR U, KOTI B C, et al. Cardioprotective effect of ascorbic acid on doxorubicin-induced myocardial toxicity in rats[J]. J Indian J Pharmacol, 2011 43(5):507-511.
[3] GOLAB F, KADKHODAEE M, ZAHMATKESH M, et al. Hepatic changes during various periods of reperfusion after induction of renal ischemia in rats[J]. J Transplant Proc, 2009,41(7):2749-2750.
[4] JABLONSKI P, HOWDEN B O, RAE D A, et al. An experimental model for assessment of renal recovery from warm ischemia[J]. Transplantation, 1983,35:198-204.
[5] CABIR A, HASAN K, RAMAZAN A, et al. Protective effect of decorin on acute ischemia-reperfusion injury in the rat kidney[J]. Arch Med Sci, 2011,7(2):211-216.
[6] 王晓杨,王万铁,郝卯林. 川芎嗪对肺缺血再灌注损伤保护作用的实验研究[J]. 青岛大学医学院学报, 2005,41(4):327-329.
[7] RYTER S, ALAM J, CHOI A. Heme oxygenase-1/carbon monoxide: from basic science to therapeutic applications[J]. Physiol Rev, 2006,86(2):583-650.
[8] INGUAGGIATO P, GONZALEZ-MICHACA L, CROATT A, et al. Cellular overexpression of hemeoxygenase-1 up-regulates p21 and confers resistance to apoptosis[J]. Kidney Int, 2001,60(6):2181-2189.
[9] GUELER F, PARK J K, RONG S, et al.
Statins attenuate ischemia-reperfusion injury by inducing hemeoxygenase-1 in infiltrating macrophages[J]. Am J Pathol, 2007,170(4):1192-1199.
[10] VILLANUEVA S, CÉSPEDES C, GONZLEZ A, et al. Effect of ischemic acute renal damage on the expression of COX-2 and oxidative stress-related elements in rat kidney[J]. Am J Physiol Renal Physiol, 2007,292(5):1364-1371.
[11] GENC K, EGRILMEZ M, GENC S. Erythropoietin induces nuclear translocation of Nrf2 and hemeoxygenase-1 expression in SH-SY5Y cells[J]. Cell Biochem Funct, 2010,28(3):197-201.
