肿瘤代谢体积对肠型胃癌新辅助化疗效果评价的价值
2013-12-23,,,,
,,,,
(青岛大学医学院附属医院肿瘤科,山东 青岛 266003)
研究显示,新辅助化疗可以提高进展期胃癌病人的手术切除率及生存时间[1],因此越来越受到人们重视。术前客观、准确评价疗效对于病人综合治疗模式、化疗方案、治疗周期数的选择至关重要。但是,目前对胃癌新辅助化疗效果尚缺乏一种准确的评价方法。而且胃肠道为空腔脏器,套用现有的实体瘤疗效评价标准似乎并不适用。氟标记脱氧葡萄糖(FDG)PET-CT检查在多种肿瘤的诊断、分期以及疗效判断等方面的价值已得到肯定。FDG摄取值可以早期、有效地评估新辅助治疗效果[2-4],但是关于胃癌的报道较少,且结果相差较大。因为大约30%的胃癌病灶FDG摄取不足[5],其中主要是Lauren分类中非肠型胃癌,本研究主要针对肠型胃癌进一步探讨肿瘤代谢体积(MTV)对新辅助化疗效果评价的价值。
1 资料和方法
1.1 一般资料
不能行完全根治性切除并接受化疗的进展期胃癌病人35例,男25例,女10例;年龄42~71岁,平均(56.5±7.8)岁;所有病人均经病理检查证实为肠型胃癌;病理分级:1a级2例,1b级15例,2级14例,3级4例。所有病人无绝对化疗禁忌证,其中行FOLFOX方案化疗15例,DCF方案化疗20例,所有病人在新辅助化疗前后行PET-CT检查。
1.2 检查方法
显像仪器为美国GE公司Discovery LS PET-CT scanner,18F-FDG由美国GE公司生产的回旋加速器PET trace及化学合成模块自动合成,放化纯度>95%。受检者空腹6 h以上,经测定确认血糖在正常范围后,肘静脉注射FDG 5.5~7.4 MBq/kg,平静休息30 min。根据病人的身高扫描6~8个床位。CT扫描的条件为:管电压140 kV,电流90 mA,层厚4.25 mm。 PET数据经CT衰减校正后,在XELERIS工作站采用二维采集OS-EM法进行图像重建。必要时加做特殊部位或局部延时显像以排除胃肠道生理性摄取的影响。
1.3 PET-CT数据分析
图像由两位经验丰富的核医学医师进行分析,病变FDG浓集程度采用目测法和半定量分析法判断。所有病人均在横断面上使用三维画法自动勾勒胃部病灶、正常胃壁的感兴趣区(ROI),取其最大标准摄取值(SUVmax)。取SUV=2.5为显示ROI底限阈值,显像区域为代谢活性区域,逐层勾画出其边界,每层面积乘以层厚得到每层体积,将每层体积相加得到MTV。考虑PET部分容积效应,PET高代谢区域可能包含有空腔区域,在确定MTV时去除此部分区域。
1.4 病理反应评价方法
采用BECKER等[6]提出的原发灶组织病理消退分级方法评价:1a级,瘤床内无残余癌细胞;1b级,残余癌细胞<10%;2级,残余癌细胞10%~50%;3级,残余癌细胞>50%。1a级和1b级为病理反应有效组,2级和3级为病理反应无效组。
2 结 果
2.1 相关临床病理参数与病理反应的关系
NAC前后SUVmax、MTV比较差异有统计学意义(t=12.87、7.72,P<0.01)。见表1。NAC后SUVmax、MTV降低率与术后病理反应相关(r=0.37、0.73,P<0.05)。NAC后有效、无效组SUVmax降低率、MTV降低率比较差异有显著性(U=74.50、22.00,P<0.01)。见表2。
2.2 代谢参数对预测病理反应的价值
通过ROC曲线分析结果显示,SUVmax降低率曲线下面积为0.76,MTV降低率曲线下面积为0.93,两者曲线下面积比较,差异有显著意义(Z=1.99,P<0.05)。见图1、表3。当MTV降低率为49.4%时,预测病理评价有效的灵敏度为88.2%、特异度为88.9%。

表1 NAC前后代谢参数的比较

表2 两组临床病理参数比较±s)

图1 ROC曲线分析不同代谢参数降低率对预测病理反应价值
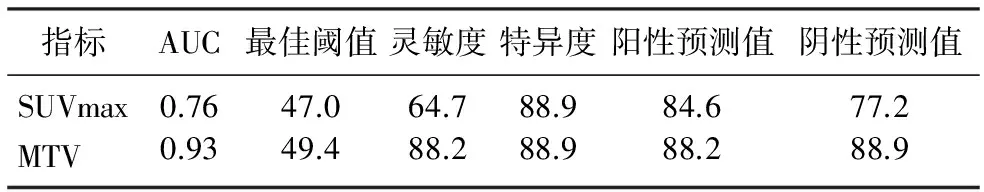
表3 代谢参数的降低率对预测病理反应的作用(χ/%)
3 讨 论
肿瘤负荷是肿瘤病人疗效评价的核心,PET-CT检查可包含肿瘤的代谢和解剖信息,能较准确地反应肿瘤负荷。以治疗前后病灶SUVmax下降程度来评价胃癌NAC的疗效,对胃食管交界处癌或胃癌病人病理反应预测的灵敏度为44%~77%,特异度为86%~100%[5,7-8]。与本研究应用NAC前后SUVmax减少43%为阈值预测病理反应的结果相似。但也有报道认为,FDG PET-CT预测病理反应和预后价值有一定局限性,不能应用于疗效评价[9-10]。分析可能与不同入组条件、分析方法、界值选择等因素有关。首先,通过分层分析显示,在不同研究样本中低分化和弥漫型胃癌的比例较高,其中Lauren分类中非肠型胃癌占60%~67%。此类型的胃癌治疗反应率较低、预后较差,因此与其他肿瘤相比,FDG PET-CT在胃癌的应用中更为复杂。其次,肿瘤对FDG摄取程度是以SUVmax来量化,而其只代表组织内某一点的代谢程度,并不反映总体代谢情况。最近研究结果显示,CT体积可评价进展期胃癌化疗效果[11]。而CT体积变化常滞后于肿瘤细胞死亡,尤其在NAC后肿瘤细胞已发生坏死凋亡,但解剖成像可持续存在。因此,MTV作为衡量高代谢活性肿瘤细胞定量的代谢体积参数,其在疗效评价中的价值可能会更高。本文的研究结果也显示,MTV降低率与病理反应呈显著相关,以MTV降低率49.4%为阈值,预测病理反应的灵敏度为88.2%,特异度为88.9%。而且与SUVmax相比,在预测胃癌NAC后的病理反应的灵敏度、特异度、阳性预测值、阴性预测值均较高,在疗效评价中具有较高诊断价值。
值得注意的是,目前对病灶摄取临界值选择尚无统一的标准,且不同临界值是否影响肿瘤MTV,还没有明确定论。但在统一标准下进行测量时,不同临界值仅影响MTV绝对值大小,并不影响MTV与实际肿瘤负荷的一致性。同时,FDG的摄取受注射与显像时间间隔、肿瘤大小、血糖水平、重建图像的空间分辨率等影响, 但若化疗前后PET 测量条件相对固定, 胃癌NAC前后FDG摄取的变化与病理反应和预后相关性较好[12]。另外,本研究主要缺陷在于小样本的回顾性研究,且病例及化疗方案的选择与PET-CT 检查时机都具有一定的异质性。
总之,在胃癌NAC疗效评价中,MTV的降低率可以较准确地预测病理反应,其预测准确性要优于SUVmax。同时,也应注意到PET-CT监测胃癌NAC疗效还缺乏有效的评估标准,仍需要进一步更多大样本、高质量、多中心的前瞻性研究,以确定更加准确的判定标准。
[1] SCHUHMACHER C, GRETSCHEL S, LORDICK F, et al. Neoadjuvant chemotherapy compared with surgery alone for locally advanced cancer of the stomach and cardia: European Organisation for Research and Treatment of Cancer rando-mized trial 40954[J]. J Clin Oncol, 2010,28(35):5210.
[2] HYUN H C, KIM J W, HAN K H, et al. Prognostic value of metabolic tumor volume measured by FDG-PET/CT in patients with cervical cancer[J]. Gynecologic Oncology, 2011,120(2):270-274.
[3] ZHU D, MA T, NIU Z, et al. Prognostic significance of metabolic parameters measured by18F-fluorodeoxyglucose positron emission tomography/computed tomography in patients with small cell lung cancer[J]. Lung Cancer (Amsterdam, Netherlands), 2011,73(3):332-337.
[4] 史春雷,黄梅娟,王玲,等.18F-FDG PET/CT在弥漫性大B细胞淋巴瘤诊治中临床应用[J]. 齐鲁医学杂志, 2010,25(2):130-131,134.
[5] OTT K, FINK U, BECKER K, et al. Prediction of response to preoperative chemotherapy in gastric carcinoma by metabo-lic imaging: results of a prospective trial[J]. J Clin Oncol, 2003,21(24):4604-4610.
[6] BECKER K, MUELLER J D, SCHULMACHER C, et al. Histomorphology and grading of regression in gastric carcinoma treated with neoadjuvant chemotherapy[J]. Cancer, 2003,98(7):1521-1530.
[7] OTT K, WEBER W A, LORDICK F, et al. Metabolic imaging predicts response, survival, and recurrence in adenocarcinomas of the esophagogastric junction[J]. J Clin Oncol, 2006 24(29):4692-4698.
[8] LORDICK F, OTT K, KRAUSE B J, et al. PET to assess early metabolic response and to guide treatment of adenocarcinoma of the oesophagogastric junction: the MUNICON phase Ⅱ trial[J]. Lancet Oncol, 2007,8(9):797-805.
[9] VALLBÖHMER D, HÖLSCHER A H, SCHNEIDER P M, et al.18F-fluorodeoxyglucose-positron emission tomography for the assessment of histopathologic response and prognosis after completion of neoadjuvant chemotherapy in gastric cancer[J]. J Surg Oncol, 2010,102(2):135-140.
[10] OTT K, HERRMANN K, LORDICK F, et al. Early metabolic response evaluation by fluorine-18 fluorodeoxyglucose positron emission tomography allows in vivo testing of chemosensitivity in gastric cancer: long-term results of a prospective study[J]. Clin Cancer Res, 2008,14(7):2012-2018.
[11] LEE S M, KIM S H, LEE J M, et al. Usefulness of CT volumetry for primary gastric lesions in predicting pathologic response to neoadjuvant chemotherapy in advanced gastric cancer[J]. Abdom Imaging, 2009,34(4):430-440.
[12] 汪劭婷,朱朝晖,李小毅,等. 胃癌新辅助化疗疗效临床评价方法及进展[J]. 中国普外基础与临床杂志, 2010,2:200-204.
