重组肝靶向干扰素工程菌菌株的遗传稳定性研究
2013-12-21卢雪梅黄演婷金小宝朱家勇
卢雪梅, 黄演婷, 汪 洁, 金小宝, 朱家勇
(1. 广东药学院药用生物活性物质研究所,广州 510006; 2. 广东省生物活性药物研究重点实验室, 广州 510006)
基因工程菌株的遗传稳定性主要是指工程菌株的质粒稳定性,即宿主细胞在繁殖分裂过程中质粒丢失的程度[1]。工程菌的遗传稳定性对于大规模发酵和产物制备至关重要,是高水平发酵的基本条件,研究其稳定性对进一步的药物开发具有指导作用[2]。
干扰素(Interferon,IFN)是慢性乙型肝炎(chronic hepatitis B,CHB)抗病毒治疗的首选药物之一[3-7]。其中IFNα2b是FDA批准的第一个抗HBV药,但是临床治疗时IFNα2b在体内容易扩散降解,未能在肝脏形成有效的抗病毒作用浓度[8]。为了达到抗病毒效果,药物剂量常要加大,药物剂量的加大也加重了其不良反应,又容易产生耐药性HBV,从而影响疗效[9]。重组肝靶向干扰素是将来源于疟原虫环子孢子蛋白的肝靶向肽CSP I-plus与IFNα2b进行融合,利用CSP I-plus高效特异的肝细胞靶向性将IFNα2b导向肝脏[10-12],使其在肝脏富集,从而提高了干扰素治疗慢性HBV感染的特异性,减少全身用量,降低毒副反应,提高量效比,具有良好的应用前景。本实验室成功克隆了肝靶向干扰素(IFN-CSP)基因,并将其转入原核表达系统菌株E.coliBL21,构建了肝靶向干扰素工程菌株E.coliBL21/pET32a-IFN-CSP,并申请了专利。本文旨在研究该菌株的遗传稳定性,按照国家医药监督管理局对基因重组产品的要求,对该菌株在传代过程中的生长特性、遗传和表达稳定性等进行鉴定。
1 材料和方法
1.1 实验材料
含IFN-CSP基因的重组工程菌株E.coliBL21/pET32a-IFN-CSP为本实验室保存。限制性内切酶KpnI、Hind Ⅲ,Taq DNA 聚合酶,DNA分子量标准购自TaKaRa公司;TIANpure Midi Plasmid Kit为北京TIANGEN公司产品;蛋白质分子量标准购自Fermentas公司;氨苄青霉素购自Amresco公司,酵母提取物和蛋白胨为Oxiod 公司产品;丙烯酰胺、N,N′-亚甲基双丙烯酰胺、SDS购自Sigma公司;TEMED为自北京鼎国生物公司产品。其他化学试剂为进口或国产分析纯。
1.2 方法
1.2.1 菌株传代方法及质粒稳定性鉴定
将冻存-80 ℃ 冰箱中的第 0 代工程菌菌种划线接种于LB (AMP+) 固体平板上,37 ℃培养16~18 h 后,挑取单菌落继续划线培养,每传1 次记为1 代。采用复制平板法,分别挑取传代过程中第0、10、20、30、40、50 代的单菌落100个复制到含AMP 和不含AMP的LB 固体平板上,37℃培养14~16 h,记数菌落数,计算工程菌在有抗生素选择压力下传代时质粒的稳定性。
质粒稳定性(%)= LB ( AMP+) 固体平板上的菌落数/LB (AMP-) 固体平板上的菌落数。
1.2.2 菌落形态和生长观察
与从原代种子接出的培养物对比,观察上述平板上传代工程菌菌落形态变化。菌体用生理盐水洗3次后,用少量生理盐水悬浮,按革兰染色方法,光学显微镜下观察。同时接种单菌落到含氨苄青霉素的LB液体培养基中,37 ℃培养12 h,用 LB 培养基作为对照,测定OD600,确定生长速度的变化。
1.2.3 目的基因的PCR 鉴定
分别挑取第0、10、20、30、40 和50 代工程菌菌种接种于LB 培养基中,培养过夜,用质粒小提试剂盒提取质粒。根据肝靶向干扰素基因的DNA 序列,应用Primer Premier 5.0 引物设计软件设计一对特异性引物,以质粒为模板,进行PCR 扩增鉴定,1.5% 琼脂糖凝胶电泳检测。
1.2.4 质粒酶切鉴定
挑取第0、10、20、30、40 和50 代单菌落,LB液体培养基培养过夜,提取质粒进行KpnI、Hind Ⅲ 双酶切,1.5% 琼脂糖电泳鉴定酶切片段。
1.2.5 插入片段DNA 序列测定
取第50 代重组工程菌菌株委托Invitrogen公司进行序列鉴定。
1.2.6 肝靶向干扰素在工程菌的诱导表达
挑取工程菌单菌落到5 mL LB液体培养基中,37℃培养过夜,然后将此菌液按1∶100比例接种到新鲜的LB液体培养基中,培养至OD600=0.8时,加入终浓度为0.4 mmol/L的异丙基-β-D-硫代半乳糖苷(IPTG)诱导6 h。离心收集菌沉进行15% SDS-PAGE电泳。
2 结果
2.1 工程菌形态与生长速率的观察
在LB(AMP+)固体平板上生长的各代工程菌菌落呈典型的大肠杆菌菌落形态:白色,外表湿润光滑,直径1 ~1.5 mm 的圆形隆起;无杂菌生长。对各代工程菌进行革兰染色,光镜下均为革兰阴性、两端呈钝圆的短小杆菌,与原代工程菌形态相同。原代和第10、20、30、40 和50 代菌株在LB液体培养基中培养12 h时的生长情况见表1,结果显示工程菌株在传代过程中生长情况没有显著差别。

表1 工程菌株在不同传代次数时的生长量
2.2 工程菌连续传代质粒稳定性
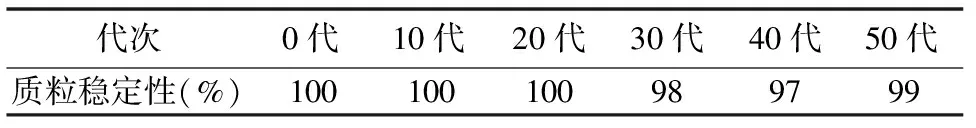
表2 工程菌株传代时的质粒稳定性
工程菌株在有AMP选择压力情况下,在LB 固体平板上传代过程中质粒稳定性接近100%(表2)。
2.3 目的基因的PCR 鉴定
以提取的各代菌种重组质粒作为模板,对肝靶向干扰素基因进行PCR 特异扩增, 结果(图1)显示各代的PCR 结果与0 代一致,均在约570 bp 处有清晰的条带,大小与目的片段相符,说明各代工程菌中的肝靶向干扰素基因未丢失。
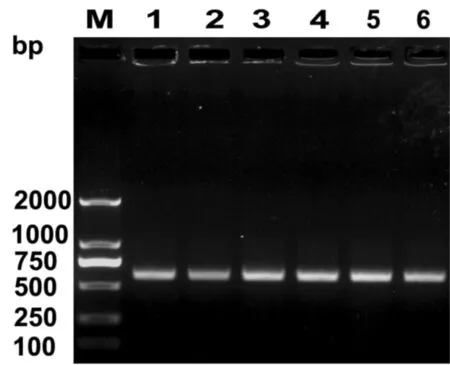
图1 IFN-CSP 的PCR扩增
2.4 质粒酶切鉴定
琼脂糖电泳显示第0、10、20、30、40、50 代工程菌的重组质粒经KpnI和Hind Ⅲ 双酶切后,均可以切出约570 bp 的片段,与原始工程菌的目的基因大小一致 (图2) ,进一步说明了各代工程菌中的肝靶向干扰素基因未丢失。对第50代工程菌进行DNA 序列测定,结果显示插入的DNA 序列与原始序列一致,没有发生突变。
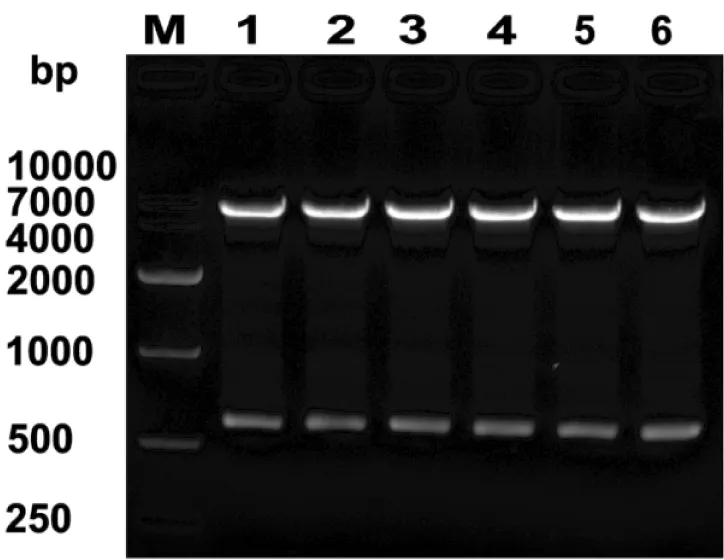
图2 重组质粒的酶切图谱
2.5 肝靶向干扰素在工程菌株中的表达
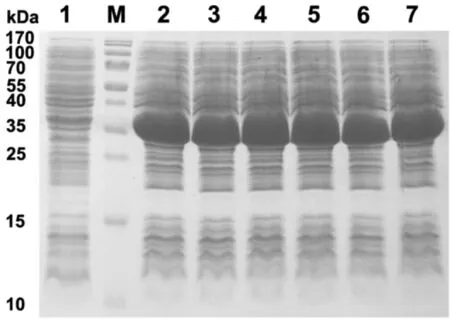
图3 诱导表达产物的SDS-PAGE分析
表达产物经15% SDS-PAGE电泳染色后,可见在大小约39 kDa (因载体pET32a具有Trx标签蛋白,分子量约为17.6 kDa;而肝靶向干扰素分子量约为21.5 kDa) 处出现蛋白条带,原代菌种和传代10,20,30,40,50代后的菌种在总蛋白电泳中所有蛋白条带位置和表达水平无明显差别 (图3) 。
3 讨论
基因工程菌株的遗传稳定性在整个生产质控过程中起到关键的作用,是高水平发酵的基本条件,直接影响重组蛋白的表达、纯化乃至产业化生产[13]。国内外学者通过从不同角度研究大肠杆菌、酵母菌等不同类工程菌的遗传稳定性发现基因工程菌中重组质粒的不稳定性一般表现为两种形式,一种是分离分配不稳定性,一般在细胞分裂时引起,指整个重组质粒分子从受体细胞中丢失或逃逸的现象,这一种是质粒丢失的主要原因;另一种是结构序列不稳定性,即重组质粒上某一区域的序列发生缺失、修饰、重排和插入等现象导致的表观生物学功能丧失,这种对质粒主要遗传标记丢失影响较小[14,15]。遗传稳定性高,目的基因量多,表达产物含量也高;反之,遗传稳定性低时,目的基因量少,基因产物的量也少[16]。因此,菌种的遗传稳定性差异决定了菌种的保存方式和传代次数,具有重要的实际指导意义。
本实验室构建冻存-80℃ 冰箱中的重组工程菌E.coliBL21/pET32a-IFN-CSP,经连续划线传代50 代以后,仍然保持与原代菌株具有相同的菌落大小和形态,显微镜下特征亦无明显差异,表明该工程菌株传代后形态特征是稳定的。工程菌株连续传代质粒稳定性接近100%,在LB液体培养基中的生长情况基本一致,表明该工程菌株具有质粒的分裂稳定性。PCR鉴定、双酶切电泳鉴定和测序结果显示该工程菌株菌中携带的重组质粒在传代前后的限制性内切酶图谱没有发生变化,基因序列亦未突变,表明该工程菌株具有质粒的结构稳定性。经诱导培养后,目的蛋白在原代和第10、20、30、40、50代中都有表达,且表达量没有明显差别,它们在SDS-PAGE中的带型也基本一致,表明该工程菌株具有表达稳定性。
综上所述,本研究通过对工程菌E.coliBL21/pET32a-IFN-CSP连续传代50 代后生长特性,pET32a-IFN-CSP质粒的PCR鉴定、酶切图谱、测序和菌株蛋白表达水平的分析,结果显示重组工程菌经50次传代后以上指标均与原始菌株相同,证明该工程菌株遗传稳定性良好,为其将来应用于大规模的发酵提供了有利保障,也为重组肝靶向干扰素的应用开发奠定了基础。
[1]董晓弟,刘兆普,刘海燕,等. 重组别藻蓝蛋白β亚基(His-βAPC)表达菌株遗传稳定性的研究[J]. 生物学杂志,2011,28(4): 1-3.
[2]王宏华,凌红丽,侯竹美,等. 鸡γ-干扰素基因重组质粒在工程菌株中的稳定性研究[J]. 微生物学通报,2008,35(7): 1055-1058.
[3]Akbar S M,Hiasa Y,Mishiro S,et al. Treatment of hepatitis B virus-infected patients: utility of therapeutic recommendations in developing countries[J]. Expert Opin Pharmacother,2009,10(10): 1605-1614.
[4]Lu J J,Chen E Q,Yang J H,et al. A mutation in the interferon regulatory element of HBV may influence the response of interferon treatment in chronic hepatitis B patients[J]. Virol J,2012,9:10.
[5]Zhu Y,Qin B,Xiao C,et al. Cell-type specific interferon stimulated gene staining in liver underlies response to interferon therapy in chronic HBV infected patients[J]. Dig Dis Sci,2012,57:2355-2361.
[6]Stel′makh V V. Possibilities of using interferon-induction therapy during latent HBV infection[J]. Eksp Klin Farmakol,2011,74:35-39.
[7]Ren S,Yu H,Zhang H,et al. Polymorphisms of interferon-inducible genes OAS associated with interferon-alpha treatment response in chronic HBV infection[J]. Antiviral Res,2011,89:232-237.
[8]Okunev O V,Gil′chuk P V,Irodov D M,et al. Production and characterization of the single chain antibodies against human alpha2b-interferon[J]. Ukr Biokhim Zh,2005,77(5): 106-115.
[9]Sonneveld M J,Rijckborst V,Cakaloglu Y,et al. Durable hepatitis B surface antigen decline in hepatitis B e antigen-positive chronic hepatitis B patients treated with pegylated interferon-alpha2b: relation to response and HBV genotype[J]. Antivir Ther,2012,17:9-17.
[10]Robertson R T,Baratta J L,Haynes S M,et al. Liposomes incorporating a plasmodium amino acid sequence target heparan sulfate binding sites in liver[J]. J Pharm Sci,2008,97(8): 3257-3273.
[11]Longmuir K J,Haynes S M,Baratta J L,et al. Liposomal delivery of doxorubicin to hepatocytes in vivo by targeting heparan sulfate[J]. Int J Pharm,2009,382(1-2): 222-233.
[12]Tsai M S,Baratta J L,Longmuir K J,et al. Binding patterns of peptide-containing liposomes in liver and spleen of developing mice: comparison with heparan sulfate immunoreactivity[J]. J Drug Target,2011,19(7): 506-515.
[13]冯秀萍,于乐洋,闫东梅,等. 重组人胸腺素β16 工程菌株的遗传稳定性研究[J]. 中国生化药物杂志,2009,30(1): 10-13.
[14]肖 硕,洪华珠,彭建新. 基因工程菌中重组质粒的稳定性研究进展[J]. 生物技术通报,2008,4: 9-12.
[15]高红伟,李素波,金泗虎,等. 重组A-N-乙酰半乳糖胺酶工程菌菌种稳定性研究[J]. 中国输血杂志,2011,24(3): 197-200.
[16]高红伟,李素波,艾 雪,等. 新型基因重组α-半乳糖苷酶工程菌菌种稳定性研究[J]. 生物技术通报,2011,7: 201-204.
