深海产低温脂肪酶菌株Dspro004的诱变育种
2013-12-21李福英何雄飞曾润颖产竹华
杨 帆,李福英,何雄飞,曾润颖,产竹华
(国家海洋局海洋生物遗传资源重点实验室 国家海洋局第三海洋研究所,厦门 361005)
脂肪酶(Lipase,EC 3.1.1.3)也叫三酰甘油脂水解酶,是一类重要的酯键水解酶,能够在油-水界面上催化天然油脂(甘油三脂)生成游离的脂肪酸、甘油和甘油单酯或甘油二酯,广泛存在于动物、植物和微生物中[1-3]。现代工业中脂肪酶经常被应用于油脂水解[4]、食品加工[5]、食品品质改良[6,7]、疾病诊断[8]、催化药物合成[9-11]、皮革生产、可生物降解的无污染洗涤剂的研发[12]和生物柴油的生产等方面[13, 14]。在诸多来源的脂肪酶中,微生物脂肪酶是工业用脂肪酶的重要来源,是生物技术和有机化学应用中使用最为广泛的酶类之一。其原因在于微生物种类多、繁殖快,易发生遗传变异,产生的脂肪酶具有比动植物脂肪酶作用更广的 pH 值、反应温度范围以及底物专一性;而且微生物来源的脂肪酶一般都是分泌性的胞外酶,适合于工业化大生产和样品提纯[15]。随着工业的发展与人类需求的不断扩大,得到一株高产、性质特殊的产脂肪酶菌株越来越成为脂肪酶应用研究开发的关键。在加紧寻找自然界中的优秀产酶菌株之外,诱变育种也是获得高产菌株的有效手段。
诱变育种是使用物理或化学诱变剂处理菌株,促进其突变率大幅提高,然后采用简便、快速和高效的筛选方法,从中挑选少数符合育种目的的突变株,达到提高代谢产物的产量、改进产品质量、扩大品种和简化生产工艺的目的[16-18]。本文从一株深海产低温脂肪酶的菌株Dspro004出发,通过紫外诱变得到了高产菌株,并进行了该突变菌株的遗传稳定性的测试,为该菌株今后的工业生产奠定了良好的实验基础。
1 材料与方法
1.1 菌株
本文实验采用的野生菌株Dspro004分离自东太平洋(107°38′ 23″ W,13°19′ 40″ N)水深4950 m的深海沉积物,采用脂肪酶筛选培养基筛选获得并保存于本实验室。
1.2 培养基
1)LB培养基:Yeast Extract 0.5%,Tryptone 1%,NaCl 1%。
2)脂肪酶筛选培养基:猪油1%,Yeast Extract 0.5%,琼脂1.5%,由原位海水配制。
三丁酸甘油酯筛选培养基:三丁酸甘油酯1%,Yeast Extract 0.5%,琼脂1.5%,由原位海水配制。
1.3 紫外诱变初筛
1.3.1 诱变剂量的确定
将Dspro004菌种接种至液体LB培养基中,绘制生长曲线并确定其对数期。取对数生长期的菌液,经5000 r/min离心5 min,弃去上清液。用灭菌的生理盐水(0.85% NaCl)溶液洗涤菌体两次以除去培养基成分,继续用生理盐水调节菌液OD600至0.6~0.7,取5 mL稀释后的菌液至直径60 mm的无菌培养皿中进行紫外照射诱变。紫外照射条件为:输出功率2×6 W,距离30 cm。紫外灯预热20 min后,放入菌液,在黑暗条件下进行紫外照射,同时进行磁力搅拌。照射不同时间后,立刻取出500 μL菌液在20℃下避光孵育30 min。在红光环境中,用生理盐水进行梯度稀释,取10-4,10-5两个稀释度的菌液各100 μL,均匀涂布LB平板,每个梯度设置3个平行样。按相同方法对未经照射的出发菌株进行孵育和稀释涂布,以作为对照平板。涂布完毕后将平板放置在20℃下避光培养1~4 d,待菌落长出后计数菌落,统计致死率[19]。
1.3.2 诱变筛选
在诱变预实验结果的基础上,选择合适的致死率所对应的诱变时间,进行紫外照射。之后避光孵育30 min,并用灭菌生理盐水进行梯度稀释,取10-5稀释度的菌液100 μL在三丁酸甘油酯筛选平板上进行均匀涂布。置于15℃下避光培养3~5 d,根据透明圈大小筛选突变菌株。
1.4 紫外诱变复筛与遗传稳定性测试
挑选透明圈较大的菌落用液体LB培养基在15℃、200 r/min的条件下振荡培养48 h,取发酵液上清,利用pNPP法测定脂肪酶活力。将复筛平板上的高活力突变菌株与出发菌株一起,进行连续传代培养,每一代进行保种并测定酶活。其中每个菌株均设3个平行样,取平均值作为结果。各代均以出发菌株作为对照,以确定突变菌株的高产能力是否稳定遗传。
1.5 pNPP法测定脂肪酶活力[20]
脂肪酶作用于底物(p-NPP) 后会产生黄色的对硝基酚p-Nitrophenol(p-NP),该产物在405nm处具有光吸收值。通过该光谱法可以检测培养基中脂肪酶的活力。脂肪酶活单位U定义为:1 min酶解底物释放出1 μmol的p-Nitrophenol所需的酶量为一个酶活单位。
配制终浓度为100 μmol/L的p-Nitrophenyl palnitate溶液,配制时先用5 mL的异丙醇溶解pNPP粉末,再用0.05 mol/L,pH9.0的Tris-HCl定容至100 mL。向2955 μL底物溶液中加入15μL(0.1 μg/μL)脂肪酶液,在25℃下反应10 min后加入30μL的NaOH(5 mol/L)溶液终止反应,测定OD405值。
2 实验结果
2.1 Dspro004野生菌的紫外诱变初筛
通过对野生菌株不同时间的紫外诱变菌液的涂板计数,得到对应诱变时间的致死率结果(图1)。致死率在70%~80%之间时,产生正突变的几率较高,更有利于进一步筛选[21]。涂板计数结果表明:当功率为12W,照射距离为30 cm,照射时间为20 min时,致死率达到81.3%,因此选定20 min为最佳照射时间。稀释度为10-4时可以看清菌落,但是透明圈分辨起来困难,故而稀释度为10-5时效果最佳。
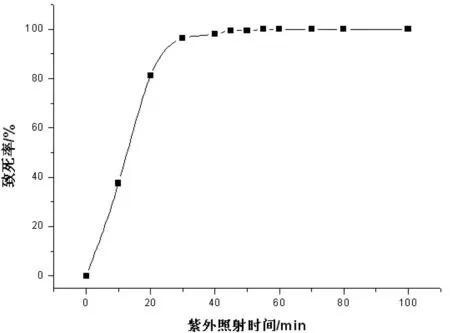
图1 Dspro004菌株紫外诱变效果
将紫外照射后的菌液在三丁酸甘油筛选平板上均匀涂布,20℃下培养3 d出现透明圈。统计菌落数,与出发菌株相比,致死率约为79.1%,符合正向突变有利筛选条件。以出发菌株为对照,挑选出90株透明圈/直径比(HE)值均大于对照的变异菌株,依次编号为UM1~UM90。
2.2 Dspro004高产脂肪酶突变菌株复筛与遗传稳定性
从上述平板中挑选诱变后HE值较大的菌落UM3、UM5、UM14、UM16、UM32、UM49、UM55在液体LB培养基中进行15℃、48 h的摇培,并取发酵液测定脂肪酶活力。结果表明(图2),相对于出发菌株,菌株UM3活力可达到2560 U/mg,相对出发菌株提高33.9%,活力提高最明显。
选取菌株UM3进行遗传稳定性试验,与出发菌株同时进行了20代传代培养和酶活测定(表1)。各代菌体发酵液的平均酶活力相对出发菌株酶活保持在134%~139%之间,酶活力保持在2540~2710 U/mg,并且同代无显著差异,表明该菌株的产酶具有较好的遗传稳定性。

图2 Dspro004突变菌株复筛结果

表1 UM3突变株的遗传稳定性实验
2.3 菌株UM3脂肪酶酶学性质分析
2.3.1 温度对酶活性的影响
分别测定菌株UM3脂肪酶在不同温度下(5℃~70℃)水解底物的活力,以研究其最适作用温度。结果表明,酶在20℃~30℃范围具有较高的酶活力,酶的最适反应温度为30℃(图3),表现出明显的冷适应特征,因此该酶可确定为低温脂肪酶,后续实验脂肪酶活力测定均在30℃下进行。

图3 温度对脂肪酶活力的影响
2.3.2 pH值对酶活性的影响
用磷酸氢钠-柠檬酸钠(pH值4~8)、Tris-HCl(pH值7~8)、NaHCO3-Na2CO3(pH值8~10)、Na2HPO4-NaOH(pH值11)缓冲液配制pNPP底物溶液,测定不同pH值下脂肪酶的酶活力。实验表明(图4),酶在pH值7.5~9.5的范围具有较高的酶活力,酶的最适反应pH值为8.5,表明该酶为碱性脂肪酶。

图4 pH值对脂肪酶活力的影响
2.3.3 酶的热稳定性
将酶液放置不同温度下保温一定时间后取出酶液,测定残余脂肪酶的活力,在最适温度下反应。实验结果表明(图5),该脂肪酶在20℃~30℃具有良好的热稳定性,20℃保持12 h后仍具有80%以上的活力,30℃下保持12 h后酶活力仍有70%。40℃保温2 h活力剩余72%,4 h仅余6%。50℃以上0.2 h基本丧失酶活。

图5 温度对脂肪酶稳定性的影响
2.3.4 酶液对pH值的耐受性

图6 pH值对脂肪酶稳定性的影响
分别将酶液加入pH值6~9的磷酸盐缓冲液冰浴中保存一定时间后,将酶液在最适反应温度下测定残余酶活力。结果表明,在pH值8条件下保持12 h后残余酶活力仍有80%,在pH值7条件下保持12 h后残余酶活力为75%,在pH值6和pH值9条件下稳定性较差,保持12 h后分别剩余51%和46%(图6)。
3 结论
与传统的诱变育种相比,建立在现代基因操作技术基础上的基因改造更为精确,但诱变育种往往能带来更为复杂的连锁反应结果,且更简便易行、快速、收效大,因而在实际工业应用中被更多地采用。紫外诱变安全简便,对环境毒害作用小,不易回复突变,因此本文采用紫外照射作为诱变剂筛选脂肪酶高产菌株。选择致死率为81%的诱变剂量,获得了酶活力最高达到2710 U/mg的突变株,产酶活力比出发菌株提高了约39%。虽然这与工业生产菌株的4000~6000U/mg[22]还有一定差距,希望通过进一步的发酵条件的优化和代谢的调控来提高脂肪酶产量。
对于生产菌株来说,必须要具备稳定的遗传性状才能在工业生产上广泛应用。本文所筛选到的菌株UM3突变株连续20代继代培养结果表明,该突变株的遗传性状稳定,为未来该菌株的实际工程应用奠定了良好的实验基础。
[1]Kaushik R,Saran S,Isar J,et al. Statisticaloptimization ofmedium components and growth conditions by response surfacemethodology to enhance lipase production by Aspergillus carneus[J]. JournalofMolecular CatalysisB: Enzymatic,2006,40: 121-126.
[2]Macrae A,Hammond R. Present and future applications of lipases[J]. Biotechnology & Genetic Engineering Reviews,1985,3: 193-217.
[3]Shimizu S,Nakano M. Structural characterization of tracylglycerol in several oils containing gamma-linolenic acid[J]. Bioscience,Biotechnology,and Biochemistry,2003,67(1):60-67.
[4]Slim C,Ahmed F,Nabil M,et al. Crab digestive lipase acting at high temperature: purification and biochemical characterization[J]. Biochimie,2007,89(8):1012-1018.
[5]苗君莅,张锋华,孟令杰,等. 脂肪酶酶解稀奶油产物对牛奶的增香作用[J]. 江苏农业科学,2012,40(4): 281-283.
[6]钱 露,李庆龙,王 晶. 国产脂肪酶在面条专用粉中的应用初探[J]. 现代面粉工业,2012,3: 21-25.
[7]韦 伟,冯凤琴. sn-1,3位专一性脂肪酶在食品中的应用[J]. 中国粮油学报,2012,27(2): 122-126.
[8]杭永伦,黄远帅. 血清脂肪酶测定对急性胰腺炎的诊断价值[J]. 检验医学,2012,27 (6): 491-494.
[9]Liu Y,Wang F,Tan T. Cyclic ressolution of racemic ibuprofen via coupled efficient lipase and acid-base catalysis[J]. Chirality,2009,21(3): 349-353.
[10]Yin C,Liu T,Tan T. Synthesis of vitamin A esters by immoblized Candida sp. lipase in organic media[J]. Chinese Journal of Chemical Engineering,2006,14(1):81-86.
[11]潘志杰,陈小娥,王卫飞,等. 脂肪酶催化鱼油醇解富集EPA和DHA的研究[J]. 油脂工程,2012,1: 40-43.
[12]Hemachander C,Puvanakrishnan R. Lipase from Ralstonia pickettii as additive in laundry detergent formulations[J]. Process Biochemistry,2000,35(8):809-814.
[13]谭天伟,鲁吉珂,聂开立,等. 酶法合成生物柴油工业化研究进展[J]. 生物工程学报,2010,26(7):903-906.
[14]李 艾,郝玉翠,金昌磊. 固定化脂肪酶催化大豆油制备生物柴油的工艺条件研究[J]. 唐山学院学报,2012,25(3): 31-34.
[15]叶 慧,雷建平,左建军,等. 微生物脂肪酶概况及其动物营养效应的研究进展[J]. 饲料工业,2012,33 (12): 37-40.
[16]施巧琴,吴松刚,工业微生物育种学[M]. 北京,科学出版社,2009.
[17]马 琼.米曲霉纤维素酶高产菌株的诱变育种研究[J]. 食品化学,2009,30(19):2007-2009.
[18]闵伟红,林小秋,冯 琦,等.蛋氨酸高产菌株诱变育种[J]. 食品化学,2008,29(11):456-459.
[19]诸葛健,沈 微,方慧英,等. 工业微生物实验与研究技术[M]. 北京:科学出版社,2007: 213- 219.
[20]Rashid N,Shimada Y,Ezaki S,et al. Low-temperature lipase from psychrotrophic Pseudomonas sp. strain KB700A[J]. Applied and Environmental Microbiology,2001,67(9): 4064-4069.
[21]张树政. 酶制剂工业(下册). 脂肪酶[M]. 北京:科学出版社,1998: 655-670.
[22]汪小锋,王 俊,杨江科,等. 微生物发酵生产脂肪酶的研究进展[J]. 生物技术通报,2008,4: 47-53.
