激活LXR降低脑Aβ与胆固醇及相关基因转录的关系
2013-12-21侯连国姜玲玲
石 芸, 姚 敏, 侯连国, 李 静, 杨 原, 姜玲玲
(1.河北医科大学生物化学与分子生物学研究室, 石家庄 050017;2.河北省人民医院, 石家庄 050017)
β-淀粉样蛋白(beta-amyloid peptide,Aβ)生成增多和在脑内的沉积是阿尔茨海默病(alzheimer’s disease,AD)发生发展的关键因素。因此,探究Aβ生成的影响因素,对防治AD有着十分重要的意义。
研究表明,Aβ的产生和沉积与脑胆固醇的代谢有密切的关系。由于血脑屏障的存在,脑细胞内胆固醇的水平只与其原位合成量和转出量有关[1]。羟甲基戊二酸单酰辅酶A还原酶(3-hydroxy-3-methylglutaryl CoA redactase,HMG-CoAR)是胆固醇合成的限速酶,其活性决定了脑胆固醇的合成量。用他汀类药物特异性地抑制HMG-CoAR的活性,降低胆固醇的合成,可明显降低神经细胞的Aβ水平[2]。肝X受体(liver X receptor,LXR)是一种核受体,与其相应的配体结合活化后,可上调靶基因ATP盒转运体A1(ATP binding cassette transporter A1,ABCA1)的表达,增加细胞内胆固醇向细胞外载脂蛋白的转移,降低胞内胆固醇水平[3]。用LXR的激活配体处理转基因的AD模型小鼠和小鼠海马细胞后,ABCA1被明显诱导表达,脑胆固醇降低,有效地降低了Aβ的水平[4, 5]。已知,正常鼠与转基因鼠有着不同的基因背景,LXR的激活配体对正常鼠是否有同样的效果?另外,脑中胆固醇是经神经元细胞内胆固醇-24S-羟化酶(cholesterol-24S-hydroxylase,CYP46)转化为24S-羟基胆固醇后通过血脑屏障出脑的[6, 7]。而细胞胆固醇通过胞内的ABCA1、ABCG1转出细胞外,呈递给apoE等载脂蛋白后[8],只在脑内转移[9, 10]。因此,上述LXR被激活上调ABCA1时,脑总胆固醇的降低是否与CYP46的转录上调有关?未见报道。
为此,本实验以C57BL/6J小鼠为实验对象,用人工合成配体TO901317激活LXR,观察脑Aβ和胆固醇水平以及CYP46 mRNA表达的变化,探讨LXR激活对脑胆固醇和Aβ水平的影响,为寻找预防AD的药物提供实验依据。
1 材料和方法
1.1 动物
8~10周龄成年雄性C57BL/6J小鼠20只,体重20~25 g,由北京实验动物中心提供。
1.2 主要试剂
TO901317购自cayman公司;Trizol购自Invitrogen;反转录试剂盒购自Promega;Taq DNA聚合酶购自鼎国生物公司;总胆固醇测定试剂盒购自上海荣盛生物技术有限公司;Aβ放免测定试剂盒购自北京301放免研究所;其它试剂为国产分析纯或优级纯。所用引物由上海捷倍思基因技术有限公司根据设计合成,见表1。

表1 引物序列
1.3 主要方法
1.3.1 动物分组及取材
将小鼠随机分为2组:对照组(Con组,10只)和激动剂组(TO组,10只)。将LXR激动剂TO901317溶于二甲基亚砜中(25 mg/mL),用1%羧甲基纤维素按体积比1∶150稀释后,予以TO组鼠灌胃(20 mg/kg/d)。Con组鼠给予不含TO901317的其它组分相同的上述液体灌胃。小鼠连续灌胃7 d后,禁食不禁水一晚,10%水和氯醛麻醉,断头处死,取脑组织于液氮冷冻后,-70℃超低温冰箱保存备用。
1.3.2 脑组织Aβ的测定
[11]的方法,称取80 mg左右的脑组织,加入1200 uL 70%甲酸,冰浴匀浆,匀浆液在4℃,12000 r/min离心30 min,取上清液400 uL,加入1 mol/L Tris-HCl 3.6 mL (pH值8.0)稀释10倍,充分混匀,4℃,12000 r/min离心30 min,去除沉淀,用于Aβ的测定。用试剂盒测定其Aβ含量后,用改良Lowry法定量总蛋白,算出每毫克总蛋白内所含的Aβ的量,用pg/mg表示。
1.3.3 脑组织中胆固醇含量的测定
准确称取脑组织,按1 g组织加29 mL氯仿/甲醇(2∶1 V/V)溶液的比例,冰浴匀浆,匀浆液3000 r/min离心5 min,留取上清液;沉淀中再加氯仿/甲醇(2∶1 V/V)溶液(第一次用量的2/3量),匀浆,3000 r/min离心5 min后留取上清,合并两次留取的上清液。取适量上清液,按2 mL上清加入1 mL含2% Triton X-100的氯仿溶液的比例混匀,60℃水浴蒸干,将蒸干样品复溶于三蒸水中,用于胆固醇的测定。按试剂盒说明书测定胆固醇含量后,计算出每克脑组织中胆固醇的含量,用mg/g表示。
1.3.4 RT-PCR
采用Trizol法分离纯化脑组织的总RNA,分光光度法测定计算提取的总RNA含量及浓度。用随机引物进行逆转录,以逆转录的单链cDNA为模板进行PCR,总反应体积25 μL,其中10×PCR buffer 2.5 μL,10 mmol/L dNTP Mix 0.5 μL,Taq DNA聚合酶2 U,cDNA 1.5 μg,引物 0.5 μmol/L。扩增条件为:95°C 预变性2 min,94°C变性1 min,55°C 45 s (for β-actin),or 62°C 45 s(for ABCA1),or 59°C 45 s(for CYP46),72°C 60 s,30个循环,72°C 延伸5 min。然后,取RT-PCR产物8 μL,在2%琼脂糖凝胶上电泳,70 V 40 min,凝胶图像成像系统拍摄保存实验结果,凝胶图像分析系统(江苏捷达科技发展公司)分析各目的基因与β-actin基因条带吸光度的比值,以此作为目的基因的相对表达量。
1.3.5 统计学处理

2 结果
2.1 小鼠脑LXR下游基因ABCA1 mRNA表达的变化
激动剂组(TO)ABCA1的mRNA相对表达量比对照组(Con)明显增高(P<0.01),见图1,表明LXR被激动剂激活。

图1 RT-PCR检测激动剂组和对照组大鼠脑中LXR下游基因ABCA1 mRNA的表达水平
2.2 小鼠脑Aβ含量的变化
激动剂组(TO)Aβ的含量较对照组(Con)有所降低(P<0.05),见图2,提示激活LXR有效地降低了小鼠脑Aβ的含量。
2.3 小鼠脑总胆固醇含量的变化
激动剂组(TO)的总胆固醇含量较对照组(Con)降低(P<0.05),且脑总胆固醇含量与Aβ的含量呈正相关(r=0.57,P<0.05),见图3,表明激活LXR引起的Aβ含量减少与脑胆固醇的降低有关。

图2 放免法检测激动剂组和对照组大鼠脑中Aβ的水平

图3 A. 酶法检测激动剂组和对照组大鼠脑中胆固醇的含量;B. 大鼠脑胆固醇和Aβ含量的相关性分析
2.4 小鼠脑胆固醇-24S-羟化酶CYP46 mRNA的表达变化
激动剂组(TO)CYP46 mRNA的相对表达量较对照组(Con)明显增高(P<0.01),见图4,CYP46 mRNA的相对表达量与脑胆固醇的含量呈负相关(r=-0.87,P<0.01)。表明LXR的激活伴随CYP46 mRNA表达增加,后者与胆固醇的降低有关。
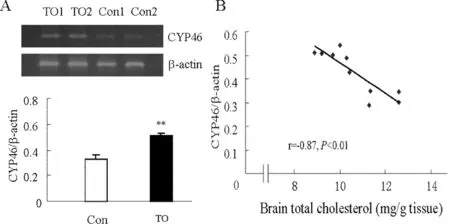
图4 A. RT-PCR检测激动剂组和对照组大鼠脑中CYP46 mRNA的表达水平;B. 大鼠脑胆固醇和CYP46 mRNA表达的相关性分析
3 讨论
Aβ由β-淀粉样前体蛋白(β-amyloid precursor protein,AβPP)经β-,γ-位点的AβPP内切酶催化裂解产生。AβPP的β-位点以及β-位点的内切酶位于细胞膜的脂筏中[12]。胆固醇是细胞膜、神经髓鞘的重要组成成分,具有调节细胞膜的通透性、流动性以及物质的转运等功能。减少细胞的胆固醇可以提高膜流动性,从而减少β-位点内切酶的活性,有效地减少Aβ的生成和聚集沉积量[13]。激活转基因的AD模型小鼠LXR后,脑胆固醇水平降低,脑Aβ降低,缓解了AD的病理过程[14]。与上述报道一致,本实验中,我们用TO901317激活正常小鼠LXR后,脑内胆固醇与Aβ也被明显降低。
由于胆固醇不能自由通过血脑屏障,脑组织的胆固醇几乎都是由神经元和神经胶质细胞自身合成[1]。脑内64%以上的胆固醇也需在神经元细胞内经CYP46将其转化为24S-羟基胆固醇后通过血脑屏障出脑[6]。而脑细胞的胆固醇通过胞内的ABCA1、ABCG1转出细胞外,呈递给apoE等载脂蛋白,只在脑内的转移[8-10],或转到神经元细胞被羟化成24S-羟基胆固醇后通过血脑屏障,或是转到需要胆固醇的部位[1]。本实验结果显示,TO901317激活LXR后,不仅LXR的靶基因ABCA1转录增强,CYP46的转录也同时明显上调,并且CYP46 mRNA的相对表达量与脑总胆固醇含量呈负相关。这表明,伴随LXR激活所发生的脑胆固醇下降,与胆固醇经ABCA1出胞,以及经24S-羟胆固醇途径出脑的机制同时被上调有关。证明,CYP46有可能在激活LXR降低脑胆固醇,降低Aβ的过程中发挥重要作用。
参考文献:
[1]Dietschy J M,Turley S D. Cholesterol metabolism in the brain[J]. Curr Opin Lipidol,2001,12(2):105-112.
[2]Shinohara M,Sato N,Kurinami H,et al. Reduction of brain beta-amyloid (Abeta) by fluvastatin,a hydroxymethylglutaryl-CoA reductase inhibitor,through increase in degradation of amyloid precursor protein C-terminal fragments (APP-CTFs) and Abeta clearance[J]. J Biol Chem,2010,285(29):22091-22102.
[3]Repa J J,Li H,Frank-Cannon T C,et al. Liver X receptor activation enhances cholesterol loss from the brain,decreases neuroinflammation,and increases survival of the NPC1 mouse[J]. J Neurosci,2007,27(52):14470-14480.
[4]Koldamova R P,Lefterov I M,Staufenbiel M,et al. The liver X receptor ligand T0901317 decreases amyloid beta production in vitro and in a mouse model of Alzheimer's disease[J]. J Biol Chem,2005,280(6):4079-4088.
[5]Cui W,Sun Y,Wang Z,et al. Activation of Liver X Receptor Decreases BACE1 Expression and Activity by Reducing Membrane Cholesterol Levels[J]. Neurochem Res,2011,36(10):1910-1921.
[6]Russell D W,Halford R W,Ramirez D M,et al. Cholesterol 24-hydroxylase: an enzyme of cholesterol turnover in the brain[J]. Annu Rev Biochem,2009,78:1017-1040.
[7]Bjorkhem I,Lutjohann D,Diczfalusy U,et al. Cholesterol homeostasis in human brain: turnover of 24S-hydroxycholesterol and evidence for a cerebral origin of most of this oxysterol in the circulation[J]. J Lipid Res,1998,39(8): 1594-1600.
[8]Pfrieger F W. Outsourcing in the brain: do neurons depend on cholesterol delivery by astrocytes[J]? Bioessays,2003,25(1):72-78.
[9]Björkhem I,Meaney S. Brain cholesterol: long secret life behind a barrier[J]. Arterioscler Thromb Vasc Biol,2004,24(5):806-815.
[10]Björkhem I. Crossing the barrier: oxysterols as cholesterol transporters and metabolic modulators in the brain[J]. J Intern Med,2006,260(6):493-508.
[11]Fitzgerald M L,Morris A L,Rhee J S,et al. Naturally occurring mutations in the largest extracellular loops of ABCA1 can disrupt its direct interaction with apolipoprotein A-Ⅰ[J]. J Biol Chem,2002,277:33178-33187.
[12]Hattori C,Asai M,Onishi H,et al. BACE1 interacts with lipid raft proteins[J]. J Neurosci Res,2006,84(4):912-917.
[13]Ehehalt R,Keller P,Haass C,et al. Amyloidogenic processing of the Alzheimer beta-amyloid precursor protein depends on lipid rafts[J]. J Cell Biol,2003,160(1):113-123.
[14]Fitz N F,Cronican A,Pham T,et al. Liver X receptor agonist treatment ameliorates amyloid pathology and memory deficits caused by high-fat diet in APP23 mice[J]. J Neurosci,2010,30(20):6862-6872.
