小鼠脑组织中组胺含量的HPLC-UV检测
2013-12-01马张庆洪宗元
许 涛,陶 芳,方 浩,马张庆,洪宗元
(皖南医学院 定量药理研究所,药理学教研室,安徽 芜湖 241002)
组胺(histamine)是中枢神经系统中的一种重要神经递质,组胺能神经元胞体位于下丘脑结节乳头核(tuberomammillary nucleus,TMN)[1-2]。组胺由组氨酸(histidine)在组氨酸脱羧酶(histidine decarboxylase)作用下脱羧生成,合成的组胺主要被组胺-N-甲基转移酶(histamine-N-methyltransferase)代谢生成 t-甲基组胺(t-methylhistamine)而失活[3]。组胺作为中枢神经系统中的一种递质,在很多中枢活动中起着重要的调节作用,如睡眠-觉醒、学习记忆、摄食以及体温调节等[4-7]。检测不同生理状态下脑内组胺含量的变化是研究组胺调节中枢活动的重要手段之一[8-10]。组胺含量的检测主要采用高效液相色-谱柱前衍生荧光检测法[11]和高效液相色谱-柱后衍生荧光检测法[12]。但高效液相色谱-荧光检测法在样品前处理时操作繁琐,且要有专门的反应装置,对仪器设备的要求较高,而高效液相色谱-紫外检测法无需特殊反应装置,操作较简单,对设备无特殊要求,因而应用更加广泛。本实验旨在建立一种测定小鼠脑组织中组胺含量的柱前衍生高效液相色谱-紫外检测法,为检测脑组织组胺含量提供更为简单快捷的方法。
1 材料与方法
1.1 动物 8只昆明种小鼠,雄性,10~12周龄,体质量(22±2)g,分笼饲养,室温(25±2)℃,湿度 <60%,在12 h/12 h明暗周期光控环境饲养1周后实验。动物可自由进食、进水,实验前禁食12 h。
1.2 药品、试剂及主要仪器 组胺标准品(日本和光制药工业株式会社,批号 KLP3326,含量97%)。乙腈为色谱纯,乙酸铵、高氯酸、碳酸氢钠等为分析纯,丹磺酰氯(上海生物工程有限公司,批号:LY0426B1012J,含量 95%)。
Agilent 1100高效液相色谱仪(配有G1312A二元泵,G1316A柱温箱,G1314A紫外检测器,自动进样器和HP Chemstation工作站);PRO 200电动匀浆器;CR22GⅡ高速低温离心机。
1.3 色谱条件 流动相:乙腈∶乙酸铵(0.01 mol/L)=70∶30(v/v),色谱柱:Agilent HC C18,流速:1.0 ml/min,检测波长:254 nm,柱温:30℃,进样量:20 μl。
1.4 标准溶液衍生化 精密称取组胺标准品,分别配制成浓度为 0.1、0.2、0.5、1.0、2.0、10 μg/ml系列标准溶液,取该系列标准溶液100 μl于试管内,依次加入200 μl饱和碳酸氢钠溶液和400 μl丹磺酰氯溶液(10 mg/ml),涡旋混匀后,在室温条件下避光反应60 min。反应完毕后,加入氨水-乙腈混合溶液100 μl,避光静置 30 min,最后用乙腈定容至1.0 ml,在4℃ 条件下离心(8 000 r/min)10 min,取上清液进样分析。
1.5 脑组织匀浆样本的制备与衍生化 小鼠在乙醚麻醉下断头处死后,迅速开颅取出全脑,在冰台上分离出皮层(cortex)、海马(hippocampus)和下丘脑(hypothalamus)[13-14],称重,按 1∶10 体积比加入0.2 mol/L 高氯酸(含 100 μmol/L EDTA-2Na),制备脑组织匀浆。匀浆于0~4℃ 环境中冷却30 min后,在4℃ 条件下离心(15 000 r/min)10 min,分离上清液。取上清液 100 μl进行衍生化,方法同上。
1.6 精密度与准确度 于1 d内在脑组织匀浆样品中添加组胺标准溶液,制成添加浓度分别为0.2、2.0、10.0 μg/ml三种浓度的加标样品各 5 份,并在连续5 d内分别配制上述浓度加标样品各1份,按1.4方法处理后进样检测,按加入量与实测值计算准确度,并计算日内、日间精密度(RSD)。
1.7 回收率测定 配制 0.2、2.0、10.0 μg/ml三种浓度的加标脑组织匀浆和组胺标准品溶液样本,按1.4方法处理后进样检测,以峰面积比计算回收率(n=5)。
2 结果
2.1 色谱行为与回归方程 图1为按上述方法测得的组胺标准品、空白样品及脑组织匀浆的色谱图。由图可见,基线噪音小,组胺分离完全,不受杂质峰干扰,峰形良好,保留时间约为6.1 min。在该试验条件下,以组胺色谱峰面积(у)为纵坐标,以相应组胺浓度(χ)为横坐标,绘制标准曲线。在 0.1~10 μg/ml浓度范围内,组胺峰面积与浓度呈良好的线性关系,其回归方程为 у=7.809 χ -0.04(γ2=0.9993),最低检出限为 0.1 μg/ml。

图1 组胺经衍生后的高效液相-紫外检测色谱图A:组胺标准溶液样品;B:空白样品;C:脑组织匀浆样品Fig 1 Histamine derivatives by HPLC-UVA:Histamine standard reagent;B:Blank sample;C:Homogenized brain sample
2.2 精密度与准确度 按1.6方法测得低、中、高三个浓度平均的日内 RSD为2.34%、3.17%和1.19%,日间 RSD 为 4.13%、2.87% 和 2.10%;准确度分别为 99.32%、102.74% 和 100.08%(n=5)。
2.3 回收率 按 1.6 方法测得 0.2、2.0、10.0 μg/ml三个浓度样本的回收率分别为(78.25±3.84)%、(83.16 ± 4.23)% 和(85.17 ± 4.67)%(n=5),重现性良好。
2.4 小鼠脑组织组胺含量 小鼠脑区中组胺含量各不相同 (F=33.79,P <0.01),其中下丘脑含量最高,约 0.21 μg/g(每克脑组织含 0.21 微克组胺),与皮层和海马相比,差异具有统计学意义(海马:q=9.355,P < 0.01;皮层:q=10.654,P <0.01)。见图 2。
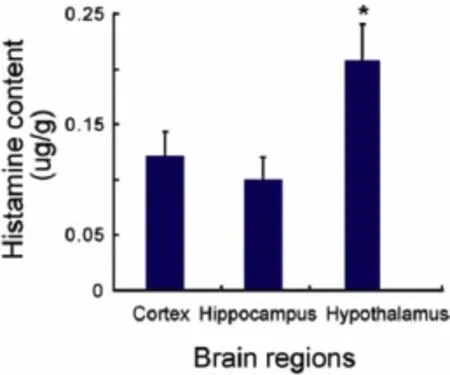
图2 经高效液相-紫外检测法测得的不同脑区内的组胺含量分布图Fig 2 Distribution of the histamine content in the brain regions of mice by HPLC-UVValues are expressed as(n=8);*P < 0.01,vs cortex or hippocampus
3 讨论
本实验在文献[15-16]基础上,经过改进,建立了一种检测脑组织匀浆中组胺含量的高效液相色谱-柱前衍生紫外检测方法,该方法操作简便,检测限高,保留时间短,重现性好,无需特殊设备和试剂,为测定组织匀浆中组胺含量的相关研究提供了实验方法。
由于组胺没有发色基团,不能直接进行检测,因此检测前需要对其进行衍生化,使其生成发色基团,才能在紫外检测器上有响应。较常用的衍生化试剂是邻苯二甲醛,但该试剂不易保存,且其衍生产物不稳定。因此本实验选用丹磺酰氯作为衍生试剂进行实验,结果衍生产物稳定,实验效果较好。
流动相是高效液相色谱检测物质浓度的重要条件之一,良好的流动相可以得到基线稳定,峰形良好,检测峰与杂质峰分离完全。为此在文献[15-16]基础上,我们先采用体积比为 80∶20的乙腈:0.01 mol/L乙酸铵溶液为流动相进行实验,结果发现组胺易受匀浆中杂质干扰,组胺峰与杂质峰有重叠,分离不完全。于是改用体积比为70∶30比例的流动相再行实验,结果组胺分离完全,峰形良好,信噪比低且不受杂质干扰。
对脑组织匀浆样品中添加不同浓度的组胺标准品进行回收率实验,在0.2 ~10.0 μg/ml范围内,组胺的回收率稳定在78.25% ~85.17% 之间,表明本方法重现性好。取加标脑组织匀浆样品衍生溶液分日内和日间重复进样5次,在以上浓度范围内组胺的平均日内RSD< 2.5%,日间RSD<3.03%,准确度在99.32% ~102.74% 之内,表明该方法精密度和准确度高,适合微量组胺的检测。
组胺作为中枢神经系统中的一种递质,通过组胺受体(包括H1、H2、H3等亚型)在中枢活动中起着重要的调节作用。组胺由组胺神经元分泌,组胺神经元胞体集中分布于下丘脑后部的 TMN,神经纤维投射至几乎所有脑区[1-2]。本实验结果显示小鼠下丘脑中组胺含量较皮层和海马为高,这与我们之前用 HPLC-荧光检测法所得的结果一致[10,17],表明本实验所建立的 HPLC-柱前衍生紫外检测方法是可靠的。
[1]HAAS HL,PANULA P.The role of histamine and the tuberomamillary nucleus in the nervous system [J].Nat Rev Neurosci,2003,4(2):121 -130.
[2]BROWN RE,STEVNES DR,HAAS HL.The physiology of brain histamine[J].Prog Neurobiol,2001,63(6):637 -672.
[3]HAAS HL,SERRGREEVA OA,SELBACH O.Histamine in the nervous system[J].Physiol Rev,2008,88(3):1183 -1241.
[4]刘天雅,洪宗元,曲卫敏,等.中枢组胺能神经系统调节睡眠-觉醒机制研究进展[J].药学学报,2011,46(3):247 -252.
[5]黄育文,余建,陈忠.中枢组胺对学习记忆的作用[J].医学与工程,2002,4(1):44 -46.
[6]沈滨,王建军.中枢组胺能系统研究的新进展[J].中国神经科学杂志,2002,18(1):417 -421.
[7]ONDERA K,YAMATODANI A,WATANABE T,et al.Neuropharmacology of the histaminergic neuron system in the brain and its relationship with behavioral disorders[J].Prog Neurobiol,1994,42(6):685-702.
[8]HONG ZY,HUANG ZL,QU WM,et al.An adenosine A2A receptor agonist induces sleep by increasing GABA release in the tuberomammillary nucleus to inhibit histaminergic systems in rats[J].J Neurochem,2005,92:1542 -1549.
[9]HONG ZY,HUANG ZL,QU WM,et al.Orexin A promotes histamine,but not norepinephrine or serotonin,release in frontal cortex of mice[J].Acta Pharmacol Sin,2005,26(2):155 -159.
[10]洪宗元.前列腺素DP受体缺乏对小鼠脑内组胺含量的影响[J].皖南医学院学报,2005,24(3):169 -172.
[11]YOSHINORI I,RYOZO O,NAOTO A,et al.A Highly Sensitive Assay for Histamine Using Ion-Pair HPLC Coupled with Postcolumn Fluorescent Derivatization:Its Application to Biological Specimens[J].J Neurochem,1992,58(3):884 -889.
[12]黄新华,陈本美,梁绍先,等.高效液相色谱柱后衍生法测定豚鼠鼻粘膜中组胺[J].湖南医科大学学报,2000,25(3):294-296.
[13]GLOWINSKI J,LVERSEN LL.Regional studies of catecholamines in the rat brain[J].J Neurochem,1966,13():655 -669.
[14]陶芳,马张庆,洪宗元.腺苷在小鼠脑组织中的分布[J].皖南医学院学报,2012,31(1):1 -3.
[15]金高娃,蔡友琼,于慧娟,等.柱前衍生高效液相色谱法测定鱼罐头中的组胺[J].色谱,2010,28(11):1099 -1102.
[16]丁卓平,刘辰麒,陈迪,等.高效液相色谱法同时测定水产品中10 种生物胺的研究[J].分析测试学报,2006,25(4):59 -62.
[17]洪宗元.组胺H1受体缺乏改变小鼠脑内组胺含量及昼夜节律[J].安徽师范大学学报(自然科学版),2005,28(3):320 -323.
