无患子总皂苷提取工艺对比
2013-11-08奚立民张昕欣柯中炉
金 秋,奚立民,张昕欣,柯中炉
(台州职业技术学院 生化制药研发中心,浙江 台州 318000)
无患子 (Sapindus mukorossi Gaertn),又名肥皂树,在我国长江流域和华南各省均有栽培[1]。其假种皮中含有大量皂苷成分,主要包括以常春藤皂苷元为基本骨架的三萜皂苷及一些倍半萜皂苷[2]。无患子皂苷具有较强去污能力[3],易降解,对皮肤刺激性小,是洗发香波、化妆品及各种生物洗涤剂的优良原料[4];同时还具有抗病毒、降血压、抗真菌、杀虫等多种药理作用[5-9]。
皂苷类化合物分子具有亲水和疏水结构,可用水或甲醇、乙醇等有机溶剂提取。目前无患子皂苷的研究和工业生产均以水提法为主,但水的溶解范围很大,造成水提物杂质含量过高,皂苷的纯度降低。魏凤玉等[10-11]研究了水提-大孔树脂吸附法提取,并用超滤法分离提纯无患子皂苷;饶厚曾等[1,12]介绍了微波萃取法提取无患子皂苷工艺。上述研究虽提出了无患子皂苷提取的一些新方法,但也存在溶剂消耗量大、能耗高和产品纯度低等缺点,不适合工业化生产的要求。本研究目的在于比较各种不同提取方法对无患子皂苷提取的效率,从易操作、低能耗和低成本等角度出发,筛选最佳提取工艺,以期为其工业化生产提供理论依据。
1 材料与方法
1.1 供试材料、试剂与仪器
供试材料为无患子假种皮,由天台县满园春农林开发有限公司提供。将无患子假种皮置于电热恒温鼓风干燥箱内于80℃烘干,并用万能粉碎机粉碎成80 目 (0.177 mm)粉末备用。
供试试剂甲醇、乙醇、丙酮均为分析纯,乙腈为色谱纯;常春藤皂苷元为标准品,购于中国药品生物制品检定所。
供试仪器为SY-1000E 多用途恒温超声提取机(北京弘祥隆生物技术开发有限公司),MDS-6 微波萃取仪 (上海新仪微波化学科技有限公司),R-210 旋转蒸发仪 (瑞士步琪有限公司),DHG 型电热恒温鼓风干燥箱 (上海精宏实验设备有限公司),FW-100 型高速万能粉碎机 (北京时利和科技发展有限公司),AS-220 电子分析天平 (波兰瑞德威公司),DK-S26 电热恒温水浴锅 (上海森信实验仪器有限公司),安捷伦1220 高效液相色谱仪(美国安捷伦公司)。
1.2 无患子皂苷分析色谱条件
以0.5 mg·mL-1的常春藤皂苷元乙腈溶液为对照,采用高效液相色谱法测定无患子皂苷含量[13]。色谱条件:色谱柱Angilent C18(4.6 mm×250 mm,5 μm),柱温30℃,流动相CH3CN∶H2O为85∶15,流速1 mL·min-1,检测时间30 min,检测波长210 nm。
无患子皂苷的提取效率用无患子皂苷得率来衡量。计算公式为:无患子皂苷得率/%=纯皂苷质量/无患子假种皮干重×100。
1.3 无患子皂苷的提取
1.3.1 单因素试验设计
不同提取方式。称取10 g 无患子假种皮干粉末,用甲醇作为溶剂,料液比为1 ∶5,分别用回流、索氏、超声和微波4种方式来提取无患子粉末中的无患子皂苷,提取时间为0.5 h,温度为50℃,提取次数为1 次,用液相色谱检测各种提取液中无患子皂苷的含量,以考察提取方式对无患子皂苷得率的影响。设3个重复。
不同提取因素。用10 g 无患子粉末,以回流提取方式,在不同提取溶剂 (水、甲醇、乙醇和丙酮)、提取次数(1,2,3 和4 次)、料液比(1∶1,1∶3,1∶5 和1∶8)、提取时间 (1,2,3 和4 h)和提取温度 (40℃,50℃,60℃和70℃)条件下重复提取。试验除了设定某单因素水平变化外,其他提取条件分别为:提取溶剂为乙醇,提取次数为3 次,料液比为1∶5,提取时间为1 h,提取温度为50℃。合并提取液作为样品提取物,用液相色谱检测各种提取液中无患子皂苷的含量,以考察以上5个因素对无患子皂苷得率的影响。试验设3个重复。
1.3.2 正交试验设计
在单因素试验的基础上,用10 g 无患子粉末,以回流方式提取,对提取溶剂 (A)、提取次数(B)、料液比 (C) (m/V)、提取时间 (D)和提取温度 (E)各因素进行L16(45)正交试验。1-4 水平因素A 分别为水、甲醇、乙醇和丙酮;因素B 分别为1,2,3 和4 次;因素C 分别为1 ∶1,1∶3,1∶5 和1 ∶8;因素D 分别为1,2,3 和4 h;因素E 分别为40℃,50℃,60℃和70℃。
1.3.3 数据统计分析
采用方差分析 (ANOVA)和Tukey’s test 来检验各个处理间无患子皂苷得率的差异显著性。
2 结果与分析
2.1 单因素试验
2.1.1 提取方式对无患子皂苷得率的影响
回流、索氏、超声和微波4种提取方式的无患子皂苷得率均存在显著差异 (P <0.001) (图1)。其中,超声提取的皂苷得率最高 (14.25%),其次是微波提取 (11.02%),而回流提取和索氏提取的得率分别为9.72% 和8.28%。由此可知,超声提取的效率最高,其原因可能是超声波将强烈的震动能和巨大的能量传递给无患子粉末和溶剂,从而破坏了无患子细胞,加强胞内皂苷的释放、扩散和溶解,提高了浸出效率。超声提取在较短时间(0.5 h)和较低温度 (50℃)下就能使无患子皂苷基本提取完全,是一种潜在的工业化生产且经济高效的提取方式。其他3种方式由于限定了提取温度、时间和次数,皂苷得率低于超声提取。如果改变上述提取条件,回流提取的皂苷得率应该有所增加,也不失为一种简单易行的工业化提取方式。而微波提取和索氏提取由于需要高昂的设备和较高的能耗,所以工业化应用潜力不大。
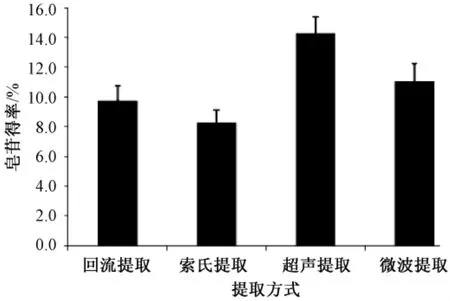
图1 不同提取方式对皂苷得率的影响
2.1.2 提取溶剂对无患子皂苷得率的影响
以水、丙酮、甲醇和乙醇为溶剂提取无患子皂苷 (图2),除了水和丙酮之间的皂苷得率差异不显著以外 (P >0.05),4种溶剂的无患子皂苷得率存在着显著差异。
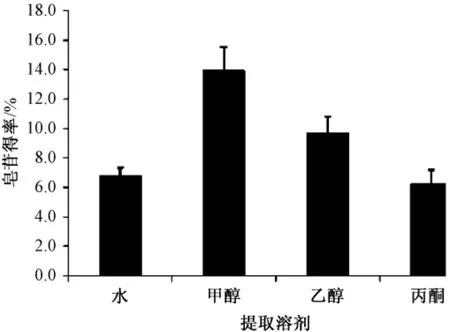
图2 不同提取溶剂对皂苷得率的影响
其他条件一定时,4种溶剂中,以甲醇提取的皂苷得率最高 (13.92%),其次为乙醇 (9.68%);以水、丙酮为提取溶剂时,皂苷得率最低。虽然甲醇的皂苷得率最高,但是甲醇提取物杂质含量较高,易吸收空气中的水而结块,不利于保存;且甲醇具有毒性,不利于工业化生产。乙醇提取皂苷得率低于甲醇,但是综合考虑提取物纯度、产品安全性及溶剂回收容易程度等因素,推荐以乙醇作为工业化生产无患子皂苷的提取溶剂。
2.1.3 提取次数对无患子皂苷得率的影响
由图3 可知,除提取1 次的较其他次数间的皂苷得率差异显著以外,其余各次提取得率间的差异不显著。同等条件下,皂苷得率随提取次数的增加而增大。提取次数为2~4 次时,其增幅变缓。从节能降耗的角度考虑,可选择工业化生产的提取次数为3 次。
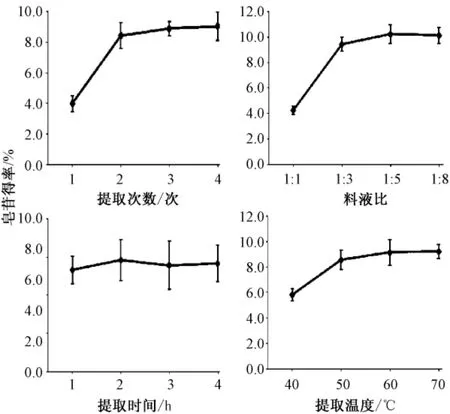
图3 不同因素对无患子皂苷得率的影响
2.1.4 料液比对无患子皂苷得率的影响
由图3 知,除了1∶5 和1∶8 料液比的皂苷得率差异不显著外,其他料液比的皂苷得率间均存在显著差异。同等条件下,提取溶剂量的增加有利于皂苷的溶出,皂苷得率也随之增加。提取溶剂在样品量的5~8 倍时,皂苷得率变化较小。从减少成本的角度考虑,工业化生产无患子皂苷的提取溶剂量以样品量的3~5倍为宜。
2.1.5 提取时间对无患子皂苷得率的影响
由图3 知,提取时间为1,2,3 和4 h 的皂苷得率间的差异均不显著。通常,随着提取时间的增加,原料中的组分逐渐扩散到溶剂中,一定时间后,溶于溶剂中的组分达到一定浓度后,其溶解速度变缓,最后趋于平衡[2]。由此表明,1 h 的提取时间已能基本完全提取无患子中的皂苷成分,再增加提取时间将增加能耗。因此,在工业化生产无患子皂苷时,提取时间可设定为1 h。
2.1.6 提取温度对无患子皂苷得率的影响
由图3 可知,不同提取温度下,除了40℃较其他提取温度的皂苷得率间存在显著差异外,其余提取温度的皂苷得率差异不显著。同等条件下,40~60℃时,无患子皂苷得率随温度增加而增大,升至70℃后,皂苷得率不再上升。无患子皂苷在常温下易溶于乙醇,温度升高有利于皂苷的溶出,但温度过高,不但会增加能耗,还会造成部分皂苷水解,生成副产物,影响提取物纯度及后续的利用[2]。因此,为了降低能耗,工业化生产无患子皂苷时,提取的温度可设定在50℃。
2.2 正交试验
由表1 可知,各因素对无患子皂苷提取率的影响大小依次为A >B >E >C >D,即提取溶剂对皂苷提取率的影响最大,其次为提取次数,第三为提取温度,第四为料液比,提取时间的影响最小。最佳提取工艺条件为A2B4C2D1E2,即提取溶剂为甲醇,提取次数为4 次,料液比为1∶3,提取时间为1 h,提取温度为50℃。经验证,该条件下无患子皂苷得率为14.66%,说明优化出的最佳工艺是稳定可靠的。正交试验结果与单因素试验结果也基本吻合。由方差分析可以看出,提取溶剂的均方比F大于其临界值F0.10(3,3)=2.490,说明对皂苷提取率有影响;而提取次数、料液比、提取时间和提取温度的F 均小于其临界值,对皂苷提取率的影响不显著。这是因为溶剂的种类直接影响其穿透无患子细胞的能力,进而影响皂苷的提取率。由于提取次数、料液比、提取时间和提取温度均在适宜范围内考察,故对结果影响较小。
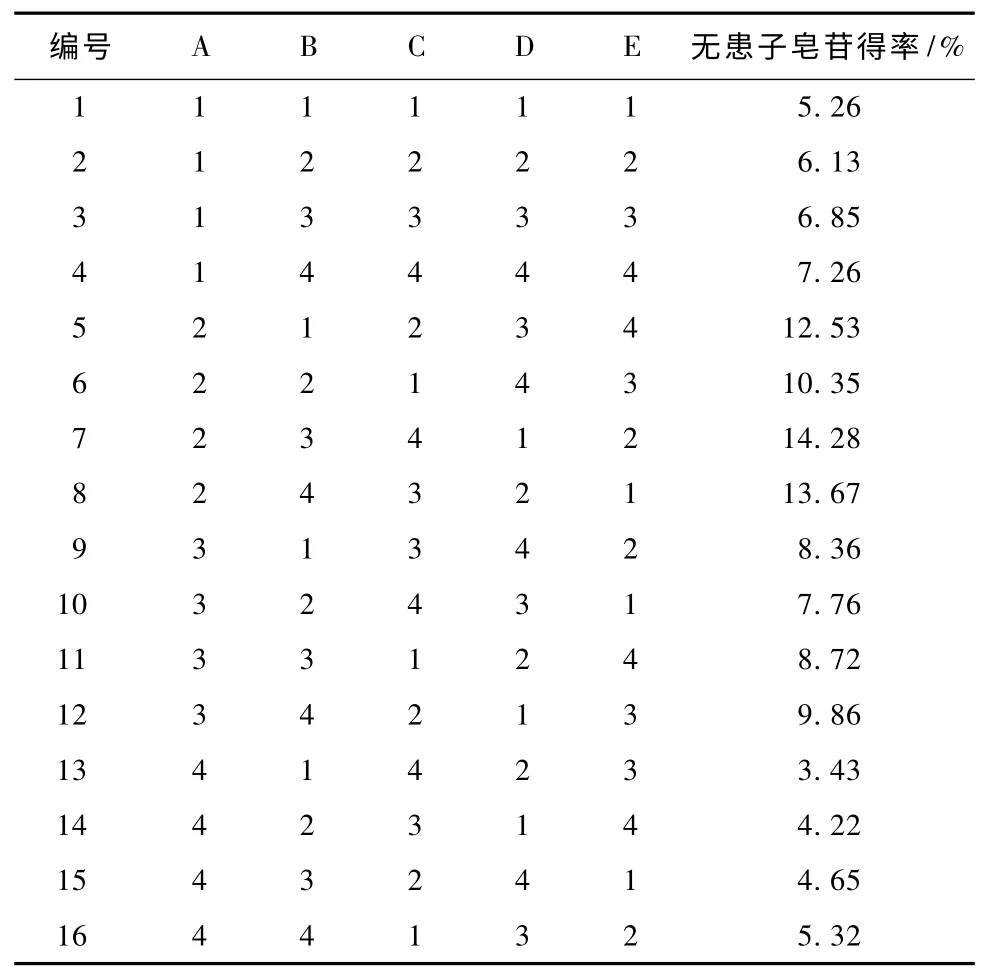
表1 正交试验设计与结果
3 小结
超声提取无患子皂苷的提取效率明显高于微波提取、回流提取和索氏提取,有条件的生产企业可购置超声提取仪器用于无患子皂苷的提取。回流提取虽然提取效率不如超声提取,但其设备投入低,操作方便,经济可靠,也是一种适用于工业化生产无患子皂苷的提取方式。
通过单因素试验和正交实验,确定回流提取无患子皂苷的最佳提取工艺条件为:以甲醇为提取溶剂,提取次数为4 次,料液比为1∶3,提取时间为1 h,提取温度为50℃。在该条件下,无患子皂苷的得率为14.66%。
[1]饶厚曾,郭隆华.无患子皂苷提取工艺研究[J].江西科学,2002,20 (1):55-58.
[2]黄素梅,王敬文,杜孟浩,等.无患子总皂苷的提取工艺研究[J].安徽农业科学,2010,38 (1):354-356.
[3]中国植物志编委会.中国植物志四十七卷 (第一分册)[M].北京:科学出版社,1998.
[4]张敏杰,刘佩茹,赵俊滋,等.无患子的开发利用[J].天然产物研究与开发,1993,5 (4):76-78.
[5]Brahm M,史青.无患子果皮中皂苷的抗真菌活性[J].国外医学中医中药分册,2002,24 (5):300-301.
[6]Tamura Y,Khan A A,Tiwaris K,et al.Antimicrobial activity of Sapindus mukorossi and Rheum emodi extracts against H.pylori:in vitro and in vivo studies[J].World J Gastroenterol,2006,14:7136-7142.
[7]Brahm M,Khaja M N,Aara A,et al.Hepatoprotective activity of Sapindus mukorossi and Rheum enodi extracts in vitro and in vivo studies[J].World J Gastroenterol,2008,14 (16):2566-2571.
[8]Huang H C,Tsaiw J,Llaw C C,et al.Anti-platelet aggregation triterpene saponins from the galls of Sapindus mukorossi [J].Chem Pharm Bull,2007,55 (9):1412-1415.
[9]王维胜,龙子江,张玲,等.无患子皂苷对肾性高血压大鼠血压及血管活性物质的影响[J].中国中药杂志,2007,32 (16):1703-1705.
[10]魏玉凤,余锦城,解辉.天然无患子皂苷的提取分离[J].安徽化工,2007,33 (3):15-17.
[11]魏玉凤,解辉,余锦城,等.超滤法分离提纯无患子皂苷[J].膜科学与技术,2008 (2):85-88.
[12]饶厚曾,桑成涛.微波萃取法提取无患子皂苷工艺[J].辽宁石油化工大学学报,2006,26 (4):70-72.
[13]何宇新,马育彪,李玲,等.反相高效液相色谱法测定不同产地无患子药材中常春藤皂苷元的含量[J].时珍国医国药,2010,21 (9):2189-2190.
