不同保存方法对厚壳贻贝样品蛋白提取效果的比较
2013-10-13杨金龙李无霜沈和定李家乐
杨金龙 , 李无霜 梁 箫 沈和定 , 李家乐
(1. 上海海洋大学 农业部淡水水产种质资源重点实验室, 上海 201306; 2. 上海市水产养殖工程技术研究中心, 上海 201306; 3. 上海高校知识服务平台上海海洋大学水产动物遗传育种中心, 上海 201306)
随着生物化学技术的不断深入发展, 在海洋无脊椎动物中有关蛋白质的研究也越来越多。其中western blot用来对蛋白表达做定量定性分析, 2-DE和质谱技术等相结合鉴定蛋白质组分。这一系列蛋白质研究技术都有赖于对样品蛋白的提取。在研究厚壳贻贝等海洋无脊椎动物不同发育阶段过程中,其新鲜样品的采集受到很大程度的限制, 例如采样时间、采样地点等, 为蛋白相关研究工作的开展带来了诸多困难。
厚壳贻贝(Mytilus coruscus)是中国重要的贝类养殖品种, 分布于黄海、渤海和东海沿岸, 其中以浙江沿海资源量最大。关于厚壳贻贝的其遗传特性[1]、附着特性[2]、低温保存[3]、繁殖发育[4,5]、生态毒理[6]等方面已开展了大量的研究工作, 主要集中在厚壳贻贝的幼体和成体两个发育阶段。与许多其他海洋无脊椎动物一样, 厚壳贻贝幼体也要经过重要的阶段—附着和变态, 在变成附着稚贝后, 其附着数量直接影响着苗种的产量。然而, 关于厚壳贻贝稚贝的研究鲜有报道[7]。
目前, 有关不同保存方法提取蛋白的比较研究尚未见报道, 本实验以厚壳贻贝稚贝为材料, 采用直接冷冻法、添加海水冷冻法以及蛋白裂解液冷冻法等3种保存方法。分别保存1周、2周、3周、4周、2个月、3个月和6个月对其进行蛋白提取, 聚丙烯酰胺凝胶电泳对所提蛋白进行比较分析, 旨在探寻合适保存样品的方法用以提取蛋白以供进一步研究。
1 材料和方法
1.1 样品处理
厚壳贻贝样品采集于浙江洞头的稚贝, 其平均壳长2.8 mm, 壳高1.8 mm。实验室暂养1周后, 挑选健康状态良好的稚贝收集于离心管, 分别用 3种不同方法进行保存。
直接冷冻法为直接将样品用液氮快速冷冻, 后放入-80℃冰箱保存; 海水冷冻法时, 向样品中添加1 mL 灭菌海水, 后用液氮快速冷冻, 最终保存于-80℃冰箱中; 蛋白裂解液冷冻法为向样品中添 1 mL蛋白裂解液(10 mmol/L Tris, 20 mmol/L EDTA, 5% Tritonx-100和2 mmol/L PMSF), 用液氮快速冷冻, 最终放入-80℃冰箱保存。实验过程中, 保存时间为1周、2周、3周、4周、2个月、3个月和6个月。
1.2 蛋白样品的制备
直接冷冻法中蛋白样品制备时, 先进行样品称质量, 加入 4倍体积的蛋白裂解液, 于冰上匀浆 3次, 每次30 s, 将匀浆液分装到1.5 mL离心管, 4℃10 000 g离心30 min, 收集上清即为可溶性蛋白。海水冷冻法中蛋白样品制备时, 将样品溶解, 除去其中的灭菌海水, 加入4倍体积的蛋白裂解液, 匀浆和离心方法同上。蛋白裂解液冷冻法中蛋白样品制备时, 将样品溶解后, 将 1 mL蛋白裂解液吸出, 置于1.5 mL离心管中称质量, 计算出所需裂解液的总量。将原有1 mL蛋白裂解液和补充裂解液加入, 最终为4倍体积的蛋白裂解液, 匀浆和离心方法同上。
1.3 蛋白定量
将制得的蛋白上清取20 μL稀释到100 μL后用Lowry法蛋白含量测定试剂盒(PRL000100), 测定不同保存时间, 各保存方法蛋白样品中所含的蛋白量。
1.4 SDS-PAGE电泳检测
取 100 μL 蛋白原液, 加入 100 μL SDS-buffer上样缓冲液, 水浴煮沸 10 min制成上样样品。上样量为10.05 μg蛋白, 用12%的聚丙烯酰胺凝胶电泳分离, 考马斯亮蓝染色, 伯乐凝胶成像系统拍照记录。结果用Quantity One软件估算条带的相对分子量及灰度值。
2 结果
3种保存方法在不同保存时间内所提蛋白样品的质量如图1所示。SDS-PAGE胶上最为明显有规律的4个条带a、b、c、d, 其相对分子量依次约为55、46、38和26 kDa。同时, 基于SDS-PAGE蛋白条带,Quantity One软件检测条带a, b, c, d的灰度值结果如表1所示。分析条带a发现, 3种保存方法均在保存3周内未检测到条带, 到第4周条带明显, 保存时间延长至2个月时条带灰度值增加, 保存3个月时出现减弱趋势, 到保存 6个月后条带的灰度值降为 0。3种保存方法下, 条带 a的灰度值总体趋势均呈先增加后减少。分析条带b可发现, 直接冷冻保存法与添加海水冷冻法均呈先增加后降低趋势; 蛋白裂解液冷冻法研究结果发现保存1个月内呈逐渐降低趋势,当保存 2个月后条带灰度值呈现增加。分析条带 c的灰度值发现, 3种不同保存方法整体趋势呈增加趋势。同样, 条带 d在6个月保存时间内, 3种保存方法整体趋势也呈增加趋势。由此可见, 条带a的灰度值在 3种不同保存方法下呈现相同趋势, 无法作为鉴定保存方法良否的依据。同样, 条带c和d的灰度值在 3种不同保存方法下呈现相同趋势, 无法作为鉴定保存方法良否的依据。直接冷冻法和添加海水冷冻法结果均显示条带 b的灰度值呈现先增加后降低趋势; 蛋白裂解液冷冻法结果与前两种保存方法不同, 呈先降低后增加趋势。因此, 将条带b可作为衡量3种保存方法良否的标准。
3 讨论
对不同保存方法DNA提取比较的研究已经很深入, 例如冷冻保存、75%乙醇保存、EDTA结合乙醇保存以及甲醛等保存方法[8-10]。然而, 有关保存方法和保存时间对样品蛋白提取影响的研究工作还未开展。作者首次通过直接冷冻法、添加海水冷冻法以及蛋白裂解液冷冻法等 3种方法开展了厚壳贻贝稚贝样品的保存工作, 确定了其最佳样品保存方法。
样品冷冻保存过程中蛋白酶的存在可能导致样品中蛋白发生不同程度的降解。自然界中根据蛋白酶活性中心分为四大类蛋白酶, 分别为丝氨酸蛋白酶、金属蛋白酶、巯基蛋白酶以及酸性蛋白酶。在本研究中, 研究对象厚壳贻贝其生活史、包括稚贝在内的各个发育阶段均生活在海水环境中; 自然海水一般偏碱性, 丝氨酸蛋白酶和金属蛋白酶具有一定的活性, 可能会降解相关蛋白, 在蛋白裂解液中, 因而选用了2种蛋白酶抑制剂PMSF和EDTA, 分别可抑制丝氨酸蛋白酶和金属蛋白酶。直接冷冻法和添加海水冷冻法的结果表明a、b、c、d 等4条条带在6个月保存过程中, 呈现整体增加的趋势。原因可能是由于在保存过程中, 无添加任何蛋白酶抑制剂,促使较大分子量的蛋白在蛋白酶的作用下, 出现降解现象, 其分解产物在原有a、b、c、d等4条条带上基础出现累积现象。蛋白裂解液冷冻法的研究发现, 条带a、c、d与直接冷冻法和添加海水冷冻法结果相似, 均呈整体增加趋势, 其原因可能是由于在蛋白裂解液中添加的 2种蛋白酶抑制剂 PMSF和EDTA无法完全抑制样品中一些大分子量蛋白的降解; 此外, 可能由于其余两大类的蛋白酶巯基蛋白酶和酸性蛋白酶发挥了作用, 导致大分子量蛋白的降解。条带b在1个月内呈现降低的趋势, 之后呈增加的趋势, 其原因可能是在蛋白裂解液中添加的 2种蛋白酶抑制剂PMSF和EDTA在一定程度上抑制了样品中一些大分子量蛋白的降解, 从而使分解产物未在条带b上基础进行累积。这一过程中, 条带b的减少, 可能是其样品保存过程中损耗所导致。此外,条带b的结果发现保存2个月后其灰度值出现增加现象, 可能是由于长时间保存过程中蛋白裂解液中添加的2种蛋白酶抑制剂的作用减弱所致。

图1 不同保存条件下的厚壳贻贝稚贝蛋白样品SDS-PAGEFig. 1 SDS-PAGE of samples of Mytilus coruscus juvenile stored in different methods
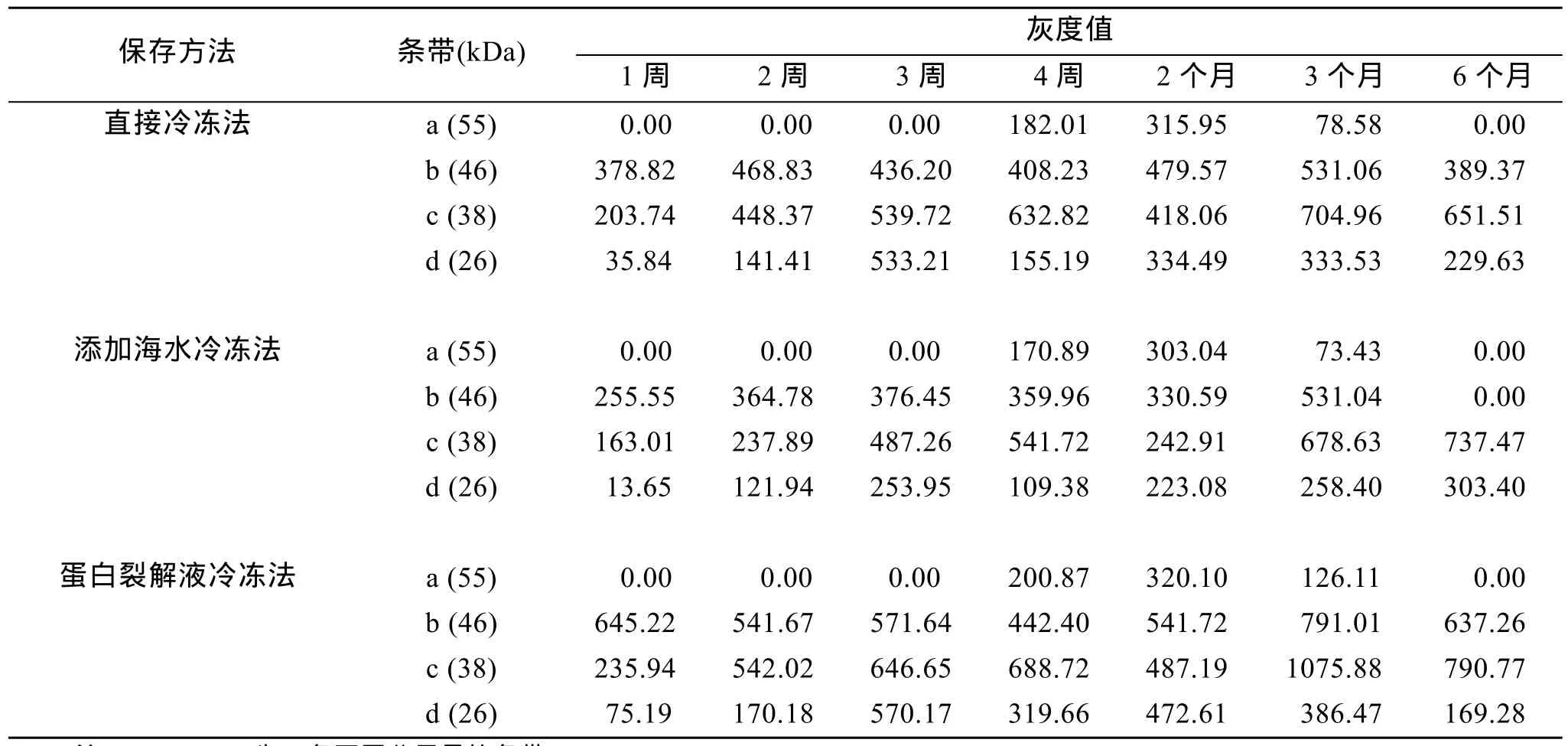
表1 不同保存方法的蛋白条带分析Tab. 1 The analysis of SDE-PAGE in different methods
综上, 条带 b可作为厚壳贻贝稚贝样品保存方法良否的标准。1个月内, 蛋白裂解液中的方法最佳,直接冷冻法和添加海水冷冻法的研究发现保存过程中的蛋白均出现不同程度的降解现象, 因而可能不适宜用于该种稚贝样品的保存。
[1]Shen Y B, Bai Z Y, Guo S Z, et al. Polymorphic microsatellite loci for population genetics of the hard shelled mussel,Mytilus coruscus[J]. Conserv Genet Resour, 2013, 5:121-123.
[2]Wang C, Bao W Y, Gu Z Q, et al. Larval settlement and metamorphosis of the musselMytilus coruscusin response to natural biofilms[J]. Biofouling, 2012, 28:249-256.
[3]李一峰, 杨金龙, 王冲, 等. 厚壳贻贝早期幼虫低温保存的影响研究[J]. 水产学报, 2012, 36(1): 73-77.
[4]常抗美, 吴剑锋. 厚壳贻贝人工繁殖技术的研究[J].南方水产, 2007, 3(3): 26-30.
[5]杨金龙, 李树恒, 刘志伟, 等. 厚壳贻贝胚胎和早期幼虫神经系统发育的初步研究[J]. 水产学报, 2013,47(4): 512-519.
[6]Li Y F, Gu Z Q, Liu H, et al. Biochemical response in the musselMytilus coruscusexposed in vivo to sublethal copper concentrations[J]. Chin J Oceanol Lim,2012, 30: 738-745.
[7]杨金龙, 慎佩晶, 王冲, 等. 微生物膜对厚壳贻贝稚贝附着的影响[J]. 水产学报, 37(6): 91-97.
[8]Cai X X, Song Z K, Peng Y H, et al. A new sampling approach to obtain genomic DNA of marine shellfish[J].Agricultural Science and Technology, 2010, 11(7): 160- 163.
[9]李联泰, 安贤惠. 几种海水经济贝类 DNA 提取方法探讨[J]. 淮海工学院学报(自然科学版), 2005, 14(4):66-69.
[10]骆轩, 江树勋, 高如承, 等. 菲律宾蛤仔基因组DNA的提取及其 RAPD分析[J].生物技术通讯, 2003, 14(5):361-363.
