低盐度形成的微生物膜对厚壳贻贝稚贝附着的影响
2013-10-13杨金龙包卫洋沈和定李家乐
杨金龙 , 李 响 王 冲, 凌 云 包卫洋, 沈和定 , 李家乐
(1. 上海海洋大学 农业部淡水水产种质资源重点实验室, 上海 201306; 2. 上海市水产养殖工程技术研究中心, 上海201306; 3. 上海高校知识服务平台上海海洋大学水产动物遗传育种中心, 上海201306; 4. 滨州市海洋与渔业研究所, 山东 滨州 256616; 5. 扬州大学海洋科学与技术研究所, 江苏 扬州225009)
在海洋环境中, 当一个物体浸入海水, 海洋细菌将迅速附着在其表面, 并生长、繁殖, 随后同繁殖的硅藻、真菌、原生动物以及有机碎屑和无机颗粒等形成一层微生物膜[1-2]。微生物膜是污损生物的重要组成部分, 能诱导海洋污损动植物的附着变态,与生物污损的形成关系密切[3-4], 是许多海洋无脊椎动物附着和变态的重要自然诱导物。同时, 微生物膜是船舶等浸水设施表面上最早附着的生物层, 是一个复杂但可控的微型生态系统[5], 其形成加速了大型污损生物的附着, 从而引起船舶及海上工程设施的生物污损及微生物腐蚀, 由此而造成巨大的经济损失[6]。因此, 研究微生物膜对海洋无脊椎动物幼虫的附着变态行为对于水产养殖苗种生产技术的改善和海洋防污技术的发展具有极其重要的理论意义和实践意义[7]。
厚壳贻贝(Mytilus coruscus)作为中国重要的贝类养殖品种, 而且也是主要的海洋筏式养殖附着生物之一, 分布于黄海、渤海和东海沿岸, 其中以浙江沿海资源量最大。近年来, 人为过度采伐导致厚壳贻贝自然资源逐渐减少, 自然海区附苗数量和质量明显下降, 厚壳贻贝养殖产业受到影响。目前, 厚壳贻贝规模化人工繁殖技术一直没有得到很好的解决,育苗数量不稳定, 导致苗种供不应求。与许多其他海洋无脊椎动物一样, 厚壳贻贝幼体也要经过重要的阶段——附着和变态, 在变成附着稚贝后, 其附着数量直接影响着苗种的产量。
大量研究证明微生物膜能诱导地中海紫贻贝(Mytilus galloprovincialis)[8]、新西兰贻贝(Perna canaliculus)[9]、大珠母贝(Pinctada maxima)[10]、太平洋牡蛎(Crassostrea gigas)[11]、杂色鲍(Haliotis diversicolor supertexta)[12]等多种经济贝类幼体的附着和变态, 但有关微生物膜对贝类稚贝附着的影响的研究鲜有报道。本课题组已证明微生物膜诱导厚壳贻贝幼体附着和变态[13]。然而, 不同盐度条件下形成的微生物膜对厚壳贻贝稚贝附着的影响的尚未得知。作者研究了低盐度下形成的微生物膜对厚壳贻贝稚贝附着的影响, 通过分析微生物膜的干质量、细菌密度、硅藻密度、叶绿素 a的含量以及微生物膜细菌群落多样性, 来探究微生物膜对厚壳贻贝稚贝附着的影响因素, 旨在为提高厚壳贻贝苗种中间培育提供相应的理论依据。
1 材料与方法
1.1 材料
1.1.1 稚贝
实验用厚壳贻贝稚贝取自浙江省舟山市嵊泗县海洋科技开发服务中心, 壳长(3.1 ± 0.5)mm, 壳高(2.2 ± 0. 5)mm, 运回实验室后暂养1周后用于实验。暂养期间, 培育水温为 18℃, 充气培育, 每天换水及投喂金藻(Isochrysis galbana)。
1.1.2 微生物膜形成
实验所需的室内微生物膜形成于光照培养箱(新苗 GZX-300BS-Ⅲ)中, 温度控制在 18℃, 光照强度为10 000 lx, 光照周期比为14 h: 10 h。形成微生物膜所用的玻璃片为26 mm × 38 mm, 灭菌后垂直置于人工配置的海水中。海水盐度为 13、23, 借助REF201手持盐度折光仪进行校对, 每隔3 d换一次水。微生物膜的日龄设为7、14、21、28 d, 每个日龄设置3个重复。
1.2 实验方法
1.2.1 微生物膜干重测量
用灭菌玻璃片将微生物膜从载玻片上刮至灭菌海水中, 过滤至 GF/C滤膜(whatman玻璃纤维滤膜,1.2 μm), 干燥箱中干燥, 设置温度为80℃, 48 h后对其干质量进行测量。
1.2.2 微生物膜中的附着细菌和底栖硅藻计数
细菌和硅藻密度计数参考Bao等[3]的方法进行。简单来说, 细菌计数时, 将微生物膜固定在 5%的福尔马林溶液中, 吖啶橙(0.1%)染色5 min后, 1000倍荧光显微镜下随机选取10个点进行计数。硅藻计数时, 将含有微生物膜的载玻片直接置于 200倍光学显微镜下、随机选取10个点进行计数。
1.2.3 微生物膜叶绿素a的测定
将载有微生物膜的过滤滤膜(0.45 μm, 纤维素酯微孔滤膜)放入具塞离心管中, 加 90%丙酮溶液10 mL摇荡, 4℃14 h后, 漩涡振荡仪振荡1 h。然后, 离心 3 000 r/min, 10 min后取上清液在 UNIC 2100分光光度计上, 用1 cm 光程的比色皿, 分别读取750、664、647、630 nm 波长的吸光度, 以90%丙酮浸泡的空白滤膜作为空白对照, 按如下公式计算叶绿素a含量[14]:
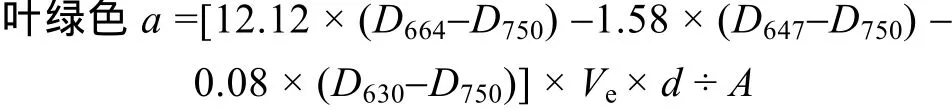
式中:Ve为恒定的提取液体积(L),D为吸光度,d为微生物膜的面积(cm2),A为比色皿光程(cm)。
1.2.4 附着细菌的DNA提取
将不同日龄的微生物膜载玻片从海水中取出, 在无菌操作台中, 将微生物膜收集到 2 mL离心管中,经10 000g, 离心5 min, 弃上清液, -20℃保存备用。解冻保存的微生物膜样品, 使用 3S柱离心式环境样品DNA回收试剂盒V2.2进行基因组总DNA的提取。
1.2.5 PCR 扩增
采用细菌16S rDNA V3区序列通用引物进行扩增, 引物为 357f-GC(5′-CGC CCG CCG C GC GCG GCG GGC GGG GCG GGG GCA CGG GGG GCC TAC GGG AGG CAG CAG-3′)和 518r(5′-ATT ACC GCG GCT GCT GG-3′), 扩增总体系为 50 μL: 模板DNA 2 μL, 4×dNTPs (10 μmol/L)1μL, Taq DNA 聚合酶(5 U/μL)1 μL, 引物(20 pmol/μL)各 1.5 μL, 10×扩增缓冲液(含 Mg2+)5 μL, 用 ddH2O 补至 50 μL。PCR反应在 Mastercycler gradient(eppendorf)上进行,PCR 扩增条件: 94℃预变性5 min, 20个循环的降落PCR(94℃变性1 min, 退火30 s, 72℃延伸3 min, 退火温度由 65℃降到 55℃, 每一循环递减 0.5℃), 15个循环(94℃变性1 min, 55℃退火30s, 72℃延伸3 min),72℃延伸10 min, 4℃保存。PCR扩增产物使用1.2%琼脂糖凝胶电泳进行检验。
1.2.6 细菌群落结构分析
使用 Bio-Rad 公司 D-code System 电泳仪进行变性梯度凝胶电泳(DGGE)分离。制备聚丙烯酰胺凝胶, 浓度为 8%, 变性梯度为 40%~70%(7 mol/L尿素和 40%去离子甲酰胺为 100%变性), 电泳缓冲液为1×TAE, 60℃, 60V条件下电泳10 h。电泳结束后, 用溴乙锭染色 15 min, 紫外拍照, 并采用软件 Quantity one(Bio-rad)对DGGE图谱进行多样性指数分析。
1.2.7 稚贝附着实验
将载有微生物膜的载玻片放入盛有 20 mL灭菌海水的培养皿(Ø64 mm × 19 mm)中, 每个培养皿中放入10只稚贝, 每个日龄设置5个平行组, 以空白载玻片作为对照。实验温度为(18 ± 1)℃, 黑暗条件。实验12、24和48 h时, 记录稚贝的附着率, 即载玻片上附着的稚贝个数占该培养皿中稚贝总数的百分比。
1.2.8 数据处理
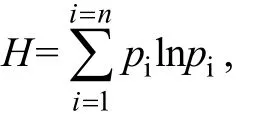
2 结果
2.1 低盐度下形成的微生物膜对厚壳贻贝稚贝附着的影响
同一盐度下, 微生物膜在12、24和48 h对厚壳贻贝稚贝附着的诱导基本相似, 因而本研究仅出示12 h的诱导效果, 其结果如图1所示。与对照组(0 d)相比, 盐度13和23时形成的微生物膜均能促进厚壳贻贝稚贝的附着(P< 0.05)。盐度13时, 不同日龄的微生物膜对稚贝附着的诱导效果之间无显著差异(P>0.05), 21 d的微生物膜对稚贝附着的诱导达到最大,为50%。同样, 盐度23时, 不同日龄的微生物膜对稚贝诱导活性之间无显著差异(P> 0.05), 在28d的微生物膜诱导下附着率达到最大, 为 72%。在高日龄(28 d)时, 两者活性无显著性差异(P> 0.05), 但随着盐度的增大, 稚贝附着率也随之升高, 相关性分析表明微生物膜的诱导活性与盐度显著相关(P< 0.05, 表1)。低盐条件下, 微生物膜的诱导稚贝附着率与干质量显著相关(P< 0.05)。同样, 细菌密度(P< 0.05)和硅藻密度(P< 0.05)明显与稚贝附着率呈显著性相关关系(表1)。
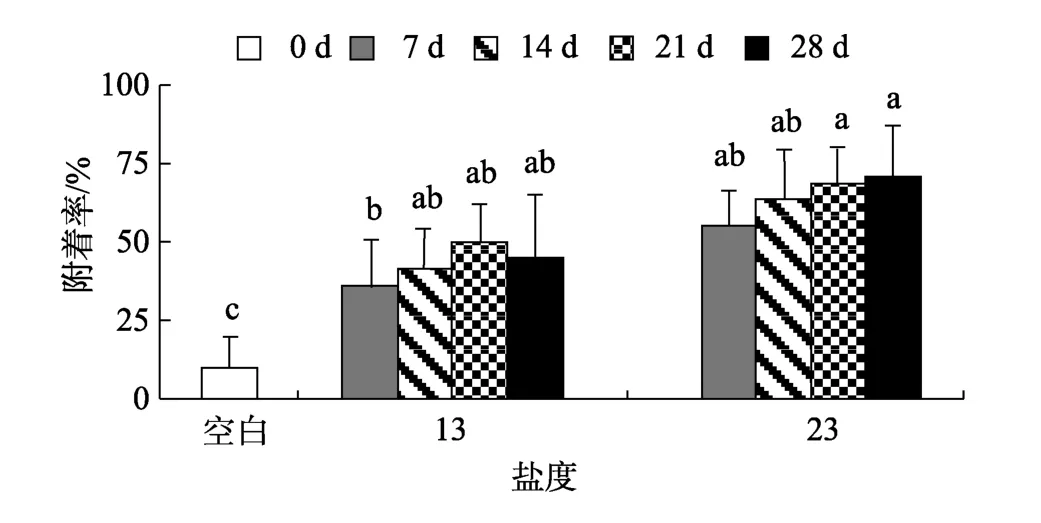
图1 低盐度时形成的微生物膜对厚壳贻贝稚贝附着率的影响Fig. 1 Settlement rates of Mytilus coruscus plantigrades on biofilms formed on low salinities
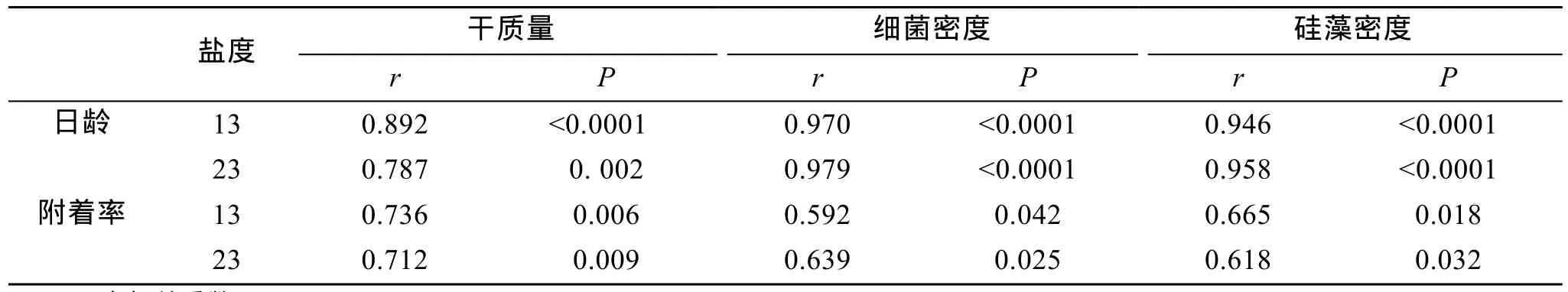
表1 低盐时, 微生物膜日龄及诱导稚贝附着率与干质量、细菌密和硅藻密度间的相关性Tab. 1 Correlation between age or settlement (%)and dry weight, bacterial and diatom densities
2.2 微生物膜中的干质量、细菌密度、硅藻密度与盐度、日龄的关系
低盐条件下, 微生物膜的干质量、细菌和硅藻密度随日龄变化如图2所示。盐度13时, 随着日龄的增加, 干质量逐渐增加, 在 28 d 达到最大值(P<0.05, 图2-A)。盐度23时, 干质量14 d时明显增加(P< 0.05), 21 d和28 d虽有增加, 但无显著性差异(P>0.05)。低盐条件下, 附着细菌密度均随着日龄的增加呈显著增加趋势(P< 0.05), 28 d时达到最高, 分别为9.4 ×106± 1.7 × 106个/cm2和 11.1 × 106± 1.5 × 106个/cm2(图2-B)。同样, 盐度13和23时形成微生物膜中的硅藻密度均随着日龄增加呈明显增加趋势(P< 0.05,图2-C)。低盐条件下, 微生物膜干质量、细菌和硅藻密度与日龄关系如表1所示。盐度13和23时, 微生物膜的干质量明显与日龄呈显著性相关(P< 0.05),其中的细菌(P< 0.05)和硅藻密度(P< 0.05)也与日龄显著相关, 其相关性系数均大于0.9。
2.3 低盐条件下形成微生物膜中叶绿素 a含量变化
微生物膜中叶绿素a的含量, 在盐度13时, 14 d与21 d叶绿素a含量之间无显著差异(P> 0.05, 图3),其他日龄间存在显著差异(P< 0.05)。盐度23、14 d时叶绿素a的含量达到最高值, 为2.03 μg/cm2, 21、28 d微生物膜中的叶绿素a含量之间无显著性增加(P> 0.05)。相关性分析发现, 盐度13时形成的微生物膜其日龄与叶绿素a无显著的正相关性(P> 0.05)。同样, 盐度23时形成的微生物膜, 其日龄与叶绿素a无正相关性(P> 0.05)。
2.4 微生物膜中细菌群落多样性分析
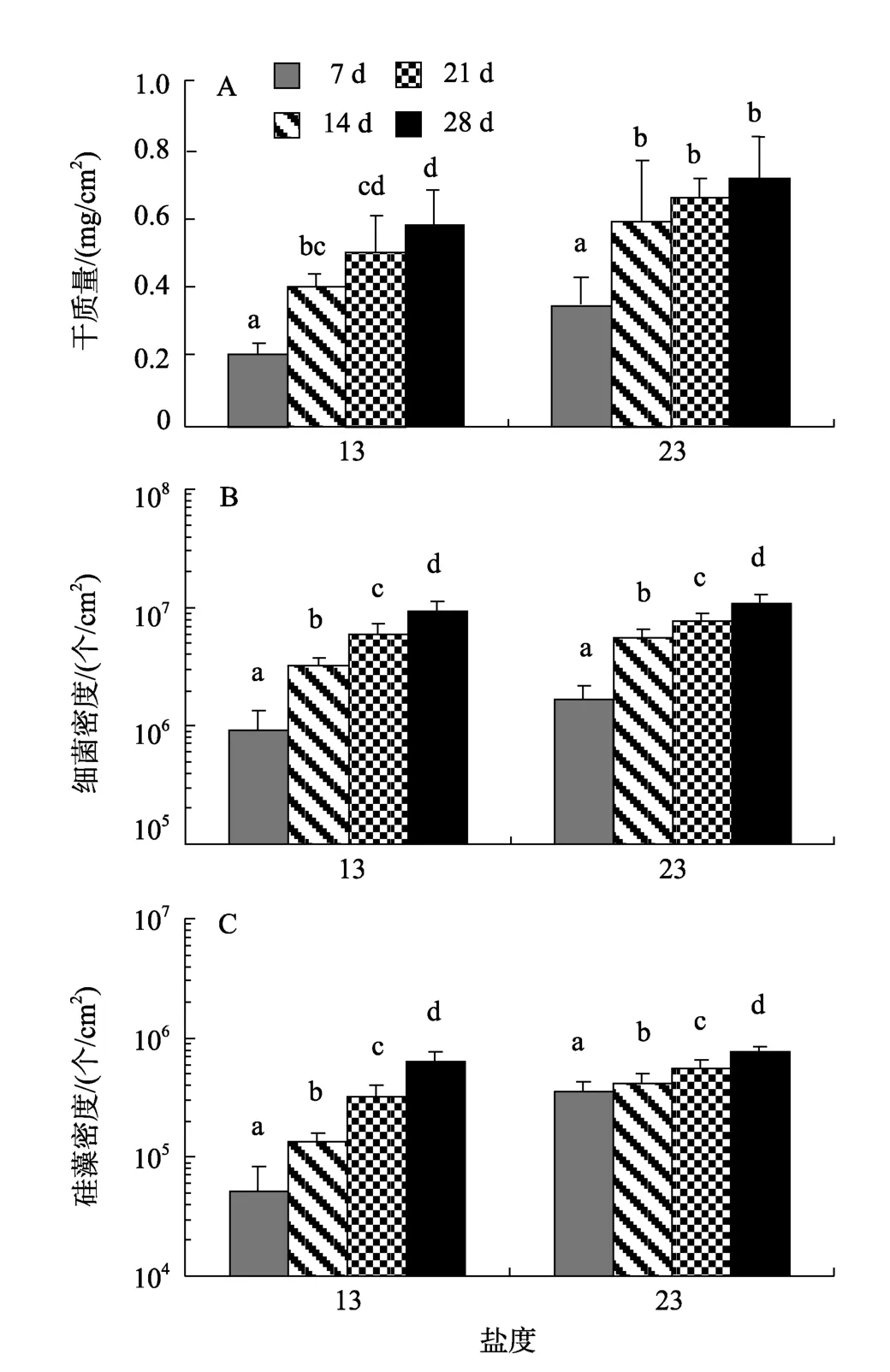
图2 低盐时形成的微生物膜中的干质量(A)、细菌密度(B)和硅藻密度(C)Fig. 2 Dry weight(A), bacterial density(B)and diatom density(C)of biofilms formed on low salinities
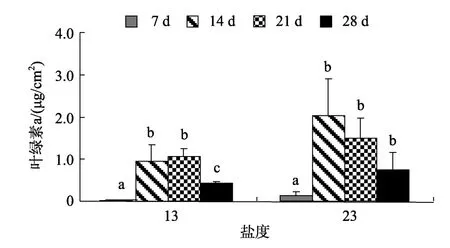
图3 低盐时形成微生物膜中的叶绿素a含量变化Fig. 3 Chlorophyll a content in biofilms formed on low salinities
不同盐度、日龄下微生物膜中细菌DGGE指纹图谱如图4所示。DGGE图谱中条带的数量可以反映样品的细菌多样性, 条带信号的强弱可以反映细菌的相对含量, 通过软件Bio-rad Quantity one 4.6.2分析每个样品的条带数目和亮度, 研究低盐条件下、日龄的微生物膜中细菌的种类数量和相对含量,得出微生物膜中细菌多样性信息(表2)。由表2可知,在不同的盐度下, 随着日龄的增加, 微生物膜中细菌 DGGE图谱的条带数有所增加, 其中盐度 13时最为明显。同时, 低盐度条件下, 微生物膜中的细菌多样性指数随着日龄的增加不断上升, 在 28 d时细菌多样性指数均达到最高, 分别为 1.98和2.27。在 DGGE指纹图谱基础, 开展了细菌群落结构的聚类分析, 其结果如图 5所示。研究发现, 盐度13时, 7 d 微生物膜与14 d微生物膜的相似性很高为64%, 21 d 微生物膜与28 d微生物膜的相似性很高为59%。盐度23时, 21 d微生物膜与28 d微生物膜的相似性很高为62%, 这2个日龄微生物膜与14 d 和 7 d 的微生物膜的相似性分别为 58%和50%。
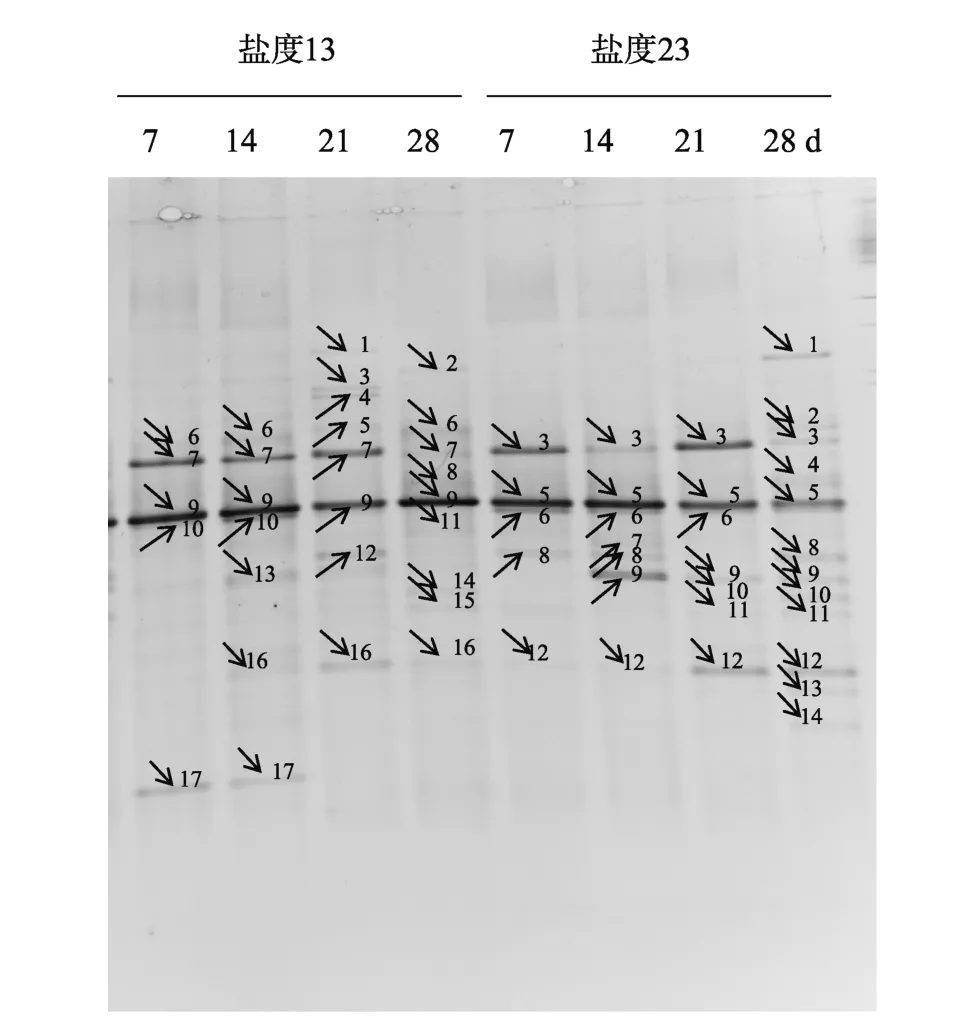
图4 低盐条件下, 不同日龄微生物膜样品DGGE指纹图谱Fig. 4 DGGE fingerprints of biofilms formed on low salinities
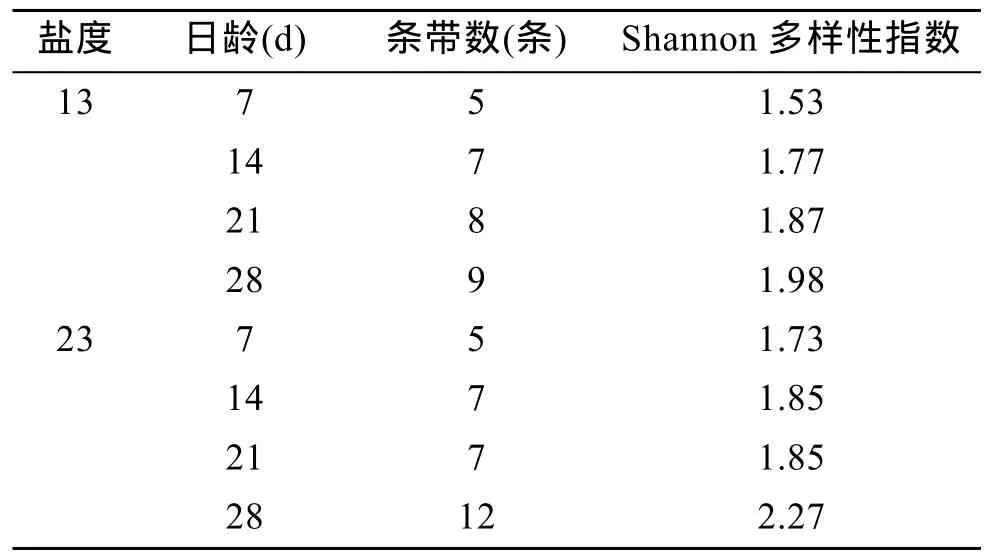
表2 低盐时形成微生物膜中细菌群落多样性指数Tab.2 Analysis of bacterial community diversity in biofilms formed on low salinities

图5 低盐时形成微生物膜中的细菌DGGE指纹图谱的聚类分析Fig. 5 Dendrogram generated from the DGGE profiles
3 讨论
本研究首次证明盐度影响微生物膜形成过程中的生物构成、群落结构, 从而影响其对厚壳贻贝稚贝的附着率也随之升高, 微生物膜的诱导活性与盐度呈显著相关。因而, 盐度不仅是海洋无脊椎动物生存的一个重要环境因子, 而且也是影响海洋无脊椎幼体附着和变态的物理因子[15]。
目前的研究发现, 在单一盐度条件下, 厚壳贻贝稚贝在微生物膜表面的附着率无显著性差异, 但随微生物膜日龄的增长而呈逐渐增加的趋势, 这与以往微生物膜对厚壳贻贝幼体附着的研究结果一致[13]。然而, 杂色鲍的研究中发现其幼虫的附着变态并不随着微生物膜日龄的增加而增加[12], 这有可能与研究的物种不同而有区别。另外, 低盐时所形成微生物膜其日龄与均与微生物膜的干质量、细菌密度和硅藻密度存在显著的正相关性, 而与所含的叶绿素 a却不存在显著性相关。同样, 在海域形成的自然微生物膜研究中发现, 其日龄与微生物膜的干重、细菌密度和硅藻密度显著相关, 而与所含的叶绿素 a含量无相关性。因而, 表明盐度尽管引起微生物膜形成过程中的生物量的变化, 但在同一盐度时对生物量与日龄的两者之间关系无显著性影响。
本实验结果表明, 不同盐度、日龄下微生物膜诱导厚壳贻贝稚贝的附着率与微生物膜的硅藻密度存在显著的正相关性。在盐度23时, 28 d的微生物膜下稚贝的附着率最高。硅藻作为许多经济贝类幼体的主要饵料, 能够为贝类的幼体及其稚贝附着过程中提供充足的饵料, 同时也有可能参与厚壳贻贝稚贝的附着过程, 且释放出一些化学信号物质, 促进了稚贝的附着, 如硅藻的胞外聚合物。然而, 这需要进一步的研究来证实这种假说。此外, 很多研究表明,海洋细菌会对多毛类[16]、棘皮动物[17]、腔肠动物[18]、软体动物[19]、甲壳类[20]、苔藓动物[21]和海鞘[22]等诸多海洋无脊椎动物的浮游幼体的附着变态产生显著影响。本实验结果表明, 厚壳贻贝稚贝的附着率与组成微生物膜的细菌密度存在显著的正相关性, 随着细菌密度的增加, 附着率也随之增加, 表明细菌对厚壳贻贝稚贝的附着产生了相应的影响, 但是细菌是如何影响稚贝附着以及是否与诱导厚壳贻贝幼体附着的方式一样仍需进一步的研究。
微生物膜作为一个微型生物群落, 在不同的盐度下, 其生物群落的组成和生物数量也不相同。叶绿素 a作为一类特殊的色素, 是藻类细胞重要组成部分, 在一定程度上可以反映出微生物膜中能进行光合作用生物的现存量。目前结果表明, 微生物膜的诱导活性与叶绿素 a之间无显著相关性, 因而微生物膜中的能进行光合作用生物与稚贝附着可能无必然联系性。通过采用 DGGE指纹图谱技术, 对微生物膜中细菌群落结构进行分析发现, 在不同的盐度时,微生物膜中所含细菌种类数量和相对含量有所不同。分析发现, 7~21 d日龄范围, 盐度13时的DGGE图谱条带数与相对较高盐度时的条带数相近, 而在28d日龄、盐度13时的DGGE图谱条带数明显低于相对较高盐度时的条带数。同样, 28 d日龄微生物膜中的细菌多样性指数也在盐度23时相对较高, 表明盐度影响且参与调控微生物膜形成过程中的细菌群落结构。然而, 究竟何种菌属在整体细菌群落中发挥主导作用仍需进一步的研究。
总之, 微生物膜的形成受海域环境中的盐度变化影响而发生不断群落演替, 不同盐度形成的微生物膜对厚壳贻贝稚贝的附着行为产生影响。因而, 在贻贝稚贝的附着基的选择过程中, 盐度应作为一个重要因素考虑进来。本研究成果为今后贝类中间培育技术的改善提供了重要科学依据, 同时对于厚壳贻贝稚贝的附着机制的理解具有重要的理论意义。
[1]Zobell C E, Allen E C. The significance of marine bacteria in the fouling of submerged surfaces [J]. J Bacteriol, 1935, 29:239-251.
[2]杨金龙, 王冲, 顾忠旗, 等. 微生物膜对海洋无脊椎动物幼体附着变态的影响研究 [J]. 海洋科学, 2012,36(8): 116-121.
[3]Wieczorek S K, Todd C D. Inhibition and facilitation of settlement of epifaunal marine invertebrate larvae by microbial biofilm cues [J].Biofouling, 1998, 12(1): 81-118.
[4]Qian P Y, Lau S C, Dahms H U, et al. Marine biofilms as mediators of colonization by marine macro organisms: implications for antifouling and aquaculture [J].Mar Biotechnol (NY),2007, 9( 4):399-410.
[5]Wahl M, Goecke F, Labes A, et al. The second skin:ecological role of epibiotic biofilms on marine organisms [J]. Front Microbiol, 2012, 3:1-21.
[6]Flemming H C, Murthy P S, Venkatesan R, et al.Marine and industrial biofouling [M]. Berlin:Springer-Verlag, 2009, 293-313.
[7]Mccliniock J B, Baker J B. Marine chemical ecology[M].Boca Raton: CRC Press, 2001: 431-461.
[8]Bao W Y, Satuito C G, Yang J L, et al. Larval settlement and metamorphosis of the musselMytilus galloprovincialisin response to biofilms [J]. Mar Biol, 150:565-574.
[9]Ganesan A M, Alfaro A C, Higgins C M, et al. Characterization of biofilm exudates and their effects on settlement of mussel (Perna canaliculus)larvae [J]. J Exp Mar Biol Ecol, 2012, 434-435:34-46.
[10]Zhao B, Zhang S, Qian P Y. Larval settlement of the silver-or goldlip pearl oysterPinctada maxima(Jameson)in response to natural biofilms and chemical cues[J]. Aquaculture, 2003, 220(1-4):883-901.
[11]Fitt W K, Labare M P, Fuqua W C, et al. Factors influencing bacterial production of inducers of settlement behavior of larvae of the oysterCrassostrea gigas[J].Microb Ecol, 1989, 17: 287-298.
[12]于秀娟, 严岩, 顾继东. 微生物粘膜对杂色鲍幼虫附着和变态的影响 [J].海洋通报, 2007,26(6): 32-36.
[13]Wang C, Bao W Y, Gu Z Q, et al. Larval settlement and metamorphosis of the musselMytilus coruscusin response to natural biofilms [J]. Biofouling, 2012,28:249-256.
[14]Ma M Y, Liu J L, Wang X M. Biofilms as potential indicators of macrophyte dominated lake health [J].Ecotoxicology, 2011, 20:982-992.
[15]冯丹青, 柯才焕, 周时强, 等. 盐度对冠瘤海鞘幼体附着与变态的影响 [J]. 海洋科学, 2003, 27(1): 42-46.
[16]Unabia C R C, Hadfield M G. Role of bacteria in larval settlement and metamorphosis of the polychaeteHydroides elegans[J]. Mar Biol,1999,133(1): 55-64.
[17]Huggett M J, Williamson J E, de Nys R, et al. Larval settlement of the common Australian sea urchinHeliocidaris erythrogrammain response to bacteria from the surface of coralline algae [J]. Oecologia, 2006,149:604-619.
[18]Tran C, Hadfield M G. Larvae ofPocillopora damicornis(Anthozoa)settle and metamorphose in response to surface-biofilm bacteria [J]. Mar Ecol Prog Ser, 2011, 433:85-96.
[19]Bao W Y, Yang J L, Satuito C G, et al. Larval metamorphosis of the musselMytilus galloprovincialisin response toAlteromonassp. 1: evidence for two chemical cues? [J]. Mar Biol, 2007, 152:657-666.
[20]Maki J S, Rittschof D, Mitchell R. Inhibition of larval barnacle attachment to bacterial films: an investigation of physical properties [J]. Microb Ecol, 1992,23:97-106.
[21]Dobretsov S, Qian P Y. Facilitation and inhibition of larval attachment of the bryozoanBugula neritinain association with mono-species and multi-species biofilms [J]. J Exp Mar Biol Ecol, 2006, 333: 263-274.
[22]张朝霞, 柯才焕, 冯丹青, 等. 海洋附着细菌对冠瘤海鞘幼体附着和变态的影响 [J]. 海洋学报, 2005,27(5): 96-102.
