培养基中不同碳源、激素对披针叶黄华种子无菌苗生长的影响
2013-09-25张春梅陈杰昌张喜军
张春梅,陈杰昌,张喜军
披针叶黄华(Thermopsis lanceolate)别名叫牧马豆或野决明,多年生草本,全世界约有30种,我国有8种及3变种,主要分布于东北、华北、内蒙古、陕西、甘肃、宁夏、青海、新疆、四川等地区,俄罗斯、蒙古也有分布。生于河岸草地、沙丘、林下灌丛中以及田边、路边,偶进入农田[1]。全草药用,能去痰,止咳,有兴奋呼吸,升高血压的功效,主治祛痰止咳[2]。其毒性为全草有毒,产生神经系统兴奋和气官刺激症状[3]。在药学上,传统日用化工及精细化工等领域得到广泛应用,具有极好的开发利用价值。通过植物组织培养方法快速繁殖披针叶黄华,不但加速品种繁育速度,还可扩大种质资源,保持优良品种的特性。种子是建立植物无菌体系的良好外植体[4]。但披针叶黄华种子种皮太硬,出苗时间长[5]。本研究采用披针叶黄华种子作为试材,探讨了培养基中不同种类、浓度碳源和激素对披针叶黄华种子无菌苗萌发的影响,为今后其组织培养或新品种选育奠定基础。
1 试验材料与方法
1.1 试验材料
披针叶黄华种子,MS培养基、葡萄糖、山梨醇、蔗糖、海藻糖、果糖,6-BA、NAA、2,4-D。
1.2 试验方法
1.2.1 培养基 以MS培养基为基本培养基,分别加入碳源(葡萄糖、山梨醇、蔗糖、海藻糖、果糖),激素(6-BA、NAA、2,4-D),碳源分别设120、160、200、240mg/L 四个浓度,激素分别设0.2、0.4、0.6、0.8 、1.0mg/L 五个浓度,不加碳源、激素为对照。将配比好的培养基pH调至6.8,分装到罐头瓶中,121℃灭菌20min。
1.2.2 种子处理 将披针叶黄华种子用纱布包好,置于自来水冲洗10min,沥干水分后,置于超净工作台上,取225粒种子置于75%的酒精溶液中消毒1min,无菌水冲洗5次,用含量8%~9%NaClO的活性氯消毒6min,再将种子用纱布包好放在无菌水中充分冲洗5次,沥干置于接种盘上备用。
1.2.3 置床及发芽 预先将处理好的披针叶黄华种子接种到含有不同浓度碳源(葡萄糖、蔗糖、山梨醇、海藻糖、果糖)不同浓度激素(6-BA、NAA、2,4-D)的 MS培养基中,每瓶3粒,3次重复。置于27℃光照强度为2 000Lx恒温培养箱连续培养7d,观察其生长,测量幼苗生长长度,比较不同种类、浓度碳源以及激素对披针叶黄华种子无菌苗生长的影响。
1.2.4 统计分析 采用DPS9.50数据处理系统对所得结果进行分析。
2 结果分析
2.1 不同碳源对披针叶黄华种子无菌苗生长状况的影响
2.1.1 不同浓度葡萄糖碳源培养基对披针叶黄华种子无菌苗生长状况的影响 由表1可知,在各浓度葡萄糖碳源培养基中,披针叶黄华种子均能萌发为无菌苗,但低浓度葡萄糖对披针叶黄华无菌苗生长有促进作用,高浓度葡萄糖对披针叶黄华无菌苗生长有抑制作用,披针叶黄华无菌苗生长的最佳葡萄糖浓度为160mg/L,与浓度为240mg/L差异显著,说明披针叶黄华无菌苗不宜在较高浓度葡萄糖培养基中生长。
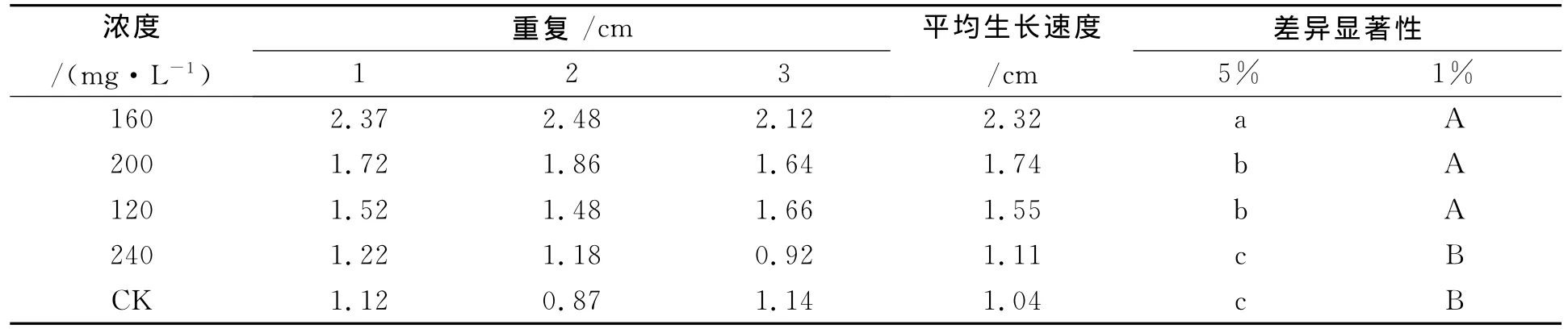
表1 不同浓度葡萄糖对披针叶黄华无菌苗生长状况的影响
2.1.2 不同浓度蔗糖碳源培养基对披针叶黄华种子无菌苗生长状况的影响 由表2可知,在各浓度蔗糖碳源培养基中,披针叶黄华种子都能萌发为无菌苗,但低浓度蔗糖对披针叶黄华无菌苗生长有促进作用,高浓度蔗糖对披针叶黄华无菌苗生长有抑制作用,披针叶黄华无菌苗生长的最佳蔗糖浓度为200mg/L,与浓度为240、160mg/L差异显著,与浓度为120mg/L存在极显著差异,说明披针叶黄华无菌苗不适宜在较高或较低浓度蔗糖培养基中生长。
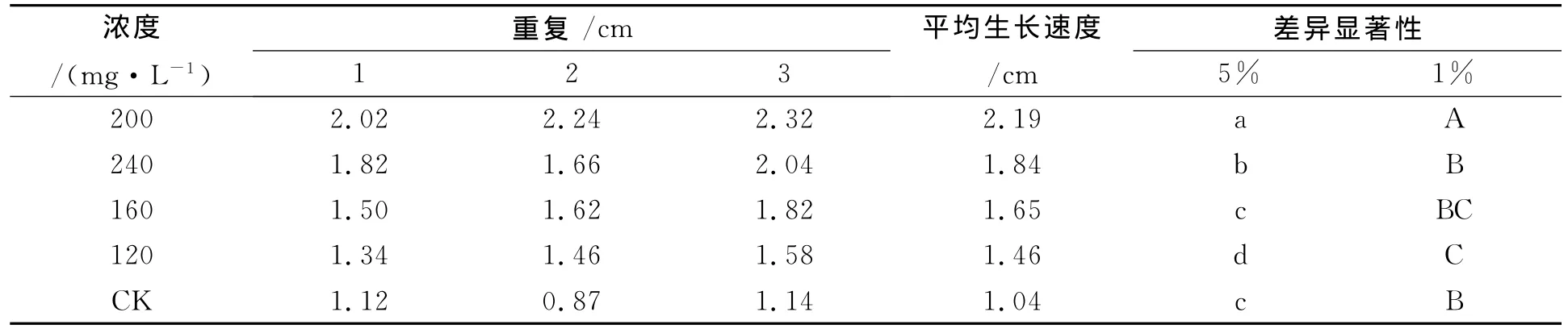
表2 不同浓度蔗糖对披针叶黄华无菌苗生长状况的影响
2.1.3 不同浓度山梨醇碳源培养基对披针叶黄华种子无菌苗生长状况的影响 由表3可知,在各浓度山梨醇碳源培养基中,披针叶黄华种子都能萌发为无菌苗,但低浓度山梨醇对披针叶黄华无菌苗生长有促进作用,高浓度山梨醇对披针叶黄华无菌苗生长有抑制作用,披针叶黄华无菌苗生长的最佳山梨醇浓度为160mg/L,与浓度为200、120mg/L间差异显著,与浓度为240mg/L存在极显著差异,说明披针叶黄华无菌苗不宜在较高或较低浓度山梨醇培养基中生长。
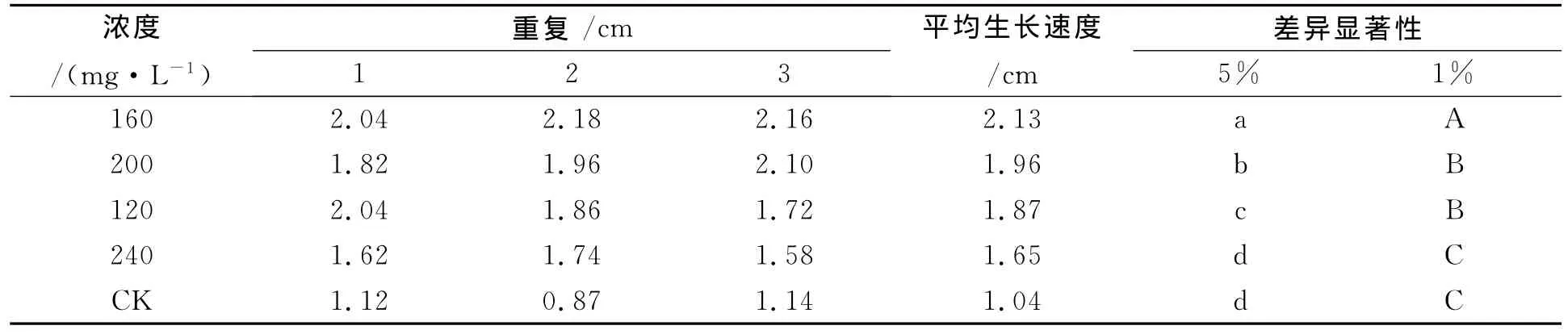
表3 不同浓度山梨醇对披针叶黄华无菌苗生长状况的影响
2.1.4 不同浓度海藻糖碳源培养基对披针叶黄华种子无菌苗生长状况的影响 由表4可知,在各浓度海藻糖碳源培养基中,披针叶黄华种子都能萌发为无菌苗,低浓度海藻糖对披针叶黄华无菌苗生长有促进作用,高浓度海藻糖对披针叶黄华无菌苗生长有抑制作用,披针叶黄华无菌苗生长的最佳海藻糖浓度为200mg/L,但与浓度为240、160mg/L差异不显著,与浓度为120mg/L差异显著,说明披针叶黄华无菌苗不宜在较低浓度海藻糖培养基中生长。
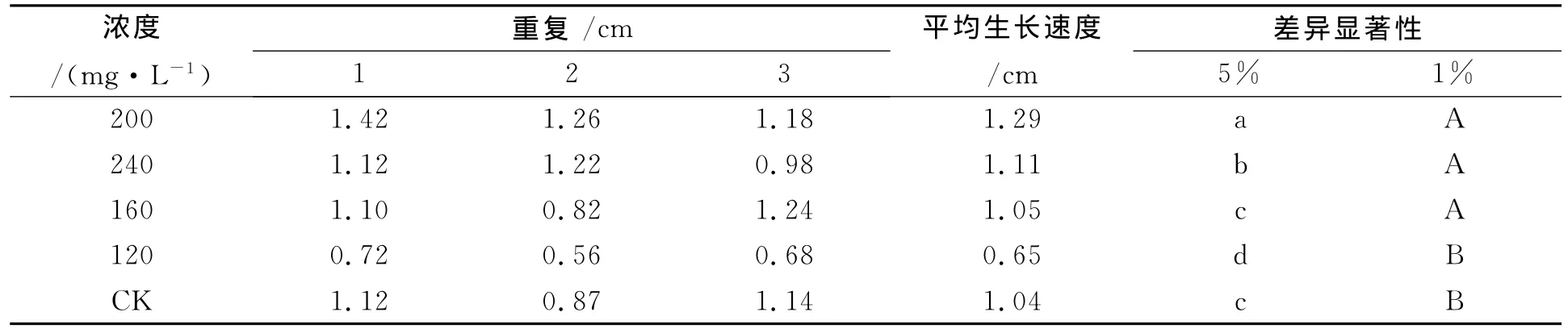
表4 不同浓度海藻糖对披针叶黄华无菌苗生长状况的影响
2.1.5 不同浓度果糖碳源培养基对披针叶黄华种子无菌苗生长状况的影响 由表5可知,在各浓度果糖碳源培养基中,披针叶黄华种子都能萌发为无菌苗,低浓度果糖对披针叶黄华无菌苗生长有促进作用,高浓度果糖对披针叶黄华无菌苗生长有抑制作用,披针叶黄华无菌苗生长的最佳果糖浓度为160mg/L,但与浓度为120、200mg/L间差异不显著,与浓度为240mg/L差异显著,说明披针叶黄华无菌苗不宜在较高浓度果糖培养基中生长。
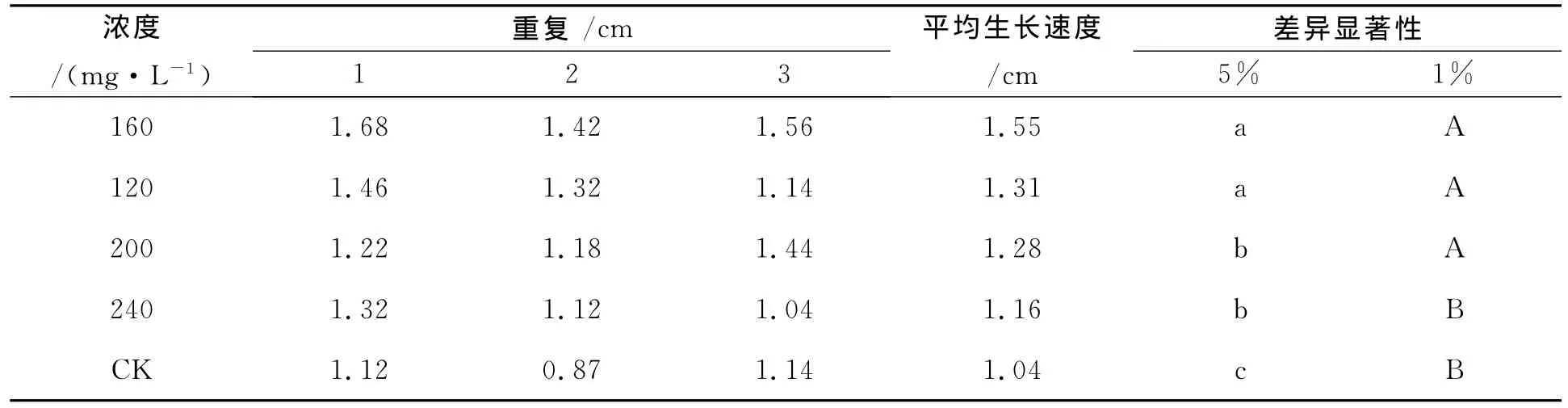
表5 不同浓度果糖对披针叶黄华无菌苗生长状况的影响
由表6可知,在最佳浓度的不同碳源培养基中,披针叶黄华种子都能生长成无菌苗,无菌苗在浓度为160mg/L的葡萄糖碳源的培养基上生长最快(表1)。与浓度为200mg/L的蔗糖存在差异,其次为160mg/L的山梨醇和果糖培养基,200mg/L的海藻糖次之,对照最差。
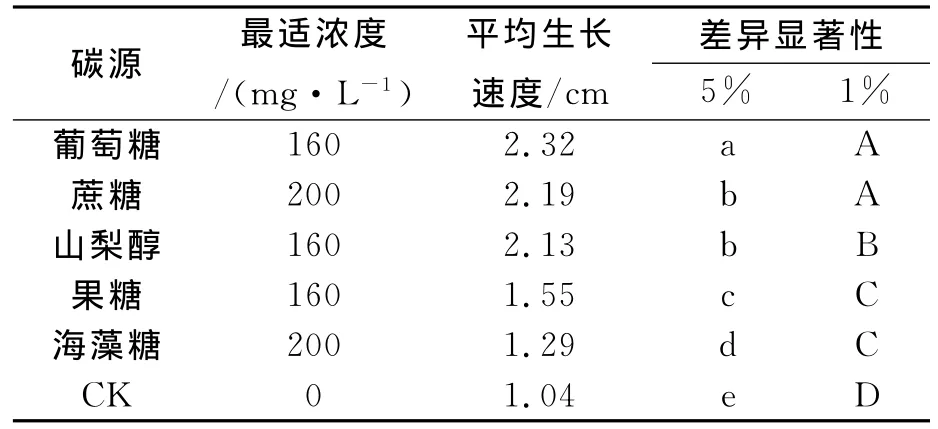
表6 不同碳源最适浓度显著性分析
用葡萄糖、山梨醇、果糖作为碳源时披针叶黄华无菌苗生长的最佳浓度为160mg/L,而当碳源为蔗糖、海藻糖作为碳源时,其最佳浓度为200 mg/L。由此可见,培养基中碳源种类不同时,其对应最佳浓度亦不同。
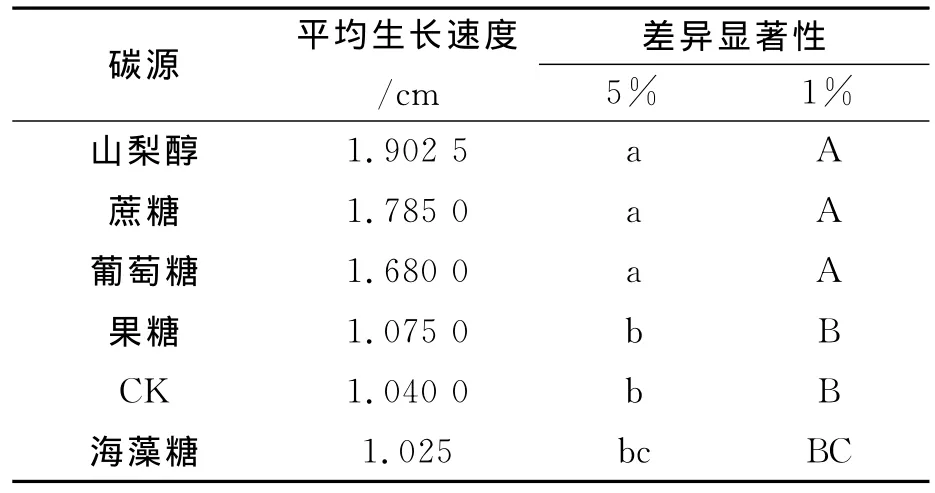
表7 披针叶黄华无菌苗在不同碳源培养基中平均生长速度差异性分析
由表7可知,披针叶黄华无菌苗生长的最佳碳源为山梨醇、蔗糖、葡萄糖,其次为果糖与海藻糖。
2.2 不同激素浓度对披针叶黄华种子无菌苗生长状况的影响
由表8、9可以看中,当6-BA与NAA或2,4-D以一定比配合使用时,有些培养基能诱导出无菌苗,且6-BA的愈伤诱导能力明显强于NAA。0.2mg/L 6-BA +0.8mg/L NAA 诱导率达到22.5%,无菌苗生长率最佳培养基为改良 MS基本培养基0.8mg/L NAA+0.4mg/L 6-BA,其诱导率达到26.7%。这足以说明披针叶黄华无菌苗诱导依赖NAA与6-BA的组合。由此可见,不同基因型、不同外植体来源和激素的配比对植物无菌苗的诱导差异很大。
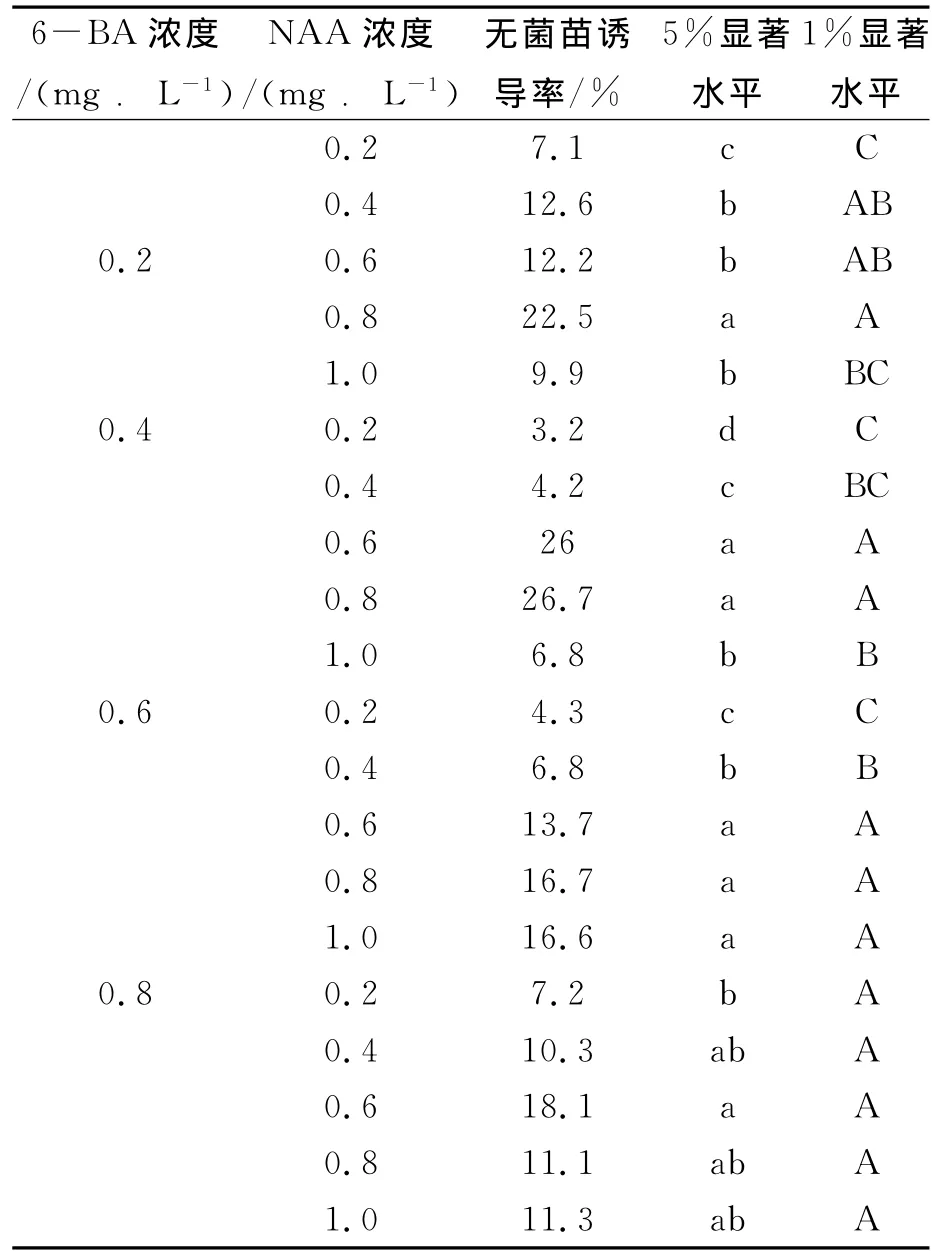
表8 6-BA与NAA的不同浓度配比对披针叶黄华无菌苗的影响
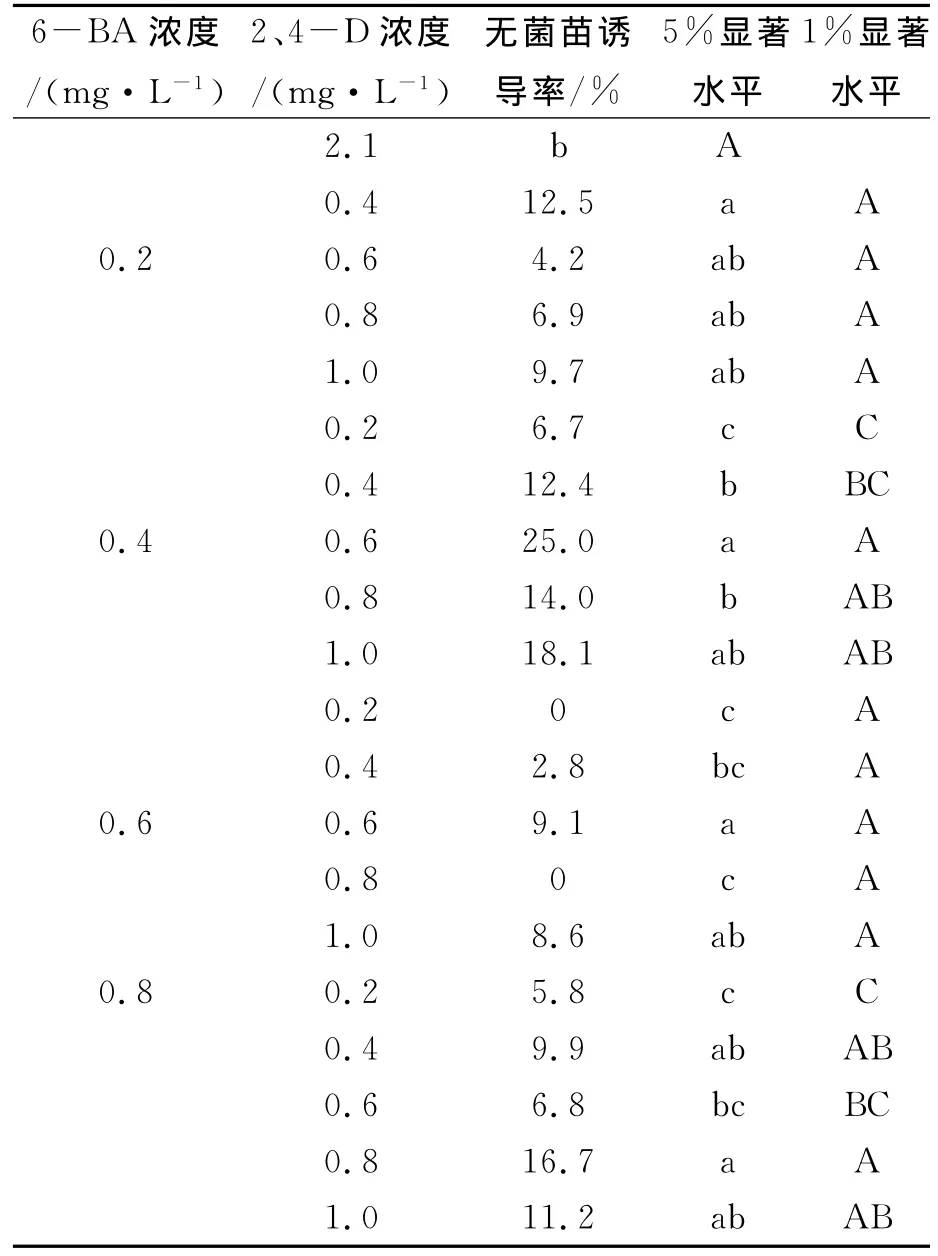
表9 6-BA与2、4-D的不同浓度配比对披针叶黄华无菌苗的影响
3 讨论
3.1 不同激素对种子无菌苗的影响
无菌苗形成过程是一个植物基因型、外植体来源、培养基成分、培养条件等诸多因素之间相互作用的复杂过程,其中生长调节物质的种类、含量及组成比例是调控植物器官产生无菌苗的主导因素[6]。在很多植物中,诱导愈伤时使用较多的是单独 2,4-D[7-8]或者 2,4-D 和 6-BA 组合[9-10]。而橡胶树花药无菌苗的诱导以2,4-D和KT的组合为主[11]。而中国植物研究所通过添加0.5mg/L NAA+1.0mg/L 6-BA+1.2 mg/L 2,4-D 3种激素的组合来诱导叶片无菌苗的产生,但是愈伤诱导率的大小在文章中未见有说明[12]。
3.2 碳源对种子无菌苗的影响
众所周知,不同的培养基所含的营养物质的成分不同,且同一培养基中不同的糖浓度对同一种外植体的作用不同。在植物组织培养中,外植体无菌苗的形成与培养基的成分等都密不可分。文心兰的不同生长发育时期所需蔗糖浓度不一。在一定范围内提高糖浓度对文心兰各诱导生长阶段有明显的促进作用。组织培养试验证明培养基中高渗透势或液体培养基有利于营养素和激素的运转,有利于根的发生和形成质量。植物组织培养中,在植物组织和细胞培养中,一般采用蔗糖、果糖和葡萄糖作为碳源。糖对次生代谢的作用,首先表现在不同的碳源对次生代谢产物的积累及细胞的生长不一致[13]。植物离体细胞作为生物反应器具有生产周期短、易规模化、不受外界环境干扰而且产量高、化学稳定性和化学特性好等特点[14],利用植物离体细胞培养进行次生代谢物质的生产一直受到学术界的重视,也取得了很大进展(如紫草宁、人参皂甙、紫杉醇等)[15-16]。无菌苗经长期继代后分化能力的保持问题,一直是细胞工程研究中的重要课题[17]。已有不少报道指出,无菌苗长期继代后,分化能力降低是较为普遍的现象[18],像胡萝卜、烟草和水稻,在继代多次后,无菌苗分化植株的能力就会完全消失[19-20]也有一些植物的无菌苗在继代中,它们分化能力是可以很好保持的。如玉米,花粉无菌苗继代2年后仍有很强的植株再生能力[21],而无菌苗,有的品种继代保存了近10年了,仍有很强的再生能力,而有的品种刚刚诱导出无菌苗不长时间后,就丧失再生能力。其原因可能与披针叶黄华的基因型有关。有文献报道,改变碳源能够诱导体胚发生[22-23]。但本试验发现,不同碳源对披针叶黄华无菌苗生长的影响各异。葡萄糖和蔗糖有利于披针叶黄华无菌苗的生长,山梨醇和果糖对披针叶黄华无菌苗的生长影响较小,而海藻糖不利于披针叶黄华无菌苗的生长。披针叶黄华无菌苗在不同碳源培养基上的生长能力大小不同。其机理有待于进一步探讨。
[1] 李勇,晁向阳,张永康.披针叶黄华的研究,2007(1):81-82.
[2] 曾建飞.披针叶黄华,北京:中国高等植物图鉴,2002,(2)104-105.
[3] 朱忠珂,赵宝玉.披针叶黄华总生物碱对小鼠的研究[J].西北农林科技大学2003(2)31-32.[4] 魏春雁.披针叶黄华的研究[M].长春:吉林科学出版社,2004.
[5] 周俊辉,周厚高,刘花全.植物组织培养中的内生细菌污染问题[J].广西植物,2003,23(1):41-47.
[6] 郑先波,夏国海,崔红.无籽西瓜种苗无菌苗生长研究[J].河南农业大学学报,2003,37(1):39-43.
[7] 沈雁,周焕起,曹红星.不同外源激素对油棕无菌苗生长的影响[J].种子,2010,29(7):37-39.
[8] 张文君,杨春华,刘帆.不同激素配比对草地早熟禾无菌苗形成的影响[J].四川农业大学学报,2010,28(2):187-190.
[9] 彭丽萍,张远兵,胡正和.中国樱桃离体叶片无菌苗生长的研究[J].安徽农学通报,2010,16(17):51-53.
[10] 尹美强,王玉国,温银元.梨枣叶片和茎段再生体系的建立[J].西北植物学报,2005,25(10):1954-1959.
[11] Kumari J P,Asokan M P,Sobha S.Somatic embryogenesisand plant regeneration from immature anthers ofHevea brasiliensis(Muell.Arg.)[J].Current Science,2009,76(9):1242-1245.
[12] Kala R G,Kuruvila L,Kumari Jayasree P.Secondary embryogenesis and plant regeneration from leaf derived somatic embryos of Hevea brasiliensi[J].Journal of plantation crops,2008,36(3):218-222.
[13] Jin Hoon Kim,Jeong hwan Yun,Yong Soon Hwang.Pro duction of taxol and taxanes in Taxus brevifolia cell cultures:effect of sugar[J].Biotechnology,2005,17(1):101.
[14] 郭志刚.植物细胞培养生产珍稀名贵药用植物替代资源的研究进展[J].高科技与产业化,2005,12:42-43.
[15] 吕春茂,范海延,姜河.植物细胞培养技术合成次生代谢物质研究进展[J].云南农业大学学报,2007,22(1):1-6.
[16] 李晓蕙,陈蕾.植物细胞培养技术的发展与应用[J].安徽农学通报,2006,12(5):74-75.
[17] Hao Y J,Deng X X.Stress treatments and DNA methylation affect somatic embryogenesis from citrus callus[J].Acta Bot Sin,2002,44(6):673-677.
[18] Etienne H,Bertrand B.Somaclonal variation in coffea arabica:effects of genotype and embryogenic cell suspension age on frequency and phenotype of variants[J.Tree Physiol,2003,23(6):419-426.
[19] Button J.The effects of some carbonhydrates on the growth and organization of citrus ovular callus [J].Z Pflanzenphysiol,2001,88:61-68.
[20] Kochba J,Spiegel Roy P,Neumann H.Stimulation of embryogenesis in citrus tissue culture by galactose[J].Naturwissenschaften,2004,65:261-262.
[21] 武琳,钟敏,涂国全.理化因子预处理对玉米芯糖化的影响[J].江西师范大学学报,2010,34(1):98-101.23(6)419-426.
[22] 张俊娥,郭文武,邓秀新.无菌苗倍性变化及其与体细胞胚胎发生能力的关系[J].遗传学报,2006,33(7):647-654.
[23] 范国强,翟晓巧,蒋建平.不同种泡桐叶片无菌苗生长及其植株再生[J].林业科学,2002,38(1):29-35.
