牛体内耻垢分枝杆菌噬菌体的分离与保存
2013-09-23苏胜兵高云航孟庆峰马红霞胡静涛徐凤宇
苏胜兵,高云航,孟庆峰,于 录,马红霞,胡静涛,徐凤宇
(1.吉林农业大学动物科技学院,吉林 长春130118;2.吉林农业大学动物生产及产品质量安全教育部重点实验室,吉林 长春130118;3.吉林大学人兽共患病研究所,吉林 长春130062)
噬菌体是寄生于细菌、支原体、螺旋体、放线菌以及蓝细菌等中的病毒,亦称细菌病毒,在自然界分布极广。由于细菌对抗生素耐药率的不断升高,补充抗生素治疗细菌性疾病方法的研究成为解决该问题的有效途径之一[1]。其中,对噬菌体的研究成为近年来的热点,而噬菌体的分离及特性是其应用的前提。目前的研究以从体外环境中分离的噬菌体居多,然而对动物机体,它们是外来物质,机体易对其产生抗性,不利于噬菌体作为治疗制剂和药物载体的开发。机体内源噬菌体可克服这一不足。故从动物体内分离对某宿主菌特异的噬菌体,对开发其作为诊断和治疗制剂,甚至药物载体都有重要意义。鉴于体内来源噬菌体的潜在价值及耻垢分枝杆菌作为分枝杆菌研究的模式菌种,本试验从副结核感染阳性和阴性奶牛体内分离了耻垢分枝杆菌烈性噬菌体。
1 材料与方法
1.1 供试样本 吉林省某奶牛场送检456份奶牛血清样品。血清学检测呈副结核病阳性或阴性奶牛的唾液和鼻黏液棉拭子共34份。
1.2 供试菌种 耻垢分枝杆菌(Mycobacterium.smegmetismc2155)为吉林大学人兽共患病研究所于录教授馈赠。
1.3 主要试验材料 ELISA检测所用溶液按参考文献[2]配制;7H9培养基为BD公司产品,用其配制双层培养基时上、下层分别加0.7%、1.5%琼脂。
SM液(噬菌体保存液):按参考文献[3]配制;噬菌体保护剂:各种噬菌体保护剂的制备方法及编号如表1和表2。

表1 液体法保存噬菌体所用的保护剂

表2 冻干法保存噬菌体所用的保护剂
1.4 奶牛副结核病的ELISA检测 依参考文献[2]进行。
1.5 唾液和鼻黏液样品的采集 用无菌棉签分别采集12头ELISA检测呈副结核病阳性奶牛和5头呈副结核病阴性奶牛的唾液和鼻黏液,放入灭菌的5mL离心管中,置于4℃冰箱中,次日进行噬菌体的分离。
1.6 噬菌体的分离 参照文献[4]中方法进行,略有改动。向装有棉拭子的5mL离心管中加入2 mL灭菌生理盐水,于4℃冰箱中作用24h,取出棉拭子,将离心管内液体倾入100mL灭菌塑料瓶中,并向其中加入噬菌体提取剂36mL(pH值为9.4),其混合液恒温37℃、恒速250r/min旋转振荡30 min,使提取剂与噬菌体充分接触。9 000r/min离心30min。过滤取上清液,调节pH值到6.6。取9 mL上清液,向其中加入10mL 2倍浓缩的7H9液体培养基、1mL耻垢分枝杆菌72h培养液、2mol/L氯化钙10μL,37℃、150r/min振荡培养48h。静置30min,调节pH 值到9.4,4℃条件下10 000 r/min离心30min,0.22μm微孔滤膜过滤,取上清液,调节pH值至7.3,作为噬菌体原液,用双层平板法检测噬菌体。
1.7 噬菌体的纯化 取培养72h的耻垢分枝杆菌菌液0.5mL,与噬菌体原液0.1mL混匀,室温放置15min,加入5mL 50℃的半固体培养基,混匀后立即倒入下层琼脂平板,制成双层平板,待琼脂凝固后,37℃倒置培养36h后,观察噬菌斑的形态。
用灭菌牙签挑取形态大小一致、单个独立的典型噬菌斑,置于盛有1mL噬菌体保存液的无菌EP管中,室温放置1h后4℃过夜,次日经旋涡振荡器振荡数秒后取0.1mL经过适当稀释后,与耻垢分枝杆菌72h培养液做双层平板进行纯化。重复此步骤3~5次,直至观察到的噬菌斑大小和形态均匀一致,得到纯化的噬菌体原种。
1.8 噬菌体的电镜观察 取适当稀释的纯化噬菌体,经双层平板培养使噬菌斑形成网状后,加入SM液,4℃振荡过夜,洗下噬菌体,11 000r/min离心30 min,取上清液过滤,用2%磷钨酸染色1.5min后,透射电镜观察噬菌体形态、大小。
1.9 噬菌体的保存方法比较 从已经纯化好的噬菌体中,选择Y028T作为保存试验的研究对象。
取20mL7H9培养基,向其中加入1mL耻垢分枝杆菌72h培养液和1mL噬菌体原液,扩增48 h,10 000r/min离心,用0.22μm微孔滤膜过滤,取上清,作为噬菌体保存原液(效价为2.5×107PFU/mL)。
将900μL各种噬菌体保护剂分别与100μL噬菌体保存原液混匀。液体保存组于4℃保存。冻干保护组平均分成两组,冻干后分别于4℃和-70℃保存,每隔30d分别取一管用双层琼脂培养法测定效价,测定6次。
2 结果
2.1 副结核病ELISA检测结果 送检的456份血清样品中,共检出副结核阳性样本12个。
2.2 噬菌体分离结果 采用双层平板法验证发现,耻垢分枝杆菌被侵染,出现大量噬菌斑(图1),呈蚕蚀状,推测样品中含有能裂解耻垢分枝杆菌的噬菌体。
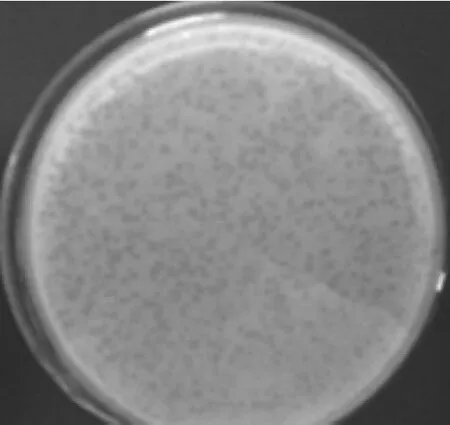
图1 用双层平板法鉴定耻垢分枝杆菌烈性噬菌体
2.3 噬菌体的纯化 采用双层平板法反复纯化,直至得到的噬菌斑形态、大小均一,结果从34份样品中分离到4株噬菌体,依据奶牛编号分别命名为Y028T 、Y010T、Y137T 、162B(图2)。
2.4 噬菌体形态、大小 透射电镜下观察噬菌体的形态,发现所有分离毒株均有一个20面体对称的头部,有尾,有可收缩的尾鞘(图3)。具体大小见表3。
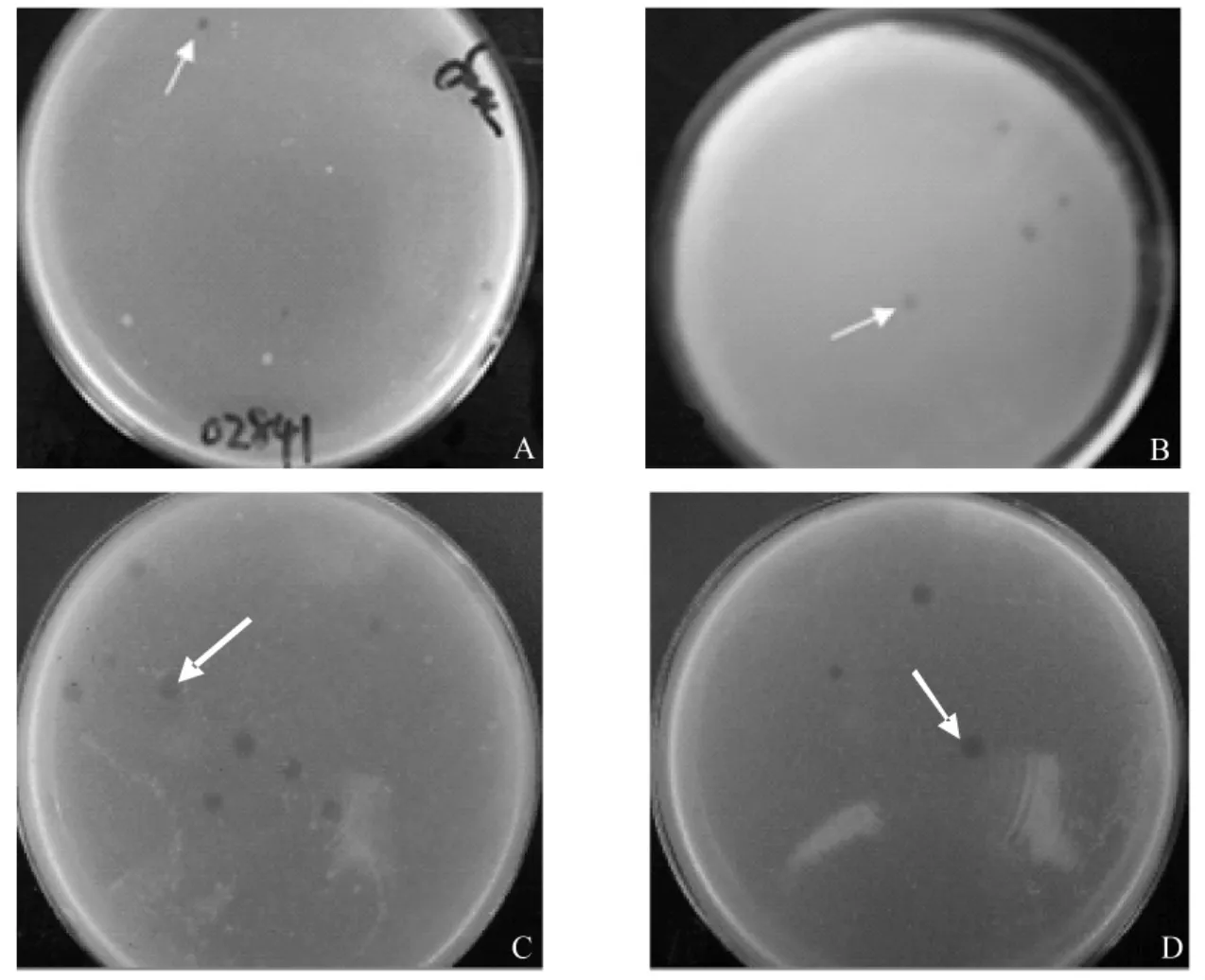
图2 纯化后的Y028T(A)、Y010T(B)、Y137T(C)、162B(D)
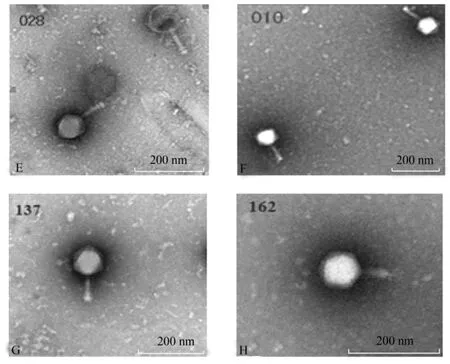
图3 电镜下的Y028T(E)、Y010T(F)、Y137T(G)、162B(H)

表3 电镜下噬菌体的大小
2.5 噬菌体的保存 采用不同保护剂在不同条件下保存Y028T,试验结果为:8种液体保护剂中除SM液外,4℃保存的噬菌体效价均可在半年之内维持较高水平;真空冻干后-70℃保存的效果优于4℃。不同保护剂的保存效果相差较大,其中10%脱脂奶粉冻干后4℃或-70℃保存时,半年内效价仅在4℃保存时下降10倍,说明脱脂奶粉是冻干保存Y028T的最佳保护剂。
3 讨论
3.1 噬菌体的分离 笔者在分离噬菌体时注意到,宿主菌与待分离样品混合后增殖时,气浴恒温振荡器转数应适宜,因为该操作会影响噬菌体对宿主菌的吸附。本试验采用150r/min,效果较好。然而不同噬菌体最适合的转数也不尽相同,需不断摸索确定。此外,噬菌体的分离率还有明显的季节性,如果从动物体外的环境中分离,则在温暖的季节,噬菌体的检出率较高[5]。据Jamalludeen报道,从加拿大安大略省38个猪场污水分离大肠杆菌噬菌体时,6月份~8月份的分离率明显高于4月份和5月份[6]。代保英在10月份、11月份于江苏省扬州市采集了100多份样品,只分离出3株噬菌体,其结果可说明天气寒冷时噬菌体检出率不高[7]。如果从动物体内分离噬菌体,作者认为分离率可能会依机体带菌程度不同而有差异。
3.2 噬菌体的纯化 噬菌体的纯化一般采用双层平板法,有的还须联合液体增殖法[8],本试验仅采用了双层平板法,因为挑取的单斑中噬菌体浓度已超过1.0×105PFU/mL。纯化的次数通常为3~7次,具体次数依纯化的噬菌斑形态是否一致而定。纯化过程中,制备双层平板前,要尽量满足两个条件:一是混匀宿主菌液、噬菌体液和半固体培养基;二是噬菌体液中含有的噬菌体数量不宜过多,最好控制在300 PFU/mL以下。
噬菌体的稀释液也有几种,PBS、SM液、细菌培养液都有报道[9-11]。本试验曾用SM液,但效果不好,后改用不含OADC的7H9培养液,效果很好。
3.3 噬菌体的保存 本研究采用的低温冷冻干燥法保存噬菌体为国际微生物保藏机构通用的方法之一,一般可维持微生物的活力达数年至10余年。研究结果以及关于分枝杆菌噬菌体D29、大肠杆菌O157噬菌体、绿脓杆菌噬菌体的保存研究都证明用10%脱脂奶粉做保护剂的有效性[3,12-13]。
[1] 苏胜兵,马红霞,徐凤宇.噬菌体在细菌性疾病诊断和治疗中的应用[J].中国兽医科学,2011,41(5):546-550.
[2] NY/T 539-2002,副结核病诊断技术[S].北京:中华人民共和国农业行业标准,2002.
[3] 彭丽.噬菌体D29在结核病诊断和治疗中的应用[D].重庆:重庆医科大学,2006.
[4] 张辉,赵炳梓,张佳宝.不同提取方法对土壤中病毒回收率的比较[J].土壤学报,2008,2008,45(3):452-458.
[5] Comeau A M,Buenaventura E,Suttle C A.A persistent,productive,and seasonally dynamic vibriophage population within Pacific oysters(Crassostrea gigas)[J].Appl Environ Microbiol,2005,71(9):5324-5331.
[6] Jamalludeen N,Johnson R P,Friendship R,etal.Isolation and characterization of nine bacteriophages that lyse O149enterotoxigenic Escherichia coli[J].Veterinary Microbiology,2007,124(1-2):47-57.
[7] 代保英.大肠杆菌K88噬菌体的分离、分类鉴定和生物学特性的测定[D].扬州:扬州大学,2009.
[8] 宋彬,熊鸿燕,朱才众,等.侵袭性大肠杆菌烈性噬菌体的筛选及其对宿主菌的抑制效应观察[J].中国消毒学杂志,2007,24(5):397-400.
[9] 周明.大肠杆菌裂解性噬菌体的分离鉴定及其实验治疗[D].长春:吉林大学,2009.
[10]宋彬.致病性大肠杆菌烈性噬菌体的筛选及其生物学效应研究[D].重庆:中国人民解放军第三军医大学,2007.
[11]马玉玲.猪链球菌2型烈性及溶源性噬菌体的分离与鉴定[D].南京:南京农业大学,2007.
[12]杜崇涛.大肠杆菌O157噬菌体的分离鉴定及其初步应用[D].长春:吉林大学,2005.
[13]张克斌.铜绿假单胞菌噬菌体的分离鉴定及其基因组学研究[D].重庆:中国人民解放军第三军医大学,2001.
