辣木茎叶中水溶性多糖的提取及抗氧化活性的研究
2013-09-05梁鹏甄润英
梁鹏,甄润英
(1.天津农学院食品科学系,天津 300384;2.天津市农副产品深加工技术工程中心,天津 300384)
辣木茎叶中水溶性多糖的提取及抗氧化活性的研究
梁鹏1,2,甄润英1,2
(1.天津农学院食品科学系,天津 300384;2.天津市农副产品深加工技术工程中心,天津 300384)
摘 要:主要探讨辣木茎叶中水溶性多糖的提取工艺条件以及抗氧化活性。以辣木茎叶干粉为原料,采用水为提取剂,通过单因素和正交试验对浸提温度、浸提时间及料液比进行研究;采用水杨酸法和邻苯三酚法分别测定辣木多糖对羟自由基以及超氧阴离子的清除率,以确定提取物的抗氧化活性。实验条件下辣木茎叶多糖最佳提取工艺条件为料液比1∶20(g/mL)、浸提温度80℃、浸提时间120 min,在此条件下,辣木粗多糖的提取率可达5.66%;多糖提取物对羟自由基及超氧阴离子均有清除作用,且随着提取物浓度的提高对二者的清除作用逐渐增强,存在剂量效应关系。清除作用的半数抑制率(IC50)分别是7.252 8 mg/mL和2.501 1 mg/mL。
关键词:辣木;多糖;提取工艺;抗氧化活性
植物多糖常见的有枸杞多糖、黄芪多糖、人参多糖等[1]。我国对多糖的研究起步于20世纪70年代,越来越多的人们把目光投向植物多糖,因此植物多糖的提取成为研究工作的焦点之一[2]。目前植物多糖提取的方法主要包括:溶剂提取法、酶解法、超滤法、酸提法、碱提法、超声波强化法、微波法等[3]。
辣木(Moringa oleifera)又称鼓槌树(Drumsticktree),为辣木科辣木属植物,起源于印度西北部的喜马拉雅山南麓。研究发现,辣木除了具备丰富的营养外,还用作治疗糖尿病、高血压、皮肤病、免疫力低下、贫血、骨骼疾病、抗忧郁、关节炎、消化器官肿瘤等疾病的传统药材[4]。辣木作为一种功能性植物,有着广阔的的开发前景[5]。辣木全株都可利用,营养物质种类多,富含 VA、VB、VC、VE及钙、钾、铁等矿质营养元素,此外还含有人体必需的各种氨基酸和微量元素等,其营养价值与现代营养学家称为“人类营养的微型宝库”的螺旋藻相当。已研究发现的一些化学物质如:具有高度的抗氧化能力的α-生育酚、β-生育酚、δ-生育酚,抗肿瘤成分的β-谷甾醇、硫代氨基甲酸盐,高效杀菌作用的凤尾辣木素、辣木素,具有净水功能的辣木蛋白质,促进植物生长的玉米素等[6]。辣木多糖是辣木中重要的有效成分之一,有很广泛的利用价值[1]。
本试验将以辣木茎叶干粉为原料,以水为提取溶剂对辣木茎叶中的植物多糖进行提取,并且对提取物进行体外功能实验,评价其抗氧化活性,为辣木的进一步开发利用提供科学的理论参考。
1 材料与方法
1.1 材料
辣木:购于广州大华种植基地。
1.2 试剂
无水乙醇、苯酚、浓硫酸、乙酸锌、亚铁氰化钾、1 mmol/LFeSO4溶液、3 mmol/LH2O2溶液、3 mmol/L 水杨酸溶液、Tris-HCL缓冲液、3 mmol/L邻苯三酚溶液、10 mmol/LHCL溶液、抗坏血酸、葡萄糖标准品,等等(以上试剂均为分析纯)。
1.3 仪器
新型密封式粉碎机:旭众机电设备有限公司;LD5-2B型低速离心机:北京雷勃尔离心机有限公司;SHB-Ⅲ循环水式多用真空泵:郑州长城科工贸有限公司;RE-2000旋转蒸发仪:上海亚荣生化仪器厂;HH数显恒温水浴锅:金坛市金城国胜实验仪器厂;DGX-9243BC-1型电热恒温鼓风干燥箱:上海福玛实验设备有限公司;WFJ7220型可见分光光度计:上海尤尼柯仪器有限公司。
1.4 方法
1.4.1 辣木多糖的提取工艺流程
辣木茎叶→干燥、粉碎→热水浸提→离心→过滤→浓缩→除蛋白→醇沉→离心→干燥→粗多糖成品
1.4.2 辣木多糖提取因素的筛选
称取1 g左右的辣木茎叶样品粉末,根据设定的因素水平,加入一定量的水置于一定温度的恒温水浴锅里浸提,提取完毕后通过4 000 r/min离心10 min,得到辣木多糖提取液。
1.4.2.1 提取条件的单因素实验设计
本实验分别考察浸提温度、浸提时间、料液比三个因素对水溶剂提取多糖效果的影响。
1)不同浸提温度对多糖提取效果的影响
采用料液比为1∶20,浸提时间为120 min,浸提温度分别为 50、60、70、80、90 ℃下多糖的提取率。
2)不同浸提时间对多糖提取效果的影响
采用料液比为1∶20,浸提温度为70℃,浸提时间分别为 60、90、120、150、180 min 下多糖的提取率。
3)不同料液比对多糖提取效果的影响
采用浸提温度为70℃,浸提时间为120min,测定料液比分别为 1∶10、1∶15、1∶20、1∶25、1∶30 下多糖的提取率。
1.4.2.2 辣木多糖提取条件的正交试验
根据单因素实验得出的结果,以浸提温度、浸提时间、料液比为三因素,设计三因素三水平的正交试验,设定的因素水平见表1。

表1 正交因素与水平表Table 1 orthogonal factors level table
1.4.2.3 提取工艺条件的重复性试验
分别称取五份辣木茎叶干粉,每份各1.00 g,在正交试验得出的提取最优条件下提取辣木茎叶多糖,测定多糖提取率,观察试验工艺的可重复性。
1.4.3 多糖含量的测定以及辣木茎叶多糖产物的获得
1.4.3.1 多糖含量的测定
采用苯酚-硫酸法测定多糖含量。多糖提取率按式(1)计算。

1.4.3.2 辣木茎叶多糖产物的获得
将样品提取液于70℃下真空浓缩,浓缩至原体积的1/5~1/4,加入4℃的乙醇,使乙醇浓度为80%,注意边加边搅拌,保证浓缩液内部醇浓度均一,以使多糖尽可能的沉淀,将醇沉液放置于4℃条件下静置过夜,4 000 r/min离心15 min。沉淀物放入干燥箱中50℃烘干至恒重,干品即粗多糖。
1.4.4 多糖功能性试验方法
本研究对多糖体外抗氧化活性进行了测定。测定指标为提取物对羟自由基(·OH)的清除作用及超氧阴离子清除率。
1.4.4.1 羟自由基(·OH)的清除作用
操作方法:在25 mL的比色管中依次移取5 mL 1 mmol/L硫酸亚铁溶液,空白管和样品管各加入5 mL 3 mmol/L H2O2溶液,样品管加入1 mL样品溶液,空白管中样品溶液用蒸馏水代替,混合均匀后用3 mmol/L水杨酸溶液定容至刻度。在(37±0.1)℃的恒温水中反应15 min后用分光光度计在510 nm的波长下测定吸光度。若样品溶液颜色较深,则设本底管,本底管中H2O2溶液用蒸馏水代替,按上述方法测定吸光度。空白管为 A0,样品管为 A1,本底管为 A2。
其对·OH自由基的清除率SA(%),可根据下式(2)进行计算:
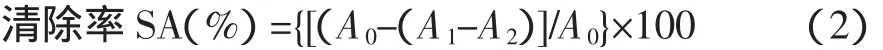
1.4.4.2 超氧阴离子清除率
操作方法:在25 mL比色管中分别加入Tris-HCl缓冲液(0.05 mol,pH=8.2)4.5 mL,3.2 m:蒸馏水,1 mL样品溶液,空白管中样品溶液用Tris-HCl缓冲液代替,0.3 mL 25℃下预热过的邻苯三酚溶液(3.0 mmol/L),本底管中邻苯三酚溶液用10 mmol/L的HCl溶液代替;于25℃保温20 min后,在299 nm下测定其吸光度。计算样品对超氧自由基的清除效率。按照下列公式(3)对样品的样品超氧阴离子清除率进行计算:

式中:A0为不加样品的吸光度;A1为加入样品的吸光度;A2为本底的吸光度。
2 结果与分析
2.1 浸提温度对多糖提取率的影响
在料液比为 1∶20(g/mL),浸提时间为 120 min,不同浸提温度下多糖的提取率见图1。
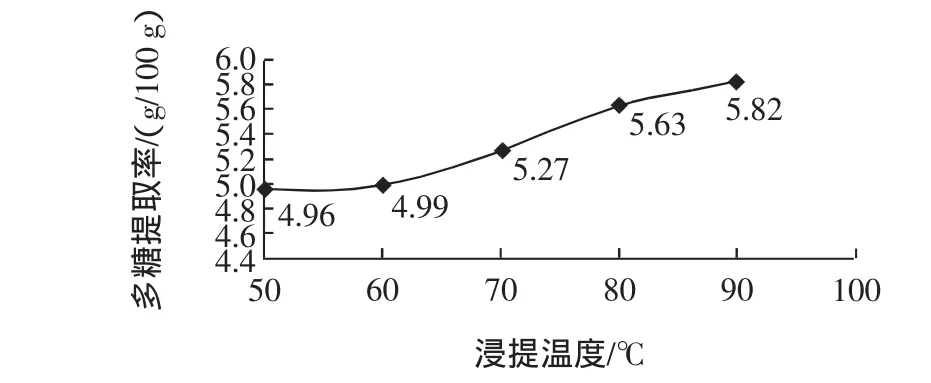
图1 不同浸提温度下多糖的提取率Fig.1 The extraction rate of polysaccharide at different extraction temperatures
由图1可知,辣木茎叶多糖的提取率随着温度的升高而逐渐增加。试验中60℃~80℃下的提取率的变化幅度较大,而80℃~90℃下的提取率变化趋于平缓。因此,在正交试验中采用60、70、80℃的浸提温度进行提取。
2.2 浸提时间对多糖提取率的影响
在料液比为 1∶20(g/mL),浸提温度为 70 ℃,不同浸提时间下多糖的提取率见图2。
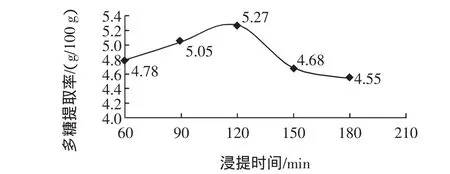
图2 不同浸提时间下多糖的提取率Fig.2 The extraction rate of polysaccharide at different extraction time
由图2可知,辣木茎叶多糖提取率随着浸提时间的增加而增加,提取时间达到120 min时提取率达到最大值,但当浸提时间超过120 min以后,随着浸提时间的延长,多糖的提取率反而降低。因此,在正交试验中采用90、120、150 min的浸提时间进行提取。
2.3 料液比对多糖提取率的影响
在浸提温度为70℃,浸提时间为120 min,不同料液比下多糖的提取率见图3。
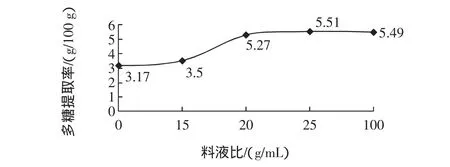
图3 不同料液比下多糖的提取率Fig.3 The extraction rate of polysaccharide at different solidliquid ratio
由图3可知,辣木茎叶多糖的提取率随着料液比的增加而升高,当料液比达到1∶25时多糖的提取率最高,随后随着料液比的增加提取率平缓下降。因此,在正交试验中采用 1∶20、1∶25、1∶30 的料液比进行提取。
2.4 提取条件的正交试验
2.4.1 正交试验结果和直观极差分析
提取条件的正交试验结果和极差分析见表3,两个平行试验提取率分别以a、b表示,以Tt两次平行试验提取率之和,以Tr表示每次平行试验之和,以T表示两次平行试验提取率总和。
由表2可知,直观极差分析影响辣木茎叶多糖提取率的因素顺序为:浸提时间>浸提温度>料液比,最优提取工艺条件为A3B2C2,即浸提时间120 min,浸提温度 80 ℃,料液比 1∶25。
2.4.2 正交试验方差分析
试验方差分析结果见表3。
由表3可知,方差分析得出浸提时间对多糖提取率的差异性达到了极显著水平,但是考虑到能耗,资源利用等因素,故将浸提时间定为120 min;浸提温度对多糖提取率的差异性达到显著水平,故将浸提温度定为80℃;料液比1∶20(g/mL)时较突出,但料液比对多糖提取率的差异性不显著。

表2 正交试验结果Table 2 Result of orthogonal test
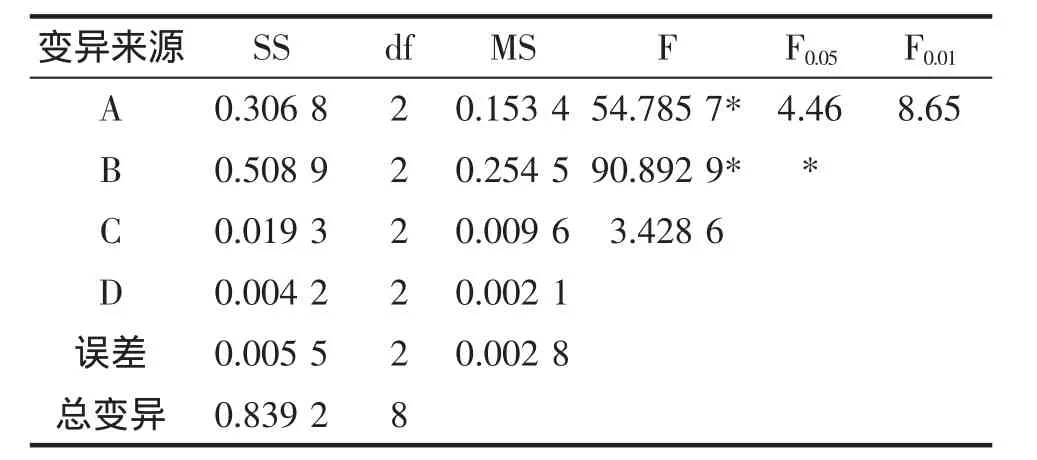
表3 正交试验方差分析Table 3 Variance analysis of orthogonal test
2.4.3 验证试验
由于正交试验直观极差分析结果(浸提温度80℃、料液比1∶25、浸提时间120 min)与方差分析结果(浸提温度 80 ℃、料液比 1∶20、浸提时间 120 min)不同,所以将直观极差分析最优条件和方差分析的最优条件进行试验比较,结果见表4和表5。
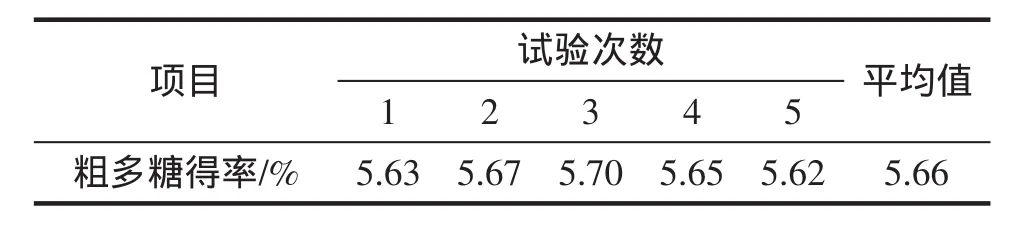
表4 直观分析最优提取条件下多糖提取率(料液比1∶25)Table 4 Intuitive analysis of the extraction rate of polysaccharide on the optimum extraction condition(solid-liquid ratio of 1∶25)

表5 方差分析最优提取条件下多糖提取率(料液比1∶20)Table 5 Variance analysis of the extraction rate of polysaccharide on the optimum extraction condition(solid-liquid ratio of 1∶20)
检验不同试验方法处理所得结果的差异显著性,通常用t检验法:t0.05(8)=2.306,t0.01(8=3.355),且t<t0.01(8),所以2种不同处理条件下提取率差异不显著。通过变异系数对直观和极差分析结果进行分析:变异系数是标准差相对于平均数的百分数,记为CV。变异系数同标准差一样是衡量资料变异程度的统计计量,可以比较多次平行测定结果的相近程度。一般来说,变异系数越小,测定结果之间的接近程度越好。计算得直观分析以及极差分析下的变异系数CV分别为0.574%、0.455%,数值均较小,充分说明直观极差分析、方差分析所得最优条件下提取多糖试验的重复性均较好。
2.5 多糖的功能性试验结果
依2.4.4所示步骤考察辣木茎叶多糖提取液体外清除羟自由基以及超氧阴离子的作用,并以抗坏血酸标准溶液作为阳性对照。
2.5.1 多糖提取物对羟自由基的清除作用
2.5.1.1 多糖样品对羟自由基的清除作用
不同浓度多糖对羟自由基清除作用见图4。

图4 不同浓度的辣木多糖对羟自由基的清除率的影响Fig.4 The effect of different concentrations of Moringa Oleifera Polysaccharide on the clearance rate of hydroxyl radical
由图4的结果可知,辣木茎叶多糖对羟自由基的影响随多糖的浓度增加而逐渐增强,多糖浓度在1 mg/mL~12 mg/mL时,对羟自由基的清除效果变化显著,当浓度达到12 mg/mL以后,对羟自由基的清除效果趋于平缓。经计算辣木多糖对羟自由基清除作用的IC50为 7.252 8 mg/mL。
2.5.1.2 抗坏血酸清除羟自由基的作用
不同浓度抗坏血酸对羟自由基清除作用见图5。

图5 不同浓度抗坏血酸对羟自由基清除率的影响Fig.5 The effect of different concentrations of Ascorbic acid on the clearance rate of hydroxyl radical
由图5的结果可知,抗坏血酸对羟自由基的清除效果与抗坏血酸的浓度成正相关。在抗坏血酸的浓度达到0.16 mg/mL之后,对羟自由基清除率的影响效果趋于平缓。经计算抗坏血酸对羟自由基清除作用的IC50为 0.046 27 mg/mL。
由2.5.1.1和2.5.1.2可知,辣木茎叶多糖具有清除羟自由基(·OH)的作用,但是清除能力明显低于阳性对照物抗坏血酸(VC)。
2.5.2 多糖提取物对超氧阴离子的清除作用
2.5.2.1 多糖样品清除超氧阴离子的作用
不同浓度多糖对超氧阴离子清除作用见图6。
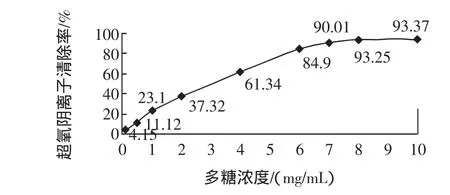
图6 不同浓度辣木多糖对超氧阴离子清除率的影响Fig.6 The effect of different concentrations of Moringa Oleifera Polysaccharide on the clearance rate of superoxide anion
由图6的结果可知,辣木茎叶多糖对超氧阴离子的清除率随多糖的浓度增加而逐渐增强,多糖浓度在0.1 mg/mL~6 mg/mL时,对超氧阴离子的清除效果变化显著,当浓度达到8 mg/mL以后,对超氧阴离子的清除效果趋于平缓。经计算辣木多糖对超氧阴离子清除作用的IC50为2.501 1 mg/mL。
2.5.2.2 抗坏血酸清除超氧阴离子的作用
不同浓度抗坏血酸对超氧阴离子清除作用见图7。
由图7的结果可知,抗坏血酸对超氧阴离子的清除效果与抗坏血酸的浓度成正相关。在抗坏血酸的浓度达到0.06 mg/mL之后,对羟自由基清除率的影响效果趋于平缓。经计算抗坏血酸对超氧阴离子清除作用的 IC50为 0.019 3 mg/mL。
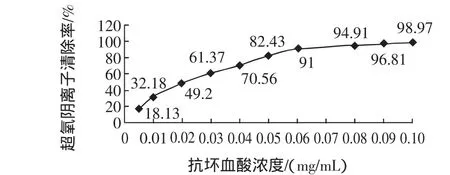
图7 不同浓度抗坏血酸对超氧阴离子清除率的影响Fig.7 The effect of different concentrations of Ascorbic acid on the clearance rate of superoxide anion
由2.5.2.1和2.5.2.2可知,辣木茎叶多糖具有清除超氧阴离子的作用,但是清除能力明显低于阳性对照物抗坏血酸(VC)。
3 结论
根据试验得出了水溶剂提取法提取辣木中水溶性多糖的最优工艺:浸提时间120 min、浸提温度80℃、料液比1∶20(g/mL),在此工艺下粗多糖提取率可达到5.66%。辣木多糖具有一定的抗氧化活性,在低浓度下,对羟自由基和超氧阴离子的清除作用均效果显著并随多糖浓度的增加而逐渐增强,当达到一定浓度后,对二者的清除效果趋于平缓。由实验结果计算可知,辣木多糖对羟自由基和超氧阴离子清除作用的IC50分别是7.252 8 mg/mL和2.501 1 mg/mL。
:
[1]任安祥,贺银凤,靳桂敏,等.辣木水溶性多糖提取工艺的研究[J].食品科技,2007,10(5):191-194
[2]叶凯贞,黎碧娜,王奎兰,等.多糖的提取分离与纯化[J].广州食品工业科技,2004,20(3):144-145
[3]许燕燕.植物多糖的提取方法和工艺[J].福建水产,2006(3):32-36
[4]刘昌芬,李国华.辣木的营养价值[J].热带农业科技,2004,27(1):4-7
[5]盘李军,刘小金.辣木的栽培及开发利用研究进展[J].广东林业科技,2010,26(3):71-77
[6]洪林,魏召新,李隆华,等.辣木资源研究利用现状[J].西南园艺,2006,34(1):56-57
Study on Extraction and Antioxidant Activity of Water-soluble Polysaccharides from Moringa Oleifera
LIANG Peng1,2,ZHEN Run-ying1,2
(1.Food Science Department of Tianjin Agricultural College,Tianjin 300384,China;2.Tianjin Engineering and Technology Research Center of Agricultural Products Processing,Tianjin 300384,China)
Abstract:In order to explore the extraction conditions of water-soluble polysaccharide from theMoringa oleiferaleaves and antioxidant activity of it,dry powder was used as raw materials and using water as extracting solvent to extract polysaccharide fromMoringa oleifera.The extraction temperature,time and solid-liquid ratio were optimized by orthogonal experiments.Then,use methods of Salicylic acid and Pyrogallol to test antioxidant activity on polysaccharide fromMoringa oleiferain different concentrations respectively.The results showed that the extraction rate was up to 5.66%,the optimal extraction conditions was extract 120 min,using 80 ℃ hot water at a solid-liquid ratio of 1∶20 (g/mL).The polysaccharides fromMoringa oleiferaleaf had a certain degree of antioxidant activities in vitro:scavenge OH·oand O2-in a dose-dependant manner with theIC50of 7.252 8 mg/ml and 2.501 1 mg/ml respectively.
Key words:Moringa oleifera;polysaccharide;extraction technology;antioxidant activity
DOI:10.3969/j.issn.1005-6521.2013.14.008
梁鹏(1980—),男(汉),中级实验师,硕士,主要从事食品加工方面的教学科研工作。
2013-03-08
