miR-350在腹主动脉部分缩窄大鼠心肌组织中的表达及意义
2013-09-04张淑华吴志婷章志玲潘淑娟王云霞刘秋玲葛郁芝
张淑华,吴志婷,章志玲,潘淑娟,王云霞,刘秋玲,葛郁芝
(江西省人民医院、江西省心血管病研究所,南昌 330006)
miRNA有调控细胞分化和发育的作用,在心血管系统的生理病理过程中起重要作用[1]。研究证实,miRNA在有疾患的心脏和血管中表达失控。纠正这些失控miRNA的表达,对心肌肥厚、心肌重构和心律失常有显著的逆转效果[2]。miR-1和miR-133是最早确认的具有横纹肌组织表达特异性的miRNA,二者广泛参与心脏发育、心肌肥厚和心律失常等心脏生理和病理生理过程,在调控心脏基因的表达过程中发挥重要作用[3,4]。因此,miRNA 作为心肌重要的调节因子,将成为治疗心脏疾病的重要靶点。2011年3~12月,我们观察了腹主动脉部分缩窄大鼠心肌组织miR-350在心肌肥厚形成过程中的表达变化,并探讨其临床意义。现报告如下。
1 材料与方法
1.1 材料 雄性 SD大鼠20只,体质量180~210 g,购自江西中医学院。大鼠胚胎心肌细胞H9c2细胞购自ATCC。盐酸氯胺酮(5%),青霉素(80万U/4 mL),庆大霉素(8万U/2 mL);培养基、胰酶、抗生素、DMSO等购自Gibco公司;胎牛血清购自PAA公司;FuGene HD购自Roche公司;Trizol购自Invitrogen公司;SYBR GreenⅠ荧光定量PCR试剂盒购自ABI公司。
1.2 方法
1.2.1 模型制作与处理 将大鼠随机分成正常组5只、假手术组5只和模型组10只。分离腹主动脉和肾动脉后,在肾动脉分支上方约1 cm处,将7号注射针头与腹主动脉一起结扎,然后抽出针头,造成腹主动脉部分缩窄。术后应用超声诊断仪连续监测室间隔舒张末期厚度(IVSTd),左室后壁舒张末期厚度(LVPWTd)及左室舒张末期内径(LVDd)。7周后处死大鼠,取出心脏并解剖,在预冷的D-hanks液中漂洗干净,计算心脏质量/体质量(HW/BW)、左室质量/体质量(LVW/BW)。用Trizol法提取心肌组织RNA,采用芯片技术检测miRNA表达。
1.2.2 细胞培养和转染 H9c2细胞常规培养于10%胎牛血清及100 U/mL青霉素、100 μg/mL链霉素的DMEM培养液中,置于含5%CO2的37℃细胞培养箱中培养。细胞转染前1 d换成无双抗的培养基。用 250 μL Opti-MEM 稀释 2 μg DNA,250 μL opti-MEM 稀释5 μL FuGene HD,室温孵育5 min;将DNA和FuGene HD混合室温孵育15 min,6孔板换成Opti-MEM培养基,加入孵育好的混合物;转染4~6 h后换成完全培养基。血管紧张素Ⅱ诱导H9c2细胞肥大作为阳性对照,空质粒和未处理的H9c2细胞作为阴性对照,同时我们合成了shRNAMAPK14的质粒和miR-350的质粒用于转染H9c2细胞。
1.2.3 H9c2细胞直径检测 构建表达该特异性miRNA的质粒载体,以Mock为对照,转染H9c2细胞,加入1×10-6mol/L AngⅡ孵育48 h后,用Image J软件分析检测H9c2细胞直径。
1.2.4 miR-350及H9c2肥厚相关基因的表达检测 细胞转染96 h后,提取每组细胞的总RNA,采用miR-350荧光定量PCR试剂盒对miR-350进行定量分析,SYBR GreenⅠ荧光 PCR试剂盒检测ANP、BNP、β-myosin 及 α-actin,SYBR GreenⅠ荧光PCR试剂盒进行定时定量PCR(qPCR)检测。Realtime PCR反应程序:94℃ 2 min;94℃ 10 s,60℃15 s,72℃ 30 s;40个循环。荧光信号采集设在72℃(每循环第3步反应时)。熔解度曲线程序设置为:95℃,2 min;72 ℃,1 min;95 ℃,30 s,步进0.5℃/s;30℃,1 min。在运行之前,调节增益使荧光本底值≤20,也可根据试剂的实际情况调整;仪器检测通道选择设定为F1(SYBR GreenⅠ)通道。PCR引物设计使用Primer 5.0软件,由上海生工生物工程有限公司合成。引物见表1。

表1 PCR引物序列
1.2.5 统计学方法 采用SPSS13.0统计软件,计量资料以表示,多组间比较用单因素方差分析。P≤0.05为差异有统计学意义。
2 结果
2.1 模型超声及解剖指标结果 造模4周后,模型组IVSTd由(1.63 ±0.21)mm 增至(2.34 ±0.11)mm,造模前后比较有统计学差异(P<0.05);LVPWTd及LVDd无明显变化。造模7周后,模型组IVSTd由(2.40 ±0.03)mm 减至(1.87 ±0.21)mm,LVPWTd由(2.52 ±0.24)减至(1.77 ±0.17)mm,LVDd由(6.83±0.28)mm 减至(4.50 ±0.19)mm,造模前后比较有显著统计学差异(P<0.05或<0.01)。假手术组、正常组上述三项指标无明显变化(P均>0.05)。解剖发现模型组心脏大于正常组,质量增加,左室增厚显著,HW/BW和LVW/BW均高于假手术组和正常组(P均<0.05)。
2.2 芯片结果 模型组miR-350表达比假手术组上调6倍(图1),其他microRNAs表达则无统计学差异。Real-time PCR法检测 miR-350表达发现miR-350上调6倍左右,与芯片结果一致,正常组和对照组间没有表达差异。

图1 芯片结果(箭头所指代表miR-350)
2.3 过表达miR-350后H9c2细胞变化 见图2。正常组和阴性对照组没有表达差异,血管紧张素Ⅱ诱导H9c2细胞肥大的阳性对照组发生明显肥大。过表达miR-350组第1~3天H9c2细胞未出现明显变化,第5天时肥大明显。转染shRNA-MAPK14质粒组的H9c2细胞肥大,但没有miR-350组明显。
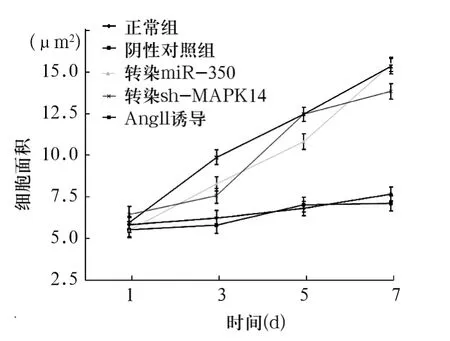
图2 过表达miR-350后H9c2细胞变化
2.4 过表达miR-350对H9c2肥厚相关基因表达的影响 正常组和阴性对照组没有表达差异,AngⅡ诱导H9c2细胞肥大的阳性对照组β-myosin、α-actin、ANP、BNP 基因分别上调 1.5、2.0、3.0 和 2.2倍;转染 shRNA-MAPK14质粒组 β-myosin、α-actin、ANP、BNP 基因分别上调1.9、2.0、3.0 和 2.2 倍,转染 miR-350 组 β-myosin、α-actin、ANP、BNP 分别上调2.0、3.0、3.8 和4 倍。见图3。

图3 Real-time PCR检测心肌细胞中ANP、BNP、β-myosin及α-actin基因的表达
3 讨论
miR-1和miR-133广泛参与心脏发育、心肌肥厚和心律失常等心脏生理和病理生理过程。Zhao等[5]报道,在小鼠心脏发育过程中,miR-1能抑制一类碱性螺旋—环—螺旋类转录因子Hand2的表达,促进心脏组织分化。Chen等[6]研究小鼠C2C12成肌细胞分化模型发现,miR-1能抑制组蛋白去乙酞化酶4表达,促进MEF2的成肌作用;miR-133则通过抑制miR-1和miR-133同转录因子SRF的基因表达,反馈性调节miR-1的促肌细胞分化效应。在一些心血管疾病中,许多miRNA表达发生显著变化,并参与疾病的病理生理过程。van Rooij等[7]在大鼠胸主动脉狭窄心肌肥厚模型发现一系列表达上调的miRNA,通过转基因方法过表达miR-195,足以引起心肌肥厚和心力衰竭发生。Carè等[8]研究发现,敲除或下调miR-133后,能显著引起心脏肥厚;进一步研究发现,miR-133通过下调GDP-GTP、交换蛋白RhA、细胞分化周期蛋白42等靶基因的表达而抑制心肌的生长和肥大。
miRNA在调控心脏基因的表达过程中发挥重要作用。本研究通过构建心肌肥厚模型,用芯片和Real-time PCR法检测miRNA在正常与肥厚的心肌组织间的表达差异,结果显示,在心肌肥厚组织中特异性表达 miRNA,即 miR-350。H9c2细胞模型证实,miR-350能引起H9c2细胞肥大,伴随心肌肥厚标志性基因上调。我们发现,在心肌肥厚心尖部与正常心肌组织心尖部间存在146个差异表达的miRNA,其中2个在心肌肥厚中表达上调1.5倍以上,144个在心肌肥厚中表达下调1.5倍以上。相对于正常的心肌组织心尖部,心肌肥厚组织中miR-350上调最明显,达6倍以上。miRNA芯片技术是一种高通量、高灵敏度的检测方法,但需用其他方法对其结果进行验证。通过Real-timePCR得到的结果与芯片结果完全一致,提示miRNA家族的表达变化可能与心肌肥厚的发生有一定联系。miR-350能否作为一个疾病发生的诊断标志有待进一步证实。进一步研究miR-350在细胞水平上的作用,以H9c2细胞为模型,构建miR-350质粒,将其转染至H9c2细胞中,通过相差显微镜和荧光显微镜发现,转染后的质粒能在H9c2细胞中表达。其次,细胞转染72 h后,H9c2细胞开始变化,细胞生长缓慢,变大,并伴随部分细胞死亡,而对照组和其他质粒转染组则无此现象。用Real-time PCR法检测心肌肥大的标志性基因发现,与对照组和其他转染质粒组相比,AngⅡ诱导的H9c2细胞,其心肌肥大的标志性表达明显增多,并用Image J软件分析得到H9c2细胞的相关数据,这些实验都表明,miR-350可引起心肌细胞肥大。
心肌肥厚是心血管疾病中预后不良的疾病,能并发各种引起生命危险的疾病,如心力衰竭等。miRNA作为诱导心肌肥厚的参与者,有望成为疾病药物治疗的新靶标。
[1]Da Costa Martins PA,De Windt LJ.MicroRNAs in control of cardiac hypertrophy[J].Cardiovasc Res,2012,93(4):563-572.
[2]Thum T,Catalucci D,Bauersachs J.MicroRNAs:novel regulators in cardiac development and disease[J].Cardiovasc Res,2008,79(4):562-574.
[3]Mann DL.MicroRNAs and the failing heart[J].N Engl J Med,2007,356(25):2644-2645.
[4]Thum T,Galuppo P,Wolf C,et al.MicroRNAs in the human heart:a clue to fetal gene reprogramming in heart failure[J].Circulation,2007,116(3):258-267.
[5]Zhao Y,Samal E,Srivastava D.Serum response factor regulates a muscle-specific microRNA that targets Hand2 during cardiogenesis[J].Nature,2005,436(7048):214-220.
[6]Chen JF,Mandel EM,Thomson JM,et al.The role of microRNA-1 and microRNA-133 in skeletal muscle proliferation and differentiation[J].Nature genetics,2006,38(2):228-233.
[7]van Rooij E,Sutherland LB,Liu N,et al.A signature pattern of stress-responsive microRNAs that can evoke cardiac hypertrophy and heart failure[J].Proc Natl Acad Sci USA,2006,103(48):18255-18260.
[8]Carè A,Catalucci D,Felicetti F,et al.MicroRNA-133 controls cardiac hypertrophy[J].Nat Med,2007,13(5):613-618.
