IRX2基因在原发性肝癌中表达的初步研究
2013-08-28余爽王静董冰鲍依稀
余爽,王静,董冰,鲍依稀
原发性肝癌(hepatocellular carcinoma,HCC)作为常见的恶性肿瘤,占肿瘤病死率的第三位,其发病率在东南亚和非洲最高,在中国每年约有23万人死于肝癌,占世界肝癌死亡人数的53%[1-3]。肝癌的发病机制仍不十分明确,其中涉及多个基因突变及表达异常[4-5]。
易洛魁族同源盒(iroquois homeobox,IRX)基因最早在果蝇的神经系统发育研究中被发现,编码一个含高度保守同源盒序列的三氨基酸环延伸(three amino acid extension,TALE)超家族蛋白[6-7]。易洛魁家族有6个成员,IRX1-IRX6,它们又分两簇,其中IRX1﹑IRX2与IRX4基因定位于5号染色体短臂5p15.33 位点或附近[8],而IRX3﹑IRX5 和IRX6 基因定位于16 号染色体长臂16q11.2-q13区域[9]。有研究显示,IRX1基因参与了胃癌的发生发展,可抑制胃癌细胞的增殖及侵袭[10]。Asaka等[11]报道IRX3基因在生存期较短的乳腺癌患者中的表达下降。IRX3在对雄激素不敏感的前列腺癌细胞株中的表达也下调[12]。Lewis等[13]研究显示IRX2基因与乳腺癌上皮细胞生长和导管增殖有关。Rauch等[14]研究发现在肺鳞癌中12个CpG岛中有85%以上发生甲基化,与其相关基因包括EVX2﹑IRX2等。IRX2基因作为易洛魁基因家族成员,属同源盒基因,具有转录因子活性[15]。最近对这一基因家族功能的研究日渐增多,而国内外尚无 IRX2在肝癌中表达情况的报道。本研究通过检测IRX2在肝癌组织与癌旁对照组织中的表达水平差异,探讨IRX2在肝癌发生发展过程中所起的作用。
1 材料与方法
1.1 标本来源 收集2010年12月-2011年12月重庆医科大学附属第一医院及第二医院手术切除肝癌组织标本共51例。所有患者术前均未接受化疗和放射治疗。20例肝癌组织及癌旁组织标本于手术后立即取材(离体20min内)放入液氮,随后转入–80℃低温冰箱保存以备RNA及蛋白抽提。另外31例肝癌组织及相应癌旁组织20例(11例缺乏相应的癌旁组织)行常规4%甲醛溶液固定,石蜡包埋,苏木精-伊红染色以备病理组织学分期。病理分期采用Edmondson-Steiner模式,详细临床特征如表1所示。

表1 51例肝癌组织标本来源患者的临床特征Tab. 1 Clinical characteristics of 51 patients with hepatocellular carcinoma
1.2 主要仪器试剂及检测技术 定量PCR仪﹑Trans-blot 半干转电泳槽﹑凝胶图像分析系统(美国Bio-Rad)。RNAiso Plus试剂﹑反转录试剂(日本TaKaRa),Eva@green荧光染料(美国Bio-Rad),PIRA裂解液(北京百泰克生物),SDS-PAGE凝胶配制试剂盒﹑化学发光试剂(ECL),DAB 显色剂二抗(碧云天生物技术研究所),β-actin(北京中山金桥),IRX2抗体(Novus)。
1.2.1 实时荧光定量PCR(qRT-PCR) 取约80mg标本,液氮研磨后加入 1ml RNAiso plus试剂,常规步骤提取RNA,反转录后,将取得的cDNA于–20℃保存。以cDNA为模板,引物序列如下。IRX2-F:TCGTCTACGGATCACTCG,IRX2-R:CCTCCAGGTCGTCATTGTC。内参照β-actin-F:CCACTGGCATCGTGATGG,β-actin-R:GCGGATGTCCACGTCACACT。使用Bio-Rad公司Eva@green荧光染料试剂进行qRT-PCR相关操作,总反应体系10μl。扩增条件:95℃ 3min;95℃ 10s,55℃ 15s,72℃ 25s,共 39个循环;72℃7min,4℃暂停,目的基因与内参照基因同时检测,每个样本设置3个重复孔,比较各组间的差异。
1.2.2 Western blotting检测 收集组织标本,与行qRT-PCR检测的组织样本相同。经RIPA裂解,4℃,13 000r/min离心15min。取上清。测蛋白质浓度,行SDS-PAGE电泳,转膜,5%脱脂奶粉室温封闭1h。一抗孵育(兔抗人IRX2多克隆抗体,Novus公司,1:500;鼠抗人β-actin多克隆抗体,北京中山金桥公司,1:1000),4℃过夜,充分洗涤后加入HRP标记的二抗,室温孵育1h,充分洗涤后ECL显色。记录结果。
1.2.3 免疫组织化学检测 采用链菌素亲生物素-过氧化酶连接法(SP)行免疫组化检测,按说明书操作,DAB显色后观察结果。高倍镜下观察结果,根据染色阳性肿瘤细胞胞核数目所占百分比计分,阴性为0分,阳性细胞占1%~33%计1分,34%~66%计2分,占67%以上计3分;染色强度按肿瘤细胞胞核着色的深浅计分:无着色为0分,黄色计1分,浅棕色计2分,棕褐色计3分。最后计算两项之和:0分为(–),2~3分为(+/–),4~5分为(),6~7分为()其中()和()为阳性。
1.3 检测标本及指标
1.3.1 肝癌及癌旁组织检测 以20例肝癌组织与20例癌旁组织作为研究对象,采用qRT-PCR法检测IRX2 mRNA的表达,采用Western blotting法检测IRX2蛋白的表达。以所有31例肝癌组织及20例癌旁对照组织(其中11例缺乏相应的癌旁组织)作为对象,采用免疫组化法观察IRX2蛋白的表达情况。
1.3.2 肝癌组织检测 取31例肝癌组织作为研究对象,采用免疫组化法检测IRX2蛋白的表达情况;同时将此批肝癌组织按照病理分期分为高分化组(n=12)﹑中分化组(n=10)和低分化组(n=9),分析3组癌组织IRX2蛋白的表达差异。
1.4 统计学处理 采用统计软件SPSS 17.0进行分析。分析IRX2 mRNA和蛋白的半定量结果为计量资料,由于不符合正态分布,采用秩和检验进行分析;分析IRX2蛋白在肝癌组织和癌旁组织以及不同分化程度肝癌组织中相对表达量的差异时,计数资料表示为患者例数,采用Kruskal-Wallis H检验进行分析,多重比较采用K Independent Samples Test进行。P<0.05示差异有统计学意义。
2 结 果
2.1 肝癌及癌旁组织检测
2.1.1 IRX2 mRNA的表达 对20例肝癌组织与20例癌旁组织中IRX2基因表达量(以2–ΔΔCt表示)进行分析,结果显示80%(16/20)的肝癌组织中IRX2基因表达量低于癌旁对照组,秩和检验显示差异有统计学意义(P=0.04)。
2.1.2 IRX2蛋白的表达
2.1.2.1 Western blotting检测 该检测结果与qRTPCR所得结果一致,肝癌组织(n=20)中IRX2蛋白表达的半定量结果低于癌旁对照组(n=20),相对表达量的值分别为0.866和1.803。经秩和检验证实差异有统计学意义(P=0.009,图1)。
2.1.2.2 免疫组化 IRX2蛋白阳性染色位于细胞核。在51例肝脏组织中,IRX2蛋白均呈阳性表达(表2),在31例肝癌组织和20例癌旁组织中,IRX2蛋白阳性表达的组织分别为13例和20例,肝癌组织中IRX2蛋白的阳性率低于癌旁对照组织,差异有统计学意义(P=0.000,秩和检验)。
2.2 肝癌组织 对31例不同分化程度的肝癌组织分析发现,IRX2蛋白阳性染色表达在细胞核上,主要表现为粗糙深染的褐色颗粒。IRX2蛋白的表达量与肿瘤的分化程度相关,随着肝癌组织分化程度的降低,阳性表达也随之降低(图2)。
在31例肝癌组织中,12例高分化肝癌组织﹑10例中分化肝癌组织以及9例低分化肝癌组织的IRX2蛋白表达情况见表3,秩和检验显示差异有统计学意义(P=0.001);进一步两两对比发现,高分化与低分化肝癌组织﹑中分化与低分化肝癌组织IRX2蛋白的表达差异有统计学意义(P<0.05),而中分化与高分化肝癌组织IRX2蛋白表达差异无统计学意义(P>0.05)。

图1 Western blotting检测肝癌组织和癌旁组织IRX2蛋白的表达Fig. 1 Expression of IRX2 protein in hepatocellular carcinoma tissue and paired normal tissue (Western blotting)

表2 IRX2 蛋白的表达情况[例(%)]Tab. 2 Expression of IRX2 protein [case(%)]
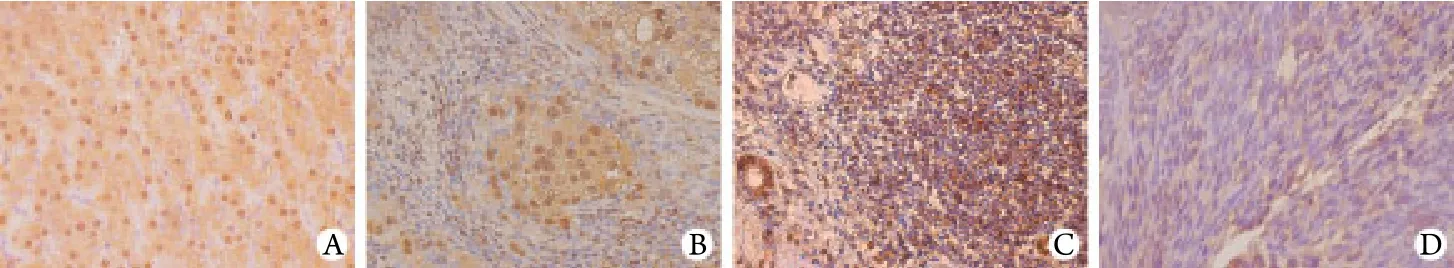
图2 IRX2蛋白的表达(SP ×400)Fig. 2 Expression of IRX2 protein (SP×400)
3 讨 论
IRX2基因是易洛魁基因家族中的成员,定位于5号染色体短臂5p15.33位点或附近[9]。文献报道该区域存在IRX1﹑IRX2和EEl等3个候选基因。IRX1和IRX2属于易洛魁基因家族成员,作为同源盒基因,与胚胎的前肠发育相关,具有转录因子活性[15]。癌变的细胞中同源盒基因功能可能丢失或活化;而同源盒基因IRX2与肝肿瘤发生的关系尚未见报道。本研究中,由于有11例肝癌组织未取到相应合格的癌旁组织标本,在检测IRX2的表达差异中,仅20例的肝癌组织与其癌旁组织相对应。qRT-PCR结果证实,HCC组中IRX2 mRNA的表达低于癌旁对照组织中的表达。为进一步了解IRX2蛋白在HCC组和癌旁对照组的表达差异以及IRX2蛋白表达与HCC分化程度的关系,本研究采用Western blotting及免疫组化技术进行分析,结果显示IRX2蛋白主要位于细胞核,IRX2蛋白在HCC组中的表达低于癌旁对照组织。在分化程度越低,恶性程度越高的肝癌组织中,IRX2蛋白的表达量越低。

表3 IRX2蛋白在不同分化程度肝癌组织中的差异表达[例(%)]Tab. 3 Differentiated expression of IRX2 in hepatocellular carcinoma tissue at different histopathologic stages [case(%)]
有研究发现,许多抑癌基因启动子区的CpG岛甲基化后造成相应基因转录障碍,导致细胞恶化[16-17]。DNA甲基化异常在肿瘤的发生发展中发挥着重要作用,可导致一种或多种抑癌基因沉默。随着对易洛魁基因家族研究的深入,Rauch等[14]研究发现在肺鳞癌中,12个CpG岛中有85%~100%发生甲基化,其中牵涉BARHL2﹑IRX2等基因。Kamalakaran等[18]在研究乳腺癌时发现CpG岛在管状A型乳癌的HOXA族和同源盒基因(IRX2﹑DLX2﹑NKX2-2)甲基化的发生明显增加。
启动子调控mRNA转录数量并决定转录的组织特异性。有研究显示,根据启动子结构特征将基因分为甲基化易感基因与甲基化抵抗基因,其中不断进行转录的基因能间接防止CpG岛的甲基化(如管家基因﹑MYC﹑FOS和CDK6等),而呈限制性表达的基因容易发生甲基化(多为组织特异性基因,如同源盒类基因CDX2和IPF1等)。目前,去甲基化治疗已成为肿瘤研究中的又一新领域。本课题组研究结果显示IRX2在原发性肝癌组织中异常表达,提示IRX2可能与肝脏肿瘤的发生发展有关,但是否与甲基化相关以及其具体机制并不完全清楚,本课题组将进行进一步的研究。
[1] Zheng L, Liang P, Li J, et al. Expression of BC047440 protein in hepatocellular carcinoma and its relationship to prognosis[J].Chin J Cancer, 2010, 29(11): 931-936.
[2] Xu XB, Zhang XH, Yang MF, et al. Expression of PTPeta in human hepatocellular carcinoma tissue and SMMC7721 cells and its significance[J].Med J Chin PLA, 2012, 37(10): 970-973. [许小兵, 张晓华, 杨妙芳, 等. 肝细胞肝癌组织及细胞株中PTPeta的表达及意义研究[J]. 解放军医学杂志, 2012,37(10): 970-973.]
[3] Wang R, Zhang M. Clinic significance of serum inflammatory factor detection in hepatitis B,hepatic cirrhosis and hepatic carcinoma[J]. Chin J Pract Intern Med, 2011, 31(6): 452-454.[王茸, 张淼. 乙型肝炎 肝硬化及肝癌血清中炎性因子检测的临床意义[J]. 中国实用内科杂志, 2011, 31(6): 452-454. ]
[4] Aravalli RN, Steer CJ, Cressman EN. Molecular mechanisms of hepatocellular carcinoma[J]. Hepatology, 2008, 48(6): 2047-2063.
[5] Marra M, Sordelli IM, Lombardi A, et al. Molecular targets and oxidative stress biomarkers in hepatocellular carcinoma: an overview[J]. J Transl Med, 2011, 10(9): 171.
[6] Dambly-Chaudière C, Leyns L. The determination of sense organs in Drosophila: a search for interacting genes[J]. Int J Dev Biol, 1992, 36(1): 85-91.
[7] Bürglin TR. Analysis of TALE superclass homeobox genes(MEIS, PBC, KNOX, Iroquois, TGIF) reveals a novel domain conserved between plants and animals[J]. Nucleic Acids Res,1997, 25(21): 4173-4180.
[8] Schmutz J, Martin J, Terry A, et al. The DNA sequence and comparative analysis of human chromosome 5[J]. Nature, 2004,431(7006): 268-274.
[9] Martin J, Han C, Gordon LA, et al. The sequence and analysis of duplication-rich human chromosome 16[J]. Nature, 2004,432(7020): 988-994.
[10] Guo X, Liu W, Pan Y, et al. Homeobox gene IRX1 is a tumor suppressor gene in gastric carcinoma[J]. Oncogene, 2010,29(27): 3908-3920.
[11] Asaka S, Fujimoto T, Akaishi J, et al. Genetic prognostic index influences patient outcome for node-positive breast cancer[J].Surg Today, 2006, 36(9): 793-801.
[12] Zhao H, Kim Y, Wang P, et al. Genome-wide characterization of gene expression variations and DNA copy number changes in prostate cancer cell lines[J]. Prostate, 2005, 63(2): 187-197.
[13] Lewis MT, Ross S, Strickland PA, et al. Regulated expression patterns of IRX-2, an Iroquois-class homeobox gene, in the human breast[J]. Cell Tissue Res, 1999, 296(3): 549-554.
[14] Rauch TA, Wang Z, Wu X, et al. DNA methylation biomarkers for lung cancer[J]. Tumour Biol, 2012, 33(2): 287-296.
[15] Becket Mb, Zulch A, Bos se A, et al. Irxl and Irx2 expression in early lung development[J]. Mech Devel, 2001, 106(1-2): 155-158.
[16] Yu Y, Chen LJ, Wang W. DNA methylation and tumor[J].Acta Acad Med CPAF, 2008, 17(4): 17-14. [俞媛, 陈立军, 王伟. DNA甲基化与肿瘤的关系[J]. 武警医学院学报, 2008,17(4): 17-14.]
[17] Cao J, Gao J, Du YQ. Aberrant methylation of NPTX2 in pancreatic carcinoma cell lines[J]. Med J Chin PLA, 2009,34(1): 18-20. [曹佳, 高军, 杜奕奇. 胰腺癌细胞株中NPTX2基因的甲基化情况研究[J]. 解放军医学杂志, 2009, 34(1):18-20.]
[18] Kamalakaran S, Varadan V, Giercksky Russnes HE, et al. DNA methylation patterns in luminal breast cancers differ from nonluminal subtypes and can identify relapse risk independent of other clinical variables[J]. Mol Oncol, 2011, 5(1): 77-92.
