微生物絮凝剂MBFGA1的结构鉴定及絮凝机理研究
2013-08-03张媛媛杨朝晖曾光明汪理科魏淑梅湖南大学环境科学与工程学院湖南长沙410082湖南大学环境生物与控制教育部重点实验室湖南长沙410082
张媛媛,杨朝晖*,曾光明,汪理科,黄 兢,魏淑梅,冯 婧 (1.湖南大学环境科学与工程学院,湖南 长沙 410082;2.湖南大学环境生物与控制教育部重点实验室,湖南 长沙 410082)
絮凝法广泛应用于水处理领域,絮凝剂的研究开发对于水处理具有重要意义.其中,微生物絮凝剂(MBF)具有易降解、无二次污染、高效安全、适应范围广等优点[1-2],越来越受国内外研究者的重视[3-7].对微生物絮凝剂分子结构进行鉴定可以为优化絮凝条件、探讨絮凝机理及实现工业化生产提供理论基础[8-9],是微生物絮凝剂研究的一个重要方面.目前,在微生物絮凝剂分子结构的研究中,多数直接将微生物发酵液提取物默认为微生物絮凝剂的活性成分而作为分子结构研究的对象,而少有对发酵液剩余物质絮凝活性进行分析的报道[10-11].为了更准确地确定微生物絮凝剂分子结构鉴定的对象及分析其絮凝机理,作者对一株产絮凝剂的多粘类芽孢杆菌(菌株编号GA1)的发酵液、发酵液提取粗产品、发酵液提取剩余物以及粗产品纯化后的精产品的絮凝活性进行分析,在确定该絮凝剂核心有效成分的基础上,对其进行分子结构鉴定及絮凝机理分析.
MBFGA1是菌株GA1所产的高效微生物絮凝剂,前期研究已证明该絮凝剂对多种废水均有较好的絮凝效果[12],具备工业化生产的潜力[13],有较好的实际应用前景.本研究着力于MBFGA1的性质及分子结构鉴定,以期为MBFGA1的推广应用提供理论基础.
1 材料与方法
1.1 实验菌种
所用菌种菌株编号GA1,经16S rDNA序列(GenBank序列登陆号DQ166375)分析鉴定为多粘类芽孢杆菌,命名为 Paenibacillus polymyxa GA1[14].
1.2 絮凝剂提取与纯化[15]
将GA1发酵液4000r/min离心30min,加入2倍体积预冷丙酮(-24℃),于 4℃冰箱中静置待析出物稳定,离心分离后干燥,得到 MBFGA1粗产品,呈淡黄褐色,与发酵液颜色相似;将粗产品溶于水,加入Sevage试剂(氯仿与正丁醇按5:1配制)充分振荡,离心后取上清液,浓缩后进行冷冻干燥得 MBFGA1精产品,呈浅黄色;粗提后的发酵液经旋转蒸发除去丙酮,得到粗提剩余物.
1.3 絮凝剂有效成分鉴定
以对高岭土的絮凝率为指标检验发酵液、粗提剩余物、10g/L粗产品溶液以及10g/L精产品溶液的絮凝活性.测定方法:取50mL 3g/L的高岭土溶液,调节pH至8,加入2mL 10g/L的CaCl2溶液作为助凝剂,摇匀 3s,加入 0.4mL絮凝剂(对照试验为等量蒸馏水),迅速摇匀持续 15s,静置30min测定上清液D550.絮凝率计算公式[16]:

式中:FR为絮凝率;a为样品实验中上清液的D550;b为对照实验中上清液的D550.
1.4 MBFGA1性质成分鉴定[17]
使用紫外可见分光光度计和傅里叶变换红外光谱分析仪(varian,USA)对 MBFGA1精产品基本性质、特征键及分子结构进行分析鉴定;采用苯酚-硫酸法对糖含量进行测定;采用考马斯亮蓝法对蛋白质含量进行测定;使用zeta电位仪(malvern,British)对溶液zeta电位进行测定.
1.5 MBFGA1凝胶过滤层析[18]
经两次凝胶层析对MBFGA1精产品进行分离纯化.一次层析:层析柱规格 40cm×2.5cm,层析介质 Sephadex G-50(Pharmacia,USA),洗脱液0.9%的 NaCl溶液,洗脱速度 0.6mL/min;二次层析:层析柱规格100cm×1.6cm,层析介质Sephadex G-100 (Pharmacia,USA),同样条件对一次层析后的样品进行分离.洗脱样品的收集使用部分收集器,接样时间 10min/管,测定收集样品的糖含量(以 D485为表征),以管数为 x轴,D485为 y轴绘制层析出峰图,收集糖峰透析,干燥后做下一步处理.
1.6 表面形态分析
使用环境扫描电镜(FEI,Netherland)分别对MBFGA1粗产品、精产品以及层析后产品的表面形态进行分析.
1.7 分子量测定
采用高效液相色谱法对MBFGA1精产品各组分进行分子量测定:使用高效液相色谱仪(Agilent,USA)对样品进行分析,Ultrahydrogel 2000和 500两根多糖专用凝胶色谱柱串联(300mm×7.8mm,排阻限分别为 7×106D 和 4×105D),以0.1mol/L的NaNO3溶液为流动相,示差折光检测器(RID)检测.分子量标准物质为pullulan多糖.
1.8 单糖组成分析
采用气相色谱法对MBFGA1精产品各组分进行单糖组成分析:先对多糖样品进行糖基衍生化,之后使用气相色谱仪(岛津,日本)对衍生化样品进行分析,5%OV-225/AW-DMCS-Chromo-sorb W玻璃填充柱(3mm×2.5m),柱温210℃,氢焰离子法(FID)检测.
2 结果和讨论
2.1 絮凝剂活性成分鉴定
从溶液表观看,发酵液、粗提剩余物、MBFGA1粗产品溶液及MBFGA1精产品溶液透光率依次增大,挂壁现象逐渐减弱,黏度降低[19],其中精产品溶液为澄清溶液.各溶液对高岭土溶液的絮凝率见表1.

表1 各溶液对高岭土溶液絮凝率的对比Table 1 Comparison of kaolin flocculating rate
由表1可知,除粗提剩余物外,另外3种溶液对高岭土均有较高的絮凝率,说明发酵液的丙酮粗提物是MBFGA1的有效成分;在提取物中,精产品溶液为成分更单一的澄清溶液,而与粗产品溶液相比絮凝率降低不大,说明精产品为 MBFGA1的核心有效成分.本研究中以 MBFGA1精产品为微生物絮凝剂的结构鉴定的主要对象.
对比发酵液、粗产品溶液和精产品溶液絮凝率可得,随着絮凝剂纯化的推进絮凝效果呈下降趋势,其中发酵液絮凝活性最大,精产品溶液絮凝活性最低.推测原因:发酵液是微生物代谢过程形成的混合物胶体,不仅含有培养基中残留的物质,也有生物代谢中产生的如磷酸盐[20]等有助于絮凝的物质;而提取物溶液组成相对单一,所以絮凝效果低于发酵液.据此同时可得MBFGA1投入实际应用时,直接使用发酵液即可达到高絮凝效果、低成本的目的.
2.2 性质成分鉴定
MBFGA1精产品的全波长扫描结果为一条平滑曲线,260nm和 280nm附近均没有吸收峰,说明精产品中不含核酸和蛋白质.同时,实验测定其中糖含量达 99%以上,可得絮凝剂MBFGA1精产品为多糖类物质.此外,精产品溶液zeta电位为-25.9,说明絮凝剂表面带负电荷,原因可能是分子表面带有较多的负电基团,负电基团之间相互作用使得絮凝剂在水中处于一个较稳定的状态.
2.3 表面形态及元素组成分析
MBFGA1电镜扫描照片如图1所示.由图1可见,MBFGA1呈现疏松、交联的网状多孔结构.从a到c随着纯化的推进,样品表面愈加细腻,脉络更加清晰,孔与孔连接益加紧密,孔隙密度越来越大,链与链的交联愈加明显,说明 MBFGA1为线性长链分子结构,且带有支链,长链之间交联成网络,最终形成图中所示构型.同时,干燥的MBFGA1具有极强的韧性,不易研磨为粉末,也证实了其线性长链分子结构.

图1 不同处理阶段下的MBFGA1的扫描电镜照片(×1000)Fig.1 Scan electron microanalysis of MBFGA1(×1000)
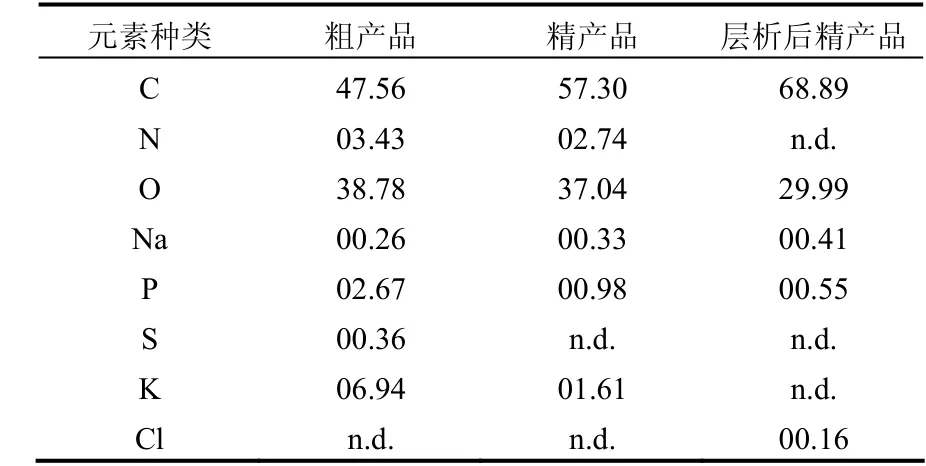
表2 MBFGA1的元素分析 (%)Table 2 Elementary analysis of MBFGA1 (%)
对MBFGA1粗产品、精产品以及层析后的精产品进行能谱扫描以对其元素组成进行分析,分析结果见表 2.随着纯化的推进,样品中 N、S含量明显降低,可认为精产品中所含杂质,或者部分支链上的小分子物质与主链分离而被去除;此外,层析后精产品中所含元素(除H外)主要有C、O、Na、P、Cl,其中 Na、Cl增加是由于洗脱液残留,故其中主要含有 C、H、O,也可佐证MBFGA1絮凝剂主链成分为多糖.
2.4 凝胶过滤层析
MBFGA1的凝胶过滤层析结果见图 2.从一次层析图可看出:一次层析样品洗脱液中的糖含量只形成 1个主峰,即在一次层析的层析条件下絮凝剂显示为单一组分物质.根据凝胶过滤层析原理,收集此峰做下一步处理即可排除层析中杂峰(即杂质)对主峰的干扰,使样品得到纯化.
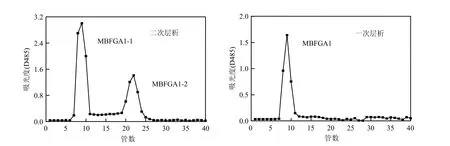
图2 MBFGA1的凝胶过滤层析Fig.2 Gel chromatography filter graph of MBFGA1
二次层析图显示,MBFGA1在二次层析中形成了2个主峰,说明絮凝剂中包含2种分子量不同的组分;分别收集两组分,经低温(<40℃)旋转蒸发浓缩、透析以及冷冻真空干燥,得到絮凝剂中的两组分,分别记为MBFGA1-1和MBFGA1-2.在MBFGA1精产品中二者含量比约为3:1.
2.5 分子量测定
MBFGA1的高效液相色谱(HPLC)如图3所示.其中,MBFGA1-1的HPLC图示差检测部分有3个峰,保留时间分别为27.136,36.469,46.915min,其中 46.915min为溶剂峰,27.136,36.469min为MBFGA1-1中的两组分,确定MBFGA1-1为非均一多糖,两峰面积对比可知后者仅在 MBFGA1-1中占极小一部分.利用GPC软件计算得两峰对应分子量分别为 1.18×106D 和 5.01×104D.由于5.01×104组分含量极低,可将MBFGA1-1分子量视为 1.18×106D.
MBFGA1-2的HPLC图示差检测部分有2个峰,保留时间分别为 26.724,27.576min,其中27.576min为溶剂峰,故MBFGA1-2为均一多糖.计算得 26.724min所对应组分的分子量为3.08×103D,即 MBFGA1-2 分子量为 3.08×103D.
2.6 单糖组分测定
MBFGA1的气相色谱(GC)如图4所示,由于各批实验条件不同,单糖标准品保留时间略有差别.单糖标准品GC出峰图中:0.8min是溶剂氯仿峰,从4.542min开始往后的6个峰分别为鼠李糖,阿拉伯 糖,木糖,甘露糖,半乳糖,葡萄糖,其余是杂质峰.
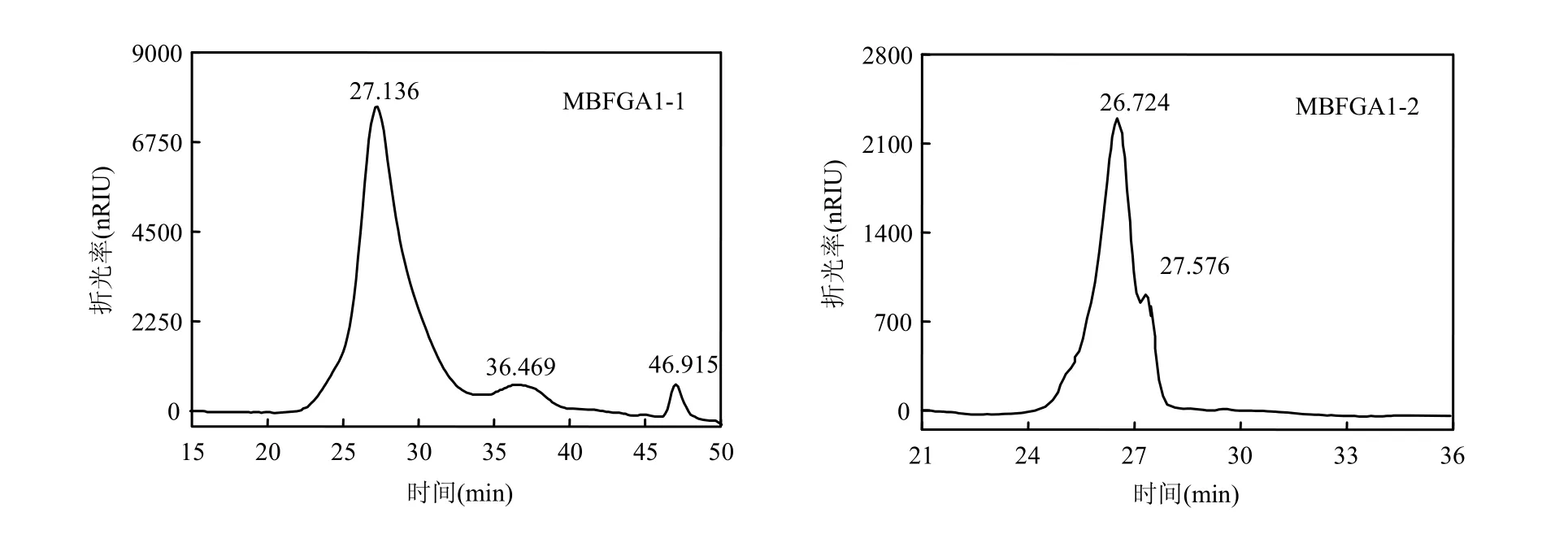
图3 MBFGA1-1和MBFGA1-2的HPLC图Fig.3 HPLC graphs of MBFGA1-1 and MBFGA1-2
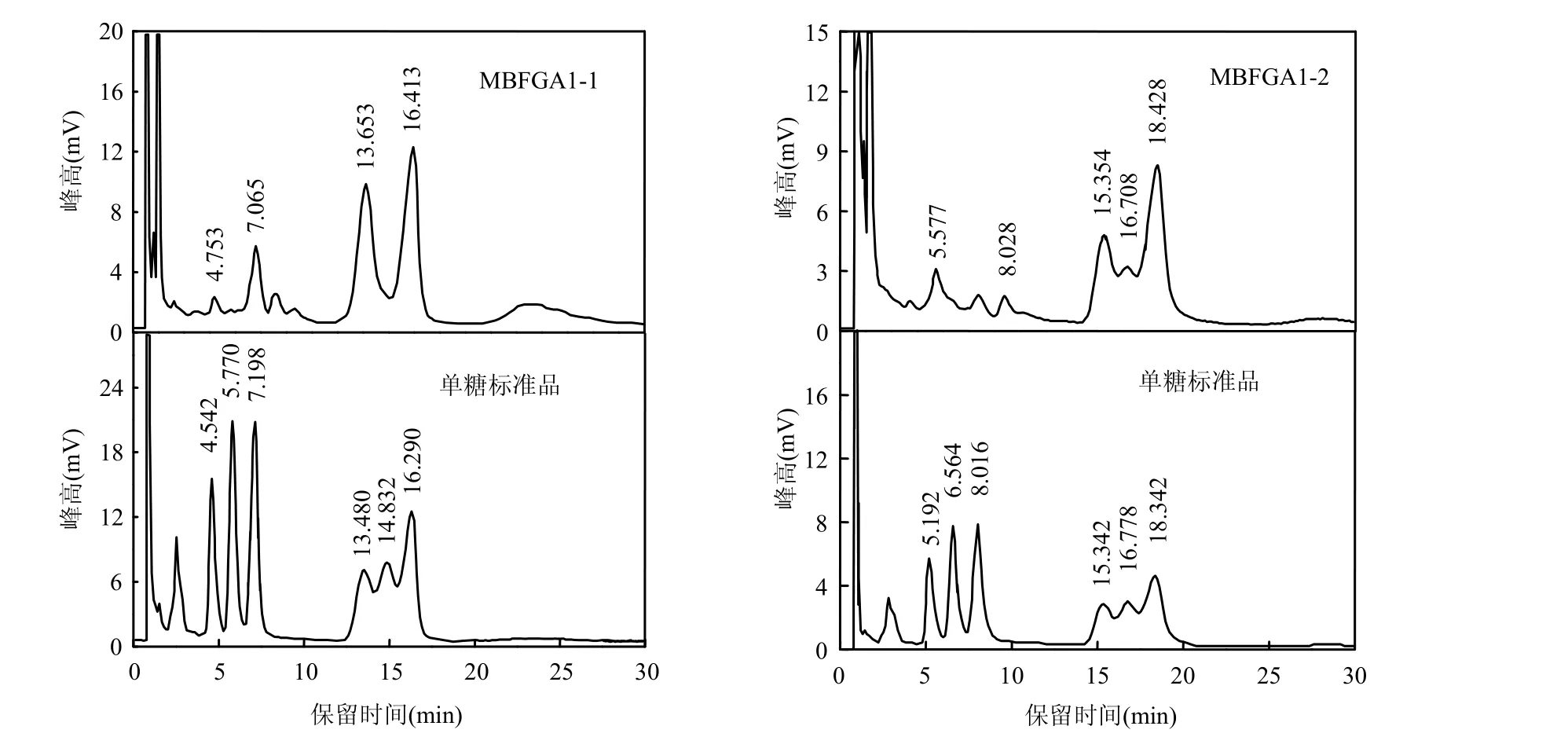
图4 MBFGA1-1和MBFGA1-2的GC图Fig.4 GC graphs of MBFGA1-1 and MBFGA1-2
其中,MBFGA1-1的GC图中共有4个糖基峰,4.753,7.065,13.653,16.413min依次为鼠李糖,木糖,甘露糖,葡萄糖,其余峰为杂质峰,即MBFGA1-1含有4种糖基.根据各单糖峰面积计算主要糖基物质的量比:其中木糖,甘露糖,葡萄糖三者的物质的量比为0.3:1:1.09,而鼠李糖含量太少未算入比例.
MBFGA1-2的 GC图中共有 5个糖基峰,5.577,8.028,15.354,16.708,18.428min依次为鼠李糖,木糖,甘露糖,半乳糖,葡萄糖,五者的物质的量比为0.68:0.28:1.82:1:3.73.
2.7 红外光谱分析
为确保絮凝剂在处理过程中不改变自身的基本结构,维持原有性质,对 MBFGA1及其所包含的两组分MBFGA1-1和MBFGA1-2均做了红外光谱分析,如图5所示.
由图 5可见,三者主要吸收峰的位置和强度均相近,可得三者分子内所含的特征键基本一致;此外 MBFGA1中还包含了 MBFGA1-1和MBFGA1-2中的特有峰,如 3911,483,984cm-1.推测MBFGA1-1和MBFGA1-2在生物体内的形成过程一致,或者二者原本就共属于同一多糖主链(即MBFGA1主链),由于之间连接的键较弱在处理过程中断开而显示为2种不同分子量的物质.

图5 MBFGA1、MBFGA1-1和MBFGA1-2红外光谱Fig.5 Fourier transform-infrared spectra of MBFGA1、MBFGA1-1 and MBFGA1-2
3440cm-1附近宽而强的吸收峰为形成氢键的多缔合—OH强吸收峰,为典型的O—H伸缩振动;3212,3117cm-1两个弱吸收峰(重叠为一宽峰)为残糖基上—CH3和—CH2的C—H的伸缩振动吸收峰;2050cm-1处亦为 C—H吸收峰;1640,1400cm-1分别为—COO—反对称和对称伸缩振动,可能为开链式糖基所含;1100cm-1处宽峰为吡喃环中醚键—C—O—C—(甲氧基)伸缩振动和弯曲振动叠加引起;850cm-1是 α-吡喃型糖苷键;620cm-1为=C—H吸收峰,即烯烃C—H键吸收峰.
MBFGA1及MBFGA1-1和MBFGA1-2分子中都含有 α-吡喃型糖苷键,说明分子基本骨架结构一致;羟基、羧基、甲氧基等极性基团大量存在,容易和颗粒表面的离子结合而形成吸附;此外,多缔合羟基之间形成氢键,使絮凝剂溶解度增大,分子链充分伸展,便于架桥形成,而发生絮凝.结合絮凝剂的zeta电位值,进一步证实了分子内极性基团的存在.
3 MBFGA1絮凝机理探讨
与其他多糖类絮凝剂相似,MBFGA1较大的分子量和分子内所含的羟基、羧基等极性基团是其具有较强絮凝性的主要原因.有研究证明,絮凝剂分子能在颗粒表面产生吸附是絮凝发生的首要条件[21].MBFGA1分子量达1.18×106D,具有足够的范德华力来克服颗粒间的静电斥力而形成吸附;此外,MBFGA1分子不同链节上的羧基、羟基,可以与颗粒表面带有的H+、OH-等以氢键形式发生吸附,羧基、甲氧基等极性基团易于与颗粒表面的 Ca2+或者其他重金属离子等以化学键结合,使溶液的 zeta电位降低,溶液脱稳,形成吸附;而颗粒与絮体间的静电力也能使之相互靠近,产生吸附作用[22].
此外,絮凝剂分子在水中的伸展状态直接影响絮凝剂架桥的发生,一般认为絮凝剂分子链充分伸展呈柔性线状时,有利于絮凝[21].MBFGA1是微生物分泌存在于发酵液中的天然多糖,糖环有多个羟基,溶于水形成氢键,保证了其较好的水溶性;同时糖环结构及其他基团的空间相互作用也使分子链不易弯曲.随着多糖分子量增加,糖环数的增多将导致溶解度降低,而分子中存在的羧基等极性基团又增加了水溶性,利于分子链在水中伸展,增加了分子链的有效长度,为胶体粒子的吸附提供足够的空间位点;未被吸附的链节则成为自由末端或疏松的链环而与其他分子相互架桥,形成絮体.MBFGA1絮凝机理如图6所示.

图6 MBFGA1絮凝机理示意Fig.6 Proposed flocculating mechanism for MBFGA1
4 结论
4.1 MBFGA1精产品为该微生物絮凝剂的核心有效成分,为多糖类物质,由环状单糖以α-型糖苷键结合成多糖主链,其他小分子物质与主链结合形成支链,共同构建为线性长链分子结构;分子内含有羟基,羧基,甲氧基等有利于絮凝的基团.
4.2 MBFGA1精产品中包含 MBFGA1-1和MBFGA1-2两种分子量不同的组分,三者分子基本结构相似,其中分子量较大的 MBFGA1-1占75%以上,MBFGA1-2仅占25%.
4.3 MBFGA1-1为非均一多糖,分子量分别为1.18×106D 和 5.01×104D(含量极低,忽略不计),主要糖基组成为木糖,甘露糖和葡萄糖(另含少量鼠李糖),物质的量比为 0.3:1:1.09,构成MBFGA1-1的基本骨架.
4.4 MBFGA1-2为均一多糖,分子量3.08×103D,糖基组成为鼠李糖,木糖,甘露糖,半乳糖,葡萄糖,五者的物质的量比为 0.68:0.28:1.82:1:3.73,构成MBFGA1-2的基本骨架.
4.5 MBFGA1絮凝机理主要为吸附架桥,絮凝剂分子主要靠范德华力、氢键和化学键吸附胶体颗粒;分子内所含的氢键和极性基团使MBFGA1分子能够充分伸展,有效发挥吸附架桥作用.
[1]Vijayaraghavan K, Yun Yeoung-Sang.Bacterial biosorbents and biosorption [J].Biotechnology Advances, 2008,26:266-291.
[2]Prado Héctor J, Matulewicz María C, Bonelli Pablo R, et al.Potential use of a novel modif i ed seaweed polysaccharide as fl occulating agent [J].Desalination, 2011,281:100-104.
[3]Badireddy Appala R, Chellam Shankararaman, Gassman Paul L,et al.Role of extracellular polymeric substances in biof l occulation of activated sludge microorganisms under glucose-controlled conditions [J].Water Research, 2010,44:4505-4516.
[4]Lee Andrew K, Lewis David M, Ashman Peter J.Microbial flocculation, a potentially low-cost harvesting technique for marine microalgae for the production of biodiesel [J].J.Appl.Phycol., 2009,21:559-567.
[5]Zhang Zhi-qiang, Xia Si-qing, Zhang Jiao.Enhanced dewatering of waste sludge with microbial fl occulant TJ-F1 as a novel conditioner [J].Water Research, 2010,44:3087-3092.
[6]郭俊元,杨春平,邱国良.生物絮凝剂与改性沸石复配处理猪场废水厌氧消化液的响应面优化 [J].中国环境科学, 2012,32(11):1999-2005.
[7]Sena Gautam, Ghosha Sandipta, Jha Usha, et al.Hydrolyzed polyacrylamide grafted carboxymethylstarch (Hyd.CMS-g-PAM):An eff i cient fl occulant for the treatment of textile industry waste water [J].Chemical Engineering Journal, 2011,171:495-501.
[8]Li Qiang, Liu Hong-lei, Qi Qing-sheng.Isolation and characterization of temperature and alkaline stable bioflocculant from Agrobacterium sp.M-503 [J].New Biotechnology, 2010,27:789-794.
[9]Ho Y C, Norli I, Alkarkhi Abbas F M, et al.Characterization of biopolymeric fl occulant(pectin) and organic synthetic fl occulant(PAM): A comparative study on treatment and optimization in kaolin suspension [J].Bioresource Technology, 2010,101:1166-1174.
[10]Wu Jane-Yii, Ye Hsiu-Feng.Characterization and fl occulating properties of an Extracellular biopolymer produced from a Bacillus subtilis DYU1 isolate [J].Process Biochemistry, 2007,42:1114-1123.
[11]黎 忠,张修玉,秦建桥,等.微生物絮凝剂ZS-7的纯化及其结构特征研究 [J].环境科学, 2010,31(9):2184-2190.
[12]阮 敏,杨朝晖,曾光明,等.多粘类芽孢杆菌GA1所产絮凝剂的絮凝性能研究及机理探讨 [J].环境科学, 2007,28(10):2336-2341.
[13]周长胜,杨朝晖,曾光明,等.絮凝剂产生菌GA1的营养优化及发酵动力学 [J].中国环境科学, 2008,28(4):324-328.
[14]杨朝晖,陶 然,曾光明,等.多粘类芽孢杆菌GA1产絮凝剂的培养基和分段培养工艺 [J].环境科学, 2006,27(7):1444-1449.
[15]郭振楚.糖类化学 [M].北京:化学工业出版社, 2005:40-72.
[16]Lee S H, Lee S O, Jang K L, et al.Microbial flocculant from Arcuadendron sp.TS-49 [J].Biotechnology Letters, 1995,17(1):95-100.
[17]荣国斌(译).波谱数据表—有机化合物的结构解析 [M].上海:华东理工大学出版社, 2002.
[18]张惟杰.糖复合物生化技术研究 [M].2版.杭州:浙江大学出版社, 1999.
[19]任 鲲,胡秋平,高金森,等.疏水缔合聚丙烯酰胺溶液挂壁与粘度的关系 [J].石油炼制与化工, 2005,36(11):59-62.
[20]熊丽娟,杨朝晖,曾光明,等.培养基中磷酸盐在GA1所产絮凝剂絮凝中的作用研究 [J].环境科学学报, 2007,27(7):1157-1162.
[21]郑怀礼.生物絮凝剂与絮凝技术 [M].北京:化学工业出版社,2004:34-75.
[22]Sharp Emma L, Jarvis Peter, Parsons Simon A, et al.The impact of zeta potential on the physical properties of ferric-NOM flocs[J].Environmental Science Technology, 2006,40(12):3934-3940.
