大剂量何首乌醇提物致大鼠多脏器损伤研究
2013-04-16李奇赵奎君赵艳玲王伽伯方芳吕旸马致洁蒋冰倩浦仕彪邹正升滕光菊宫嫚肖小河
李奇 赵奎君 赵艳玲 王伽伯 方芳 吕旸 马致洁 蒋冰倩 浦仕彪 邹正升 滕光菊 宫嫚 肖小河
何首乌始载于《开宝本草》,为蓼科植物何首乌PolygonummultiflorumThunb .的干燥块根。味苦、甘、涩,微温,归肝、心、肾经,具有解毒、消痈、截疟、润肠通便等功效;制何首乌为何首乌的炮制加工品,二者归经性味相同,具有补肝肾、益精血、乌须发、强筋骨、化浊降脂等功效[1]。何首乌与人参、灵芝、冬虫夏草历来并称为中国“四大仙草”,古今皆为医家、饮食家所推崇,成为滋补延年之佳品。临床中常用于治疗肝、肾精血亏虚所致的头昏目眩、须发早白、腰膝酸软及遗精等,近年来用于高血压、高血脂、冠心病、斑秃、脱发等证的治疗,疗效满意。但是近年来国内外关于何首乌肝毒性的报道屡见不鲜[2-9]:如英国、澳大利亚、荷兰、意大利、哥伦比亚、韩国和中国香港等相继出现何首乌肝损害的病例报道,症状分别表现为轻重度黄疸、急慢性肝炎、肝功能异常等,因而引发了国内外学者对何首乌用药安全性问题的高度关注[10]。
然而,有关何首乌毒性的实验研究结果各不相同且多有矛盾[11-20],何首乌肝毒性的客观真实性仍未阐明,难以正确评价何首乌临床用药的安全性。本文通过两部分实验评价何首乌生品和炮制品的不同提取物的毒性作用:首先是比较不同提取物,找到毒性较大的提取物;然后,针对毒性较大的提取物,以CCl4作为阳性对照,进一步评价何首乌对大鼠主要脏器的损伤情况,并考察其组织病理损伤与血生化指标的相关性。为了尽可能暴露出何首乌潜在的毒性,本文在较大剂量下考察了何首乌损伤肝脏等脏器的可能性。
1 材料与方法
1.1材料与仪器
生何首乌(批号:10050904)购于北京绿野药业有限公司,经解放军第三〇二医院肖小河研究员鉴定为蓼科植物何首乌(PolygonummultiflorumThunb.)的干燥块根。制何首乌(批号:10122402)由上述同一批生何首乌炮制而成,炮制方法参照《中华人民共和国药典(2010年版)》及《北京市中药材炮制规范》,由北京绿野药业有限公司协助完成。
SD大鼠,SPF级,体重160 g左右,雄性,共132只,购于军事医学科学院实验动物中心(合格证号SCXK-军2007-004)。动物饲养于屏障动物房,室温(20±2)℃,相对湿度60%~70%,通风良好、环境安静,室内保持12小时照明,12小时黑暗,并定期消毒。
2500型超声波清洗器(江苏省昆山市超声仪器有限公司),旋转蒸发仪(德国Heidolph公司),迈瑞BS-300全自动生化分析仪(上海富众生物科学有限公司)。
1.2药品制备
本实验醇提物所采取的提取方法为:将生何首乌和制何首乌分别粉碎得粗粉,加6倍量的75%乙醇冷浸提取,共提取5次,每次48小时,合并醇浸提取液,浓缩并减压干燥,制得干粉备用。水提物所采取的提取方法为:将生何首乌和制何首乌分别粉碎得粗粉,加10倍量的蒸馏水煎煮1.5小时,回流提取2次,合并提取液,浓缩并减压干燥,制得干粉备用。药材粉碎通过200目筛即得药材全粉。每次给药前按生药量配制药液,水浴加热至37 ℃时使用。
1.3何首乌不同提取物的毒性比较试验
将实验动物SD大鼠随机分为7组,生何首乌醇提物、制何首乌醇提物、生何首乌水提物、制何首乌水提物、生何首乌全粉、制何首乌全粉和正常对照组,每组12只,均为雄性。各给药组剂量均为20 g/kg。按4 ml/200 g体重灌胃给药,正常对照组给相同量蒸馏水,连续给药28小时。给药期间动物自由饮食。每日观察给药前后各组每只动物的外观体征,行为活动,毛发变化、大小便形状、颜色及有无异常分泌物等。每7天大鼠眼眶取血,分离血清,检测谷丙转氨酶(ALT)和谷草转氨酶 (AST)等生化指标的变化,动物股动脉取血后处死,进行全面系统尸检,对、肝、肺、肾、脾等脏器进行肉眼观察,记录有异常的脏器。
1.4何首乌醇浸提物的亚急性毒性试验
将实验动物SD大鼠随机分为4组,分别为正常对照组(Control),阳性对照组(CCl4),生何首乌组(Crude Polygonum multiflorum,CP)、制何首乌组 (Prepared Polynonum multiflorum, PP),每组12只,均为雄性。各给药组剂量均为40 g/kg。按4 ml/200 g体重灌胃给药, 对照组给相同量蒸馏水, 阳性对照组按1.25 ml/kg CCl4腹腔注射(每周3次),连续给药28天(4周)。给药期间动物自由饮食。每日观察给药前后各剂量组每只动物的外观体征,行为活动,毛发变化、大小便形状、颜色及有无异常分泌物等。分别在给药0、7、14、28天称动物体重,计算体重增长率。给药期间每7天大鼠眼眶取血,分离血清,全自动生化仪检测谷丙转氨酶(ALT)、谷草转氨酶(AST)、尿素(UREA)、谷氨酰基转移酶(γ-GT)、肌酐(CREA)、碱性磷酸酶(ALP)、总蛋白(TP)、白蛋白(ALB)、总胆红素(TBIL)、结合胆红素(DBIL)、磷酸肌酸激酶(CK)指标变化。动物股动脉取血后处死, 进行全面系统尸检,对肝、肺、肾、脾、性腺、甲状腺、胸腺、回肠等进行肉眼观察,记录有异常的脏器,称重并计算脏器系数。尸检后取肝、肾、肺组织进行组织病理检测。
1.5组织病理检测
用10%中性甲醛溶液固定,经梯度乙醇脱水、二甲苯透明、石蜡包埋、切片(厚4~5 μm)、HE染色。在光学显微镜下观察组织病理变化。
1.6统计学分析
2 结果
2.1何首乌不同提取物的毒性差异
初步实验结果表明:生何首乌和制何首乌的醇提物均可使大鼠行为活动减少,毛色发黄并出现便溏现象。尸检后肉眼观察:生何首乌醇提物组(6/12)、制何首乌醇提物组(4/12)均出现肝脏肿大、变色、纤维化等病变特征,但ALT和AST无显著性变化。生何首乌水提物组(3/12)和制何首乌水提物组(1/12)也出现行为活动减少、毛色发黄等现象,但是发现肝脏仅轻微肿大,无其他明显病变特征。生何首乌全粉组和制何首乌全粉组无明显异常现象。
2.2何首乌醇提物对大鼠的脏器毒性
2.2.1 对大鼠体重和脏器指数的影响 各给药组动物均出现活动减少、皮肤毛色变黄、便溏且呈灰白色等现象。根据图1可知:各给药组大鼠体重增长均受到不同程度的抑制作用,生何首乌组大鼠增长趋势明显缓慢(P>0.05)且受到抑制,但在实验第4周时显示出抑制作用减弱的态势,大鼠体重显著性增长(P<0.05);制何首乌和CCl4阳性药对大鼠体重增长也存在明显的抑制作用,但较生何首乌为轻。结果表明,何首乌可抑制大鼠体重增长,其中生何首乌比制何首乌严重。
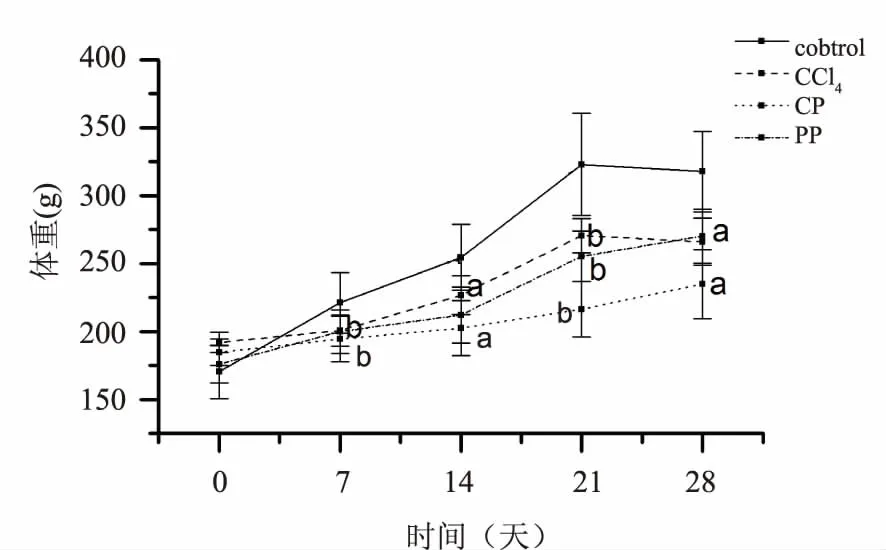
注:Control:正常对照组;CCl4:肝损伤阳性对照组;CP:生何首乌组;
PP:制何首乌组。与正常对照组相比,aP<0.05;bP<0.01
图1 各组大鼠的体重增长动态变化
脏器指数可一定程度反映实验大鼠与正常大鼠脏器之间的差异,对于脏器损害程度监测具有一定的指导意义。根据图2可知:生何首乌和CCl4阳性药可使大鼠肝脏和肾脏一定程度肿大,肝脏指数和肾脏指数显著高于对照组(P<0.01);而且生何首乌还可使大鼠肺脏一定程度肿大,肺脏指数显著高于对照组(P<0.01)。结果提示:生何首乌可导致大鼠肝脏、肾脏和肺脏肿大及病变。
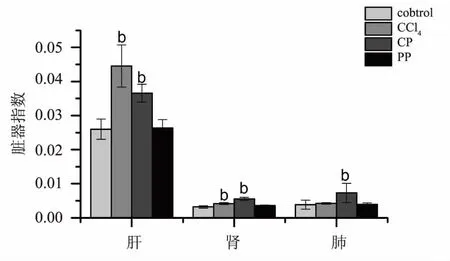
注:Control:正常对照组;CCl4:肝损伤阳性对照组;CP:生何首乌组;
2.2.2 对大鼠肝肾功能指标的影响 课题组对各项生化指标实行动态监测,结果发现:结合DBIL、ALB、CREA、ALP和CK这5项指标给药后7天、14天、21天均没有显著性变化,而在给药28天后发生显著性改变;ALT和AST这两项指标给药后7天、14天、21天、28天后均无显著性差异,但是于给药第3天后ALT和AST曾经出现一过性显著升高。根据图3可知,在整个实验周期中,生何首乌组大鼠的ALT和AST除第3天出现显著升高(P<0.05)之外,其他各检测时间点均无显著性差异,制何首乌组也无显著性改变。根据图4可知,生何首乌组大鼠的DBIL和ALP显著升高,CREA和ALB显著降低;制何首乌组大鼠ALB、CREA和CK显著降低。从具有显著性差异的生化指标来看,生何首乌比制何首乌差异程度大,可一定程度反映生何首乌的毒性作用大于制何首乌。
2.2.3 对大鼠肝组织的影响 生何首乌组有2例(2/12)死亡,1例(1/12)肝组织中度损伤,4例(4/12)肝组织轻度损伤;制何首乌组有1例(1/12)死亡,7例(7/12)肝组织轻度损伤。四氯化碳模型组有3例(3/12)死亡,2例(2/12)肝组织中度损伤,3例(3/12)肝组织轻度损伤;正常对照组无损伤及死亡现象。根据图5可以看出,与正常对照大鼠比较,生何首乌组大鼠肝脏组织可见灶性肝细胞坏死,肝细胞索排列紊乱,灶性肝细胞嗜酸性变,水肿颗粒样变性,及肝细胞胞浆中可见部分脂滴等病变现象。制何首乌组可见肝细胞浊肿,肝细胞索排列较紊乱,肝血窦较狭窄及局部肝细胞嗜酸性变等病变现象。CCl4阳性对照组可见肝小叶周围肝细胞广泛脂肪变性,肝细胞呈星点状肿大及胞浆透明且有大脂滴等病变特征。

注:Control:正常对照组;CCl4:肝损伤阳性对照组;CP:生何首乌组;
图3 各组大鼠的ALT和AST动态水平变化
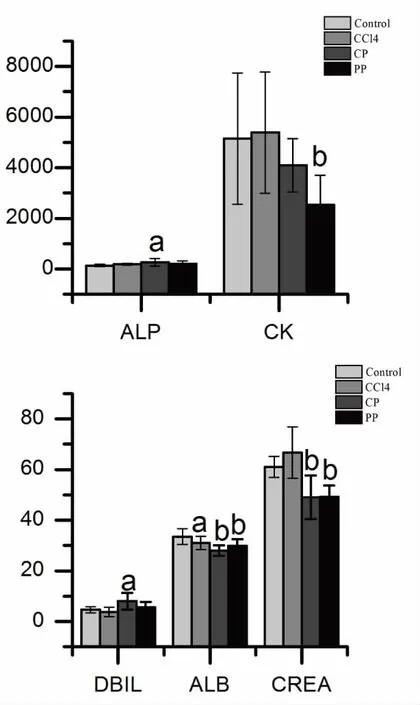
注:Control:正常对照组;CCl4:肝损伤阳性对照组;CP:生何首乌组;
2.2.4 对大鼠肾组织的影响 生何首乌组出现5例(5/12)肾组织轻度损伤;制何首乌出现1例(1/12)肾组织中度损伤,5例(5/12)肾组织轻度损伤。根据图6可以看出,与正常对照大鼠比较,生何首乌组大鼠可见肾小管上皮细胞水肿颗粒样变性,肾小球体积增大且毛细血管腔内红细胞淤积,包曼氏囊腔狭窄并伴系膜细胞及基质增生,伴有毛细血管腔开放欠佳等病变特征。制何首乌组可见肾小管上皮细胞轻度水肿颗粒样变性,肾小球体积增大且系膜区轻至中度增宽伴系膜细胞及基质增生,局部毛细血管开放欠佳等病变特征。CCl4阳性对照组可见肾小管上皮细胞轻度水肿颗粒样变性,局部肾小球系膜基质节段性轻度增多,肾小球毛细血管腔内红细胞轻度淤积等病变特征。
2.2.5 对大鼠肺组织的影响 生何首乌组出现3例(3/12)肺组织中度损伤,4例(4/12)肺组织轻度损伤;制何首乌组出现2例(2/12)肺组织中度损伤,5例(5/12)肺组织轻度损伤。根据图7可以看出, 与正常对照大鼠比较, 生何首乌组大鼠可见局部肺泡壁间隔重度增宽伴单个核炎细胞浸润及纤维组织增生等病变特征。制何首乌组可见肺泡壁较广泛增宽伴单个核炎细胞浸润及纤维组织增生等病变特征。CCl4阳性对照组可见肺泡壁间隔明显增宽,间隔内较多单个核炎细胞浸润,毛细血管腔内红细胞淤积等病变特征。
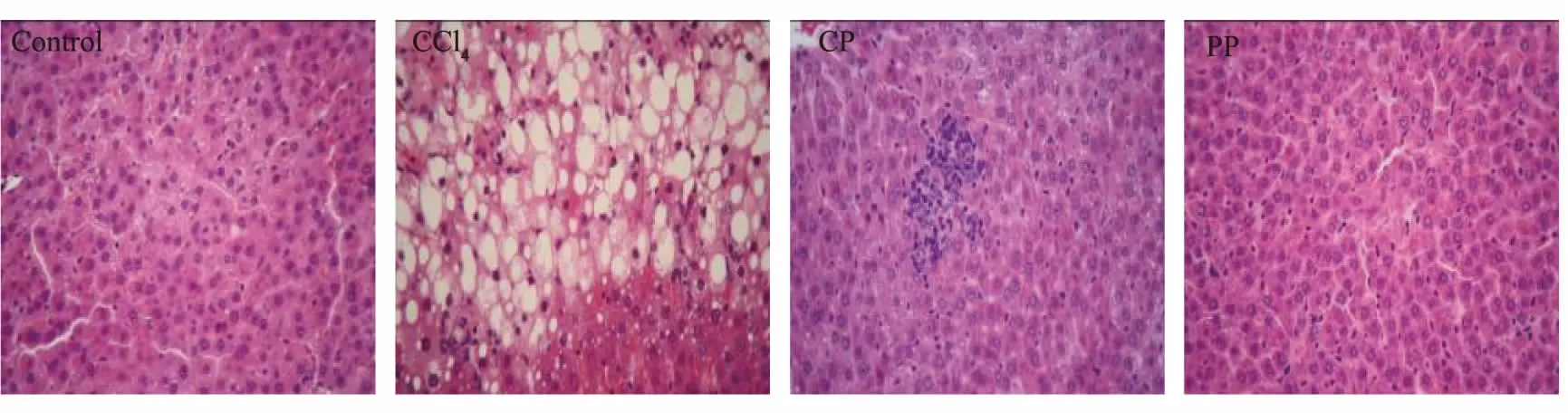
注:Control:正常对照组;CCl4:肝损伤阳性对照组;CP:生何首乌组; PP:制何首乌组
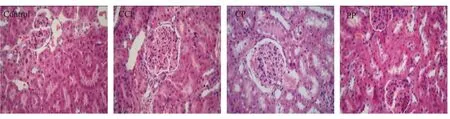
注:Control:正常对照组;CCl4:肝损伤阳性对照组;CP:生何首乌组; PP:制何首乌组
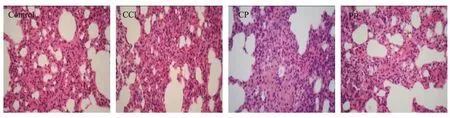
注:Control:正常对照组;CCl4:肝损伤阳性对照组;CP:生何首乌组; PP:制何首乌组
3 讨论
何首乌(生品和制品)不同提取物的毒性比较实验表明,醇提物的毒性比水提物和药材全粉的毒性大,提示何首乌的肝毒性物质可能集中在醇提物中。根据相似相溶的原理,醇提物比水提物含有较多的极性较弱蒽醌类成分,鲁彦等[21]也认为蒽醌主要存在于醇提物中。白研等[22]认为何首乌中蒽醌类成分主要含有大黄素和大黄酚。美国国家卫生研究院的研究表明,大黄素可引起F344/N大鼠和B6C3F1小鼠肾小管损伤及肝细胞病变[23]。孙向红等[24]研究发现大黄素和大黄酸是何首乌引发肝毒性的主要成分,高浓度长时间下具有细胞毒作用。张瑞晨等[27]研究发现,何首乌95%乙醇洗脱物是其引起肝损伤的主要物质,而大黄素是导致肝细胞损伤的成分之一。综合来看,何首乌所含蒽醌类成分可能是其重要的肝毒性成分之一,同时也提示服用何首乌药酒应该保持一定的警惕性。
进一步对何首乌醇提物的亚急性毒性实验表明,大剂量何首乌醇提物的毒性作用体现在多个方面,包括对体重增长的抑制作用、脏器指数异常、DBIL、ALB、CREA、ALP和CK等多项肝肾功能生化指标的显著改变,以及引起多个脏器(肝脏、肾脏和肺脏)的病理改变。特别值得一提的是,何首乌对大鼠脏器的损伤作用不只限于肝脏,对肺脏和肾脏同样有损害,其中何首乌的肺损伤作用为首次报道。何首乌与大黄属于同科植物,二者均含蒽醌类成分,文献报道大黄蒽醌成分可引起肾损伤[25],推测何首乌引发肾脏损伤的物质基础可能也是蒽醌类成分。何首乌对肺脏有损伤作用,而大黄未发现有肺损伤报道,提示何首乌损伤肺脏的物质可能与其所含特异性成分有关。
何首乌引发肝损伤的过程中,ALT和AST这两项临床常用的药物肝损害检测指标,除在第3天(生首乌组)曾经出现一过性显著升高外,在整个实验周期内均无显著性变化,而从动物的一般表现和病理改变来看,何首乌(生品和制品)确实有肝脏损伤的作用。CCl4阳性对照组给药第一周即引起ALT、AST显著升高,其机制是·CCl3自由基导致细胞膜脂质过氧化,从而使肝细胞膜受到破坏、通透性发生改变,致使肝脏细胞中ALT和AST等酶漏出[26],因而ALT和AST对CCl4引起肝脏损伤较为敏感。由于何首乌与CCl4对ALT和AST的影响规律不同,推测何首乌的肝损伤机制与CCl4不同。张瑞晨等[27]认为何首乌醇提物对人正常肝细胞L02周期阻滞从而引起凋亡。在肝细胞凋亡的早期,不一定会引起血ALT和AST显著升高。王涛等[28]报道了何首乌水提物也未引起血ALT和AST显著升高。综合来看,血清酶(ALT和AST)对何首乌早期肝损伤不敏感,难以早期有效预警中药何首乌对肝脏损伤的发生。
从生何首乌和制何首乌对比考察结果来看,制何首乌的毒性作用显著低于生何首乌,与传统及文献报道炮制减毒的认识相同[29]。从文献报道[30]及笔者相关研究来看,何首乌炮制品的质量参差不齐,相当数量的炮制品可能未达到足够的炮制时间或简化了炮制方法[31],难以达到炮制减毒的目的,可能是导致临床毒副反应发生的重要因素之一[32]。而目前药典检测含量控制指标和标准难以反映炮制程度。因此,笔者认为亟待增加反映炮制减毒程度的控制指标,加强制何首乌减毒的控制,保障临床用药安全。此外,目前生何首乌和制何首乌均为收录入可用于保健食品的物品名单,考虑到保健食品不限制服用剂量、时间和适应症,而何首乌(尤其是生何首乌)在大剂量下确可引起肝肾等脏器损害,是否将生何首乌列入可用于保健食品目录有待系统评价。综上,建议加强对何首乌毒副反应监测,临床用药严格按照药典规定的剂量(生何首乌<6 g/日,制何首乌<12 g/日),生何首乌长时间用药应注意监测肝肾损害,加强制何首乌炮制减毒控制标准研究。
[1] 国家药典委员会.中华人民共和国药典2010年版一部[M].北京:中国医药科技出版社,2010:164-165.
[2] Hinshaw LB.Sepsis/ septic shock:Participation of the microcirculation:An abbreviated review[J].Crit Care Med,1996,249(6):1072-1078.
[3] 国家食品药品监督管理局药品评价中心.英国MHRA警告何首乌的肝损害不良反应[J].中国药物警戒,2006,3(5):313-314.
[4] Park GJH, Mann SP, Ngu MC.Acute hepatitis inducedby Shou Wu Pian, a herbal product derived from Polygonum multiforum [J]. J Gastroenterol Hepatol, 2001,16(1):115-117.
[5] Panis B,Wong DR, Hooymans PM, et al. Recurrent toxic hepatitis in a Cau casian girl related to the use of Shou Wu Pian,a Chinese herb alpreparat ion [J].J Pediatr Gastroenterol Nutr, 2005,41(2):256-258.
[6] Battinelli L,Daniele C,Mazzanti G.New case of acute hepatitis following the consumption of Shou Wu Pian, a Chinese herbal product derived from Polygonum mu lt iflorum [J]. Ann Intern Med,2004,140(7):588-589.
[7] Cárdenas A, Rest repo J, Sierra F. Acute hepaitis due to Shen Min: a herbal product derived from Polygonum multiflorum [J]. J Clin Gas roenterol, 2006,40(7):629-632.
[8] Min HJ, Jung KA, Kim HJ, et al. Twelve cases of toxic hepatitis related to the root of Polygonum multiflorum Thunb [J].J Hepatol,2008,47:S356.
[9] But PP. Tomlinson B, Lee KL .Hepatitis related to the Chinese medicine Shou wu pian manufactured from Polygonum multiflorum [J]. Vet Hum Toxicol,1996,38(4):280-282.
[10] Ng KG, Cheng CL, Xu HX,et al. Safety issues of Chinese medicine: a review of Intoxication cases in Hong Kong [J]. Chin Herb Med,2010,1(1):29-39.
[11] 胡锡琴,耿增岩,李巧兰,等.制何首乌不同剂量与大鼠肝损伤程度的实验研究[J].陕西中医,2007,28(10):1420.
[12] 耿增岩,陈金铭,于德红,等. 制何首乌对大鼠肝损伤的实验研究[J].时珍国医国药,2010,21(4):1006.
[13] 刘煜德,黄小洵,吴丽莎,等.何首乌肝毒性实验研究[J].亚太传统医药, 2007,(4):71-72.
[14] 黄伟,张亚囡,孙蓉,等.何首乌不同组分单次给药对小鼠肝毒性“量-时-毒”关系研究[J].中国药物警戒,2011,8(4):193-196.
[15] 黄伟,张亚囡,孙蓉,等.何首乌不同组分对小鼠急性毒性试验比较研究[J].中国药物警戒,2010,7(12):705-707.
[16] 鄢良春,赵军宁,邱雄,等.何首乌安全性问题研究进展[J].中药药理与临床,2009,25(3):77-80.
[17] 李玥,徐立,刘若囡,等.炮制对何首乌小鼠急性毒性的影响[J].辽宁中医药大学学报,2011,13(5):248-249.
[18] 夏蕾,王丽霞,牟稷征,等.制何首乌单用或配伍用白蒺藜对小鼠肝脏毒性的比较研究[J].中国药房,2011,22(23):2122-2124.
[19] 胡锡琴,杨红莲,张晓琴,等.制何首乌对大鼠肝脏毒理的实验研究[J].陕西中医,2006,29(3):40-41.
[20] 胡锡琴,杨晓青,刑玉瑞,等.制何首乌致肝损害的实验研究[J].陕西中医,2006,27(5):625-626.
[21] 鲁彦,郭建宇,朱贤,等.分光光度法测定大黄中总蒽醌[J].理化检验-化学分册,2011,47(3):297-299.
[22] 白研,黄丽玫,毋福海,等.德庆首乌中蒽醌类成分的含量测定[J].广东药学院学报,2001,17(1):40-41.
[23] National Toxicology Program (2001) Technical report on the toxicology andcarcinogenesis studies of emodin in F344/N rats and B6C3F1 mice. Series No.493. NIH Publication No. 01-3952. U.S. Department of Health and HumanServices, Public Health Service, National Institutes of Health, Research TrianglePark, NC.
[24] 孙向红,孙玉维,李红,等.何首乌主要成分大黄素、大黄酸和二苯乙烯苷对肝细胞、肝癌细胞的影响[J].现代中西医结合杂志,2011,19(11):1315-1318.
[25] 王伽伯,马永刚,张萍,等.炮制对大黄化学成分和肝肾毒性的影响及其典型相关分析[J].药学学报,2009,44(8):885-890.
[26] Crocenzi FA,Sisti A,Pellgehino JM, et al. Role of bile salts in colchicine-induced hepatotoxicity. Implications for hepatocellular integrity and function [J]. Toxicology, 1997,121(2):127-142.
[27] 张瑞晨,刘斌,孙震晓,等.何首乌提取物对人正常肝细胞L02周期阻滞及凋亡的影响[J].中西医结合学报,2010,8(6):554-560.
[28] 王涛,王佳颖,江振洲,等.何首乌水提物大鼠连续灌胃给药28d肝毒性研究—胆汁淤积相关性分析[J].中国中药杂志,2012,37(10):1445-1449.
[29] Wu XQ,Chen XZ,Huang QC,et al. Toxicity of raw and processed roots of Polygonum multiflorum[J]. Fitoterapia, 2012, 83(3):469-475.
[30] 陈艳.何首乌炮制程度与内在质量相关性的研究[D].北京:北京中医药大学,2004.
[31] 李卫先,张琦,王国仁,等.不同炮制方法炮制的何首乌的质量标准探讨[J].中国医药导报,2012,9(9):41-42.
[32] 张力,杨晓晖,孙震晓,等.何首乌临床不良事件回顾性研究及风险控制措施探讨[J].中国中药杂志,2009,34(13):1724-1729.
