金雀异黄素对类风湿关节炎患者成纤维样滑膜细胞骨保护素/细胞核因子κB受体活化因子/细胞核因子κB受体活化因子配体通路的影响
2013-01-22王燕茹沈维干马莹莹方振玉
王燕茹,张 育,沈维干,尚 辰,马莹莹,方振玉
(扬州大学临床医学院 江苏省苏北人民医院风湿免疫科,江苏扬州 225001)
类风湿关节炎(rheumatoid arthritis,RA)是以关节病变为主的慢性炎性疾病,可导致关节畸形。RA具有明显致残率,在其自然病程中,5~10年致残率为60%,30年致残率达90%,35% RA患者在10年内丧失工作能力[1]。抗炎治疗是缓解RA患者临床症状的重要手段。然而,RA治疗更重要的是抑制关节破坏,防止关节变形,保护关节功能。目前,许多新方法使RA炎性反应得以很好地控制,但仍不能完全阻断关节破坏。如何干预并有效预防RA患者关节破坏、促进骨修复、改善患者生活质量是风湿病学者亟待解决的一个难题。
研究发现,细胞核因子κB受体活化因子(receptor-activator of nuclear factor kappa bata,RANK)、细胞核因子κB受体活化因子配体(receptor-activator of nuclear factor kappa bata ligand,RANKL)和骨保护素(osteoprotegerin,OPG)是破骨细胞生成、活化、发育、激活及成熟过程中的关键性调控因子[2]。RANKL属于肿瘤坏死因子(tumor necrosis factor,TNF)家族,其受体包括两种,一种是存在于破骨细胞前体细胞膜表面的RANK,RANKL与RANK结合可促进破骨细胞分化、成熟;另一种受体是OPG,OPG与RANKL的结合能力较RANK强,可以竞争性地阻碍RANKL与RANK的结合,达到抑制破骨细胞分化的目的[2]。研究表明,RA患者骨侵蚀部位成骨细胞的骨形成减弱[3]。TNF-α是控制疾病的关键因子之一,其可使参与骨吸收的破骨细胞生成增多,同时抑制参与骨重建的成骨细胞分化,导致软骨下骨组织破坏[3]。已有研究证实,金雀异黄素(genistein,Gen)对RA有治疗作用[4]。本研究探讨Gen对RA患者成纤维样滑膜细胞(fibroblast-like synoviocytes,FLS)OPG/RANKL/RANK通路的影响及机制。
材料和方法
试剂及细胞
人RA-FLS(408RA-05a)购自广州吉妮欧生物有限公司;Gen购自江苏恒瑞医药股份有限公司提供;兔Anti-OPG购自美国SANTA CRUZ公司;兔Anti-RANKL购自美国SANTA CRUZ公司;兔Anti-RANK购自美国SANTA CRUZ公司;辣根过氧化物酶标记的羊抗兔IgG抗体及荧光标记的二抗购自武汉博士德生物工程有限公司。
分组
根据3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)实验结果,选择Gen对RA-FLS细胞的非抑制浓度,具体分为(1)对照组:RA-FLS细胞;(2)TNF-α组:RA-FLS细胞+TNF-α(10 ng/ml);(3)TNF-α+Gen组:RA-FLS细胞+TNF-α(10 ng/ml)+Gen(50 μM);(4)Gen组:RA-FLS细胞+Gen(50 μM)。
实验方法
取第4代RA-FLS,行细胞计数、调整细胞悬液,使细胞浓度达到5×105/ml,接种于直径为10 cm的细胞培养皿中,分别加入预先配制好的Gen,分组同上述。37℃、5% CO2培养72 h后终止培养,收取细胞提蛋白,用蛋白印迹(Western blotting)法检测Gen对RA-FLS细胞RANK、RANKL、OPG、雌激素受体(estrogen receptor α,ERα)表达的影响。应用免疫荧光法检测Gen影响RA-FLS内ERα分布情况。应用流式细胞仪检测FLS表面标记。
统计学处理
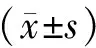
结 果
FLS形态观察和鉴定
FLS贴壁前为圆形,复苏4~6 h后开始贴壁。24 h后均贴壁,并伸出生长突,可见许多细胞呈梭形树突状生长,有少量呈圆形生长,胞质突起细长或较短,具有成纤维样细胞的特性,细胞长满可呈旋涡状分布(图1)。
FLS表面标记可见人RA-FLS有CD29、CD90高表达(图2)。
Gen对FLS的RANKL/OPG/RANK系统及ERα表达的影响
Gen组、TNF-α组及TNF-α+Gen组细胞内RANK蛋白表达量较对照组无明显差异(P=0.302),但OPG及RANKL蛋白表达明显高于对照组(P=0.002,P=0.031)。Gen组OPG/RANKL较对照组增高(P=0.002)。Gen组、TNF-α组及TNF-α+Gen组细胞内ERα蛋白表达量与对照组比较,差异无统计学意义(P=0.401)(图3)。
Gen对人RA-FLS内ERα入核的影响
Gen作用RA-FLS 24 h后,与对照组比较,Gen组RA-FLS内ERα细胞核处荧光强度较强;与雌激素组比较,Gen组RA-FLS荧光强度类似(图4)。
讨 论
RA患者可因骨质丢失导致畸形关节疼痛、进行性功能障碍、骨折发生率增加、死亡率升高。现在研究发现,破骨细胞是RA骨质和关节破坏的中枢效应细胞,RANKL/OPG/RANK是调节破骨细胞募集和活化的重要因子。正常骨组织中,骨吸收重建主要通过成骨细胞及破骨细胞发挥作用,而RANK/RANKL/OPG通路是连接骨形成和骨吸收的重要因子,RANKL/OPG的平衡决定了破骨细胞活化和增殖水平[5]。RANKL分为膜结合状态与可溶性状态,主要由成骨细胞、免疫细胞和一些肿瘤细胞产生,其结合于破骨细胞表面受体RANK,通过破骨基因和活化多个核细胞刺激骨质吸收。OPG属于TNF受体超家族,具有拮抗RANKL的生物功能。OPG是成骨细胞分泌RANKL诱饵受体,可减少RANKL与RANK的结合及骨质吸收,其存在于成人肺、心、肾、肝脏、胸腺、淋巴结、骨髓、成骨细胞、血管平滑肌细胞、B淋巴细胞和关节软骨细胞[6]。维生素D3、白介素(interleukin,IL)-1α、IL-1β、TNF-α、TNF-β、骨形态发生蛋白-2(bone morphogenetic protein 2,BMP2)、转化生长因子β、17-雌二醇及Wnt信号路可调节OPG的表达。
RA患者的关节炎性反应由多种细胞及细胞因子引起,滑膜细胞是其中较为重要的细胞,其可通过分泌趋化因子及黏附因子诱导淋巴细胞及巨噬细胞等聚集、活化。RA-FLS具有侵袭性,可在RA发病过程中可从静止的、相对无细胞组织的细胞转变为畸形增长、侵入组织的、且具有免疫活性的细胞,可侵袭细胞外基质,并致关节破坏进一步加剧。RA-FLS主要通过产生细胞因子维持炎性环境及蛋白酶,并导致软骨破坏,也可迁移至关节软骨并通过分泌骨质金属蛋白酶、丝氨酸蛋白酶和组织蛋白酶破坏基质[7-8]。Herenius等[9]认为,破骨基因活化通路存在于炎性关节病中,FLS是骨和关节破坏的关键细胞[9]。由于RA-FLS在RA发病中的重要作用,本次研究主要选取了RA-FLS为研究对象,探讨Gen影响下RA-FLS内RANKL/OPG/RANK通路的改变情况,揭示其对调控破骨细胞可能影响。蛋白印迹检测结果示,Gen可以上调人RA-FLS中OPG及RANKL,且对OPG的上调作用更强,Gen组OPG/RANKL增高;但Gen对RANK表达无明显影响。上述结果提示,Gen可能通过影响OPG/RANKL平衡发挥其抑制RA骨质破坏作用。
TNF-α是引起RA关节炎性反应的重要因子,其可以通过刺激多种细胞活化、分泌细胞因子引起关节炎炎性反应。本研究发现,TNF-α组及TNF-α+Gen组RA-FLS内RANKL及OPG较对照组均有上调,且TNF-α+Gen组OPG上调幅度更大,提示Gen可以抑制TNF-α诱导的关节破坏。
Gen为植物雌激素,具有多种生物学效应,并具有酪氨酸激酶抑制剂的作用[10]。目前,许多研究认为,Gen具有雌激素样作用,能抑制糖皮质激素及双侧卵巢切除诱导的骨质疏松动物模型的骨质疏松进展[11-13]。本研究发现,Gen作用的RA-FLS在细胞核处荧光强度更强,提示Gen可能通过与雌激素受体结合,转入核内发挥免疫调节作用。同时,免疫印迹检测结果提示Gen作用FLS后ERα表达量无明显变化,提示Gen可能主要通过调节ERα功能、而非改变表达量调节FLS功能。
体内环境下RA发病过程受到多种细胞及其分泌细胞因子共同影响,较体外环境更为复杂。有研究发现,脂多糖等因子可诱导RANKL的生成增加[14]。Romas等[15]发现随着体外培养RA-FLS代数增加,FLS细胞表面RANKL将减少,认为这种表现可能与体外FLS细胞离开关节内炎性环境相关。
(本文图1~4见插页Ⅰ)
[1]Allaire S, Wolfe F, Niu J, et al. Contemporary prevalence and incidence of work disability associated with rheumatoid arthritis in the US[J].Arthritis Rheum, 2008, 59:474-480.
[2]Ando K, Mori K, Rédini F, et al. RANKL/RANK/OPG:key therapeutic target in bone oncology[J].Curr Drug Discov Technol, 2008, 5:263-268.
[3]Walsh NC, Gravallese EM. Bone remodeling in rheumatic disease:a question of balance[J].Immunol Rev, 2010, 233:301-312.
[4]魏华,张育,高波,等. 金雀异黄素对CIA大鼠成纤维样滑膜细胞分泌的血管新生相关因子的影响[J].中华风湿学杂志,2010, 14:25-29.
[5]Chanawirat A, Khemapech S, Patumraj S, et al. Genistein replacement therapy on endothelial dysfunction and bone loss in bilateralovariectomized rats[J].Clin Hemorheol Microcirc, 2006, 34:309-314.
[6]Holmdahl R, Andersson ME, Goldschmidt TJ, et al. Collagen induced arthritis as an experimental model of rheumatoid arthritis[J].APMIS, 1989, 97:575-584.
[7]Kim HS, Kim AR, Park HJ, et al. Morus bombycis Koidzumi extract suppresses collagen-induced arthritis by inhibiting the activation of nuclear factor-κB and activator protein-1 in mice[J].J Ethnopharmacol, 2011, 136:392-398.
[8]Silva I, Branco JC. Rank/Rankl/opg:literature review[J].Acta Reumatol Port, 2011, 36:209-218.
[9]Herenius MM, Oliveira AS, Wijbrandts CA, et al. Anti-TNF therapy reduces serum levels of chemerin in rheumatoid arthritis:a new mechanism by which anti-TNF might reduce inflammation[J].PLoS One, 2013, 8:e57802.
[10] Velders M, Solzbacher M, Schleipen B, et al. Estradiol and genistein antagonize the ovariectomy effects on skeletal muscle myosin heavy chain expression via ER-α mediated pathways[J].J Steroid Biochem Mol Biol, 2010, 120:53-59.
[11] Zhang Y, Zhu G, Gu S, et al. Genistein inhibits osteolytic bone metastasis and enhances bone mineral in nude mice[J].Environ Toxicol Pharmacol, 2010, 30:37-44.
[12] Dai R, Ma Y, Sheng Z, et al. Effects of genistein on vertebral trabecular bone microstructure, bone mineral density, microcracks, osteocyte density, and bone strength in ovariectomized rats[J].J Bone Miner Metab, 2008, 26:342-349.
[13] Zhang Y, Zhu G, Gu S, et al. Genistein inhibits osteolytic bone metastasis and enhances bone mineral in nude mice[J].Environ Toxicol Pharmacol, 2010, 30:37-44.
[14] Oka H, Miyauchi M, Furusho H, et al. Oral administration of prostaglandin E(2)-specific receptor 4 antagonist inhibits lipopolysaccharide-induced osteoclasto-genesis in rat periodontal tissue[J].J Periodontol, 2012, 83:506-513.
[15] Romas E, Gillespie MT, Martin TJ. Involvement of receptor activator of NFΚB ligand and tumor necrosis factor-in bone destruction in rheumatoid arthritis[J].Bone, 2002, 30:340-346.