银胶菊叶和花提取物对南方根结线虫的毒杀活性比较
2012-12-31苏秀荣张纪龙王金信
苏秀荣,谢 宁,张纪龙,王金信,①
根结线虫病主要危害黄瓜(Cucumis sativus L.)、番茄(Lycopersicon esculentum Mill.)和茄子(Solanum melongena L.)等常见蔬菜[1],是蔬菜生产过程中的主要障碍之一[2]。目前,化学防治仍是植物寄生线虫病害的最主要防治措施,但是这类杀线虫剂的毒性较高,使用成本也高,环境相容性较差[3]。近年来,利用植物天然活性物质防治植物害虫的研究报道越来越多[4-6]。
银胶菊(Parthenium hysterophorus L.)原产于美国德克萨斯州及墨西哥北部,现广泛分布于全球热带地区。其花有毒,花粉可造成人和家畜(牛)发生过敏性皮炎;该种的繁殖力强且具有较强的化感潜力,可抑制邻近杂草和作物的生长[7-9];银胶菊叶的乙醚提取物可导致埃及伊蚊(Aedes aegypti L.)产卵能力降低及卵死亡[10];其鲜叶及种子的蒸馏水提取物可抑制南方根结线虫(Meloidogyne incognita Chitwood)卵的孵化并具有杀线虫活性[11-12]。而有关银胶菊提取物对根结线虫的毒性与控制的研究报道相对较少。
鉴于此,作者采用不同溶剂对银胶菊叶和花的干粉进行了提取及萃取,并比较了它们对南方根结线虫的杀虫活性,以期为进一步合理利用银胶菊以及寻找新型植物源杀线虫剂提供一定的实验基础。
1 材料和方法
1.1 材料
供试的银胶菊叶和花均采自山东临沂莒南,为野生植株;于盛花期采集全株后分别收集叶和花,阴干、粉碎后备用。供试南方根结线虫采自山东农业大学温室内种植的接种有南方根结线虫的番茄苗[13];从番茄根结表面挑取新鲜卵囊,将卵粒放于自制孵化器中,置于25℃恒温培养箱内进行孵化,每隔24 h收集2龄幼虫[14]供试。
所用仪器包括MP502B型电子天平(上海精天电子仪器有限公司)、美国Corning-Costar 24孔细胞培养板(上海艾研生物科技有限公司)、250 mL索氏提取器(北京朋利驰科技有限公司)、LRH-150-G型恒温培养箱(广东省医疗器械厂)、RE52-4型旋转蒸发仪(上海沪西分析仪器厂)和SZ6045型双目镜(日本奥林巴斯光学工业株式会社);主要溶剂有蒸馏水、甲醇(AR)、乙酸乙酯(AR)、石油醚(AR)和三氯甲烷(AR),由天津凯通化学试剂有限公司生产。
1.2 方法
1.2.1 不同溶剂提取物的制备 取银胶菊叶和花的干燥粉末各5 g,分别加入150 mL蒸馏水、甲醇、乙酸乙酯和石油醚,用索氏提取器浸提5 h后抽滤,浸提液经旋转蒸发仪减压蒸馏浓缩至10 mL,将浓缩的浸提液置于55℃恒温干燥箱中,待溶剂挥发后,得到对应溶剂的提取物浸膏。用蒸馏水将各提取物浸膏配制成质量体积分数10%的待测溶液母液,其中,配制乙酸乙酯和石油醚提取物溶液时需加入1滴500号表面活性剂(十二烷基磺酸钙)助溶。
1.2.2 甲醇提取物的萃取分离 取银胶菊叶和花的干燥粉末各1 000 g,分别加入3倍体积的甲醇,置于55℃水浴中浸提5 h后,按上述方法获得提取物浸膏;然后用300 mL HCl(pH 2)溶解浸膏,抽滤除去残渣;滤液用石油醚萃取3次,每次100 mL。弃石油醚层,酸水层合并后用100 mL三氯甲烷萃取,共萃取3次;合并三氯甲烷层萃取液,蒸馏回收三氯甲烷,干燥后获得三氯甲烷Ⅰ层萃取物。酸水层用氨水调节酸碱度(pH 9~pH 10),然后再用三氯甲烷萃取3次,每次100 mL,合并三氯甲烷层,蒸馏回收三氯甲烷,干燥后获得三氯甲烷Ⅱ层萃取物。碱水层经减压蒸馏浓缩干燥后获得固形物。分别用蒸馏水配制成质量体积分数5%的待测母液,用于杀虫活性测定。
使用极性不同的溶剂,按照极性从小到大依次对上述碱水层固形物进行萃取分离,溶剂分别为:三氯甲烷、V(三氯甲烷)∶V(甲醇)=10∶1、V(三氯甲烷)∶V(甲醇)=8∶1、V(三氯甲烷)∶V(甲醇)=5∶1、V(三氯甲烷)∶V(甲醇)=4∶1、V(三氯甲烷)∶V(甲醇)=2∶1、V(三氯甲烷)∶V(甲醇)=1∶1、V(三氯甲烷)∶V(甲醇)=1∶2、V(三氯甲烷)∶V(甲醇)=1∶4、甲醇、V(甲醇)∶V(水)=1∶1。各溶剂均萃取3次,每次200 mL,合并相同溶剂的萃取物,共收集到11个萃取组分,即A1~A11,用于杀虫活性测定。
1.2.3 生物碱的定性检测 参照文献[15]的2种方法分别对不同溶剂提取物、萃取物及萃取组分进行生物碱定性检测,使用的检测剂分别是碘化铋钾试剂(在酸性溶液中与生物碱反应生成棕红色沉淀)和硅钨酸试剂(在酸性溶液中与生物碱反应生成灰白色沉淀)。
1.2.4 杀虫活性测定方法 采用药液浸泡法[14]测定待测溶液对南方根结线虫的杀虫活性。将0.5 mL线虫悬浮液注入细胞培养板的样品孔内,根据不同待测液的质量体积分数加入一定体积的待测溶液母液,用蒸馏水补足至总体积1 mL,混合均匀后置于25℃培养箱中培养。其中,不同溶剂提取物的质量体积分数为1.0%、0.5%和0.2%,甲醇提取物的碱水层、三氯甲烷Ⅰ层和Ⅱ层萃取物的质量体积分数为1.0%,组分A1~A11的质量体积分数为0.2%和0.1%;以蒸馏水作为蒸馏水和甲醇提取物或萃取物的空白,以含有1滴500号表面活性剂并稀释相同倍数的蒸馏水作为乙酸乙酯和石油醚提取物的空白。每处理4次重复,每个重复约30条试虫。分别于处理后24和48 h检查各待测液中线虫的死亡与存活情况,并分别计算线虫的死亡率和校正死亡率。
1.3 数据处理
按照公式“得率=(提取物浸膏质量/粉末样品质量)×100%”计算提取物得率。线虫死亡率和校正死亡率的计算公式分别为:死亡率=(死亡虫数/供试虫数)×100%;校正死亡率=〔(处理组死亡率-空白组死亡率)/(1-空白组死亡率)〕×100%。
采用南京农业大学王绍华编制的STST统计软件对实验数据进行差异显著性分析。
2 结果和分析
2.1 不同组分的提取率及生物碱定性检测
采用蒸馏水、甲醇、乙酸乙酯及石油醚为溶剂,对银胶菊叶和花的干粉进行提取,不同溶剂提取物的得率差异明显。叶和花蒸馏水提取物的得率最高,分别为24.5%和20.3%;叶和花甲醇提取物的得率次之,分别为19.6%和10.9%;叶和花乙酸乙酯提取物的得率分别为6.8%和7.7%;叶和花石油醚提取物的得率最低,分别为2.0%和2.7%。尽管叶和花的蒸馏水和甲醇提取物的得率较高,但蒸馏水提取物中杂质较多,难以提纯,因而选取银胶菊叶和花的甲醇提取物进行进一步的活性组分萃取与分离。
生物碱定性检测结果表明:银胶菊叶和花的甲醇和水提取物,叶和花甲醇提取物的碱水层、三氯甲烷Ⅰ和Ⅱ层萃取物,以及叶和花甲醇提取物碱水层的不同极性组分A1~A11中均含有大量的生物碱。
2.2 不同组分的杀线虫活性分析
2.2.1 不同溶剂提取物的杀虫活性比较 用银胶菊叶和花的4种溶剂提取物处理24和48 h后南方根结线虫的校正死亡率分别见表1和表2。总体来看,在质量体积分数相同的条件下,银胶菊叶和花的蒸馏水提取物对南方根结线虫的杀虫活性最强,甲醇提取物次之,乙酸乙酯提取物较弱,石油醚提取物最弱;不同溶剂提取物对南方根结线虫的毒杀活性随其质量体积分数的降低而减弱,即质量体积分数越低,对试虫的毒杀活性越弱,试虫的校正死亡率越低。
用质量体积分数1.0%、0.5%和0.2%的银胶菊叶蒸馏水提取物处理48 h,南方根结线虫的校正死亡率都达到95%以上;用质量体积分数1.0%和0.5%的银胶菊叶甲醇提取物进行处理,南方根结线虫的48 h校正死亡率也达到95%以上。用质量体积分数1.0%和0.5%的银胶菊花蒸馏水提取物进行处理,南方根结线虫的24和48 h校正死亡率都达到了100.00%;而用质量体积分数1.0%和0.5%的银胶菊花甲醇提取物进行处理,南方根结线虫的48 h校正死亡率也较高,均超过90%。差异显著性分析结果表明:银胶菊叶和花的4种溶剂提取物对南方根结线虫的杀虫活性基本都存在显著差异。
表1 用银胶菊叶不同溶剂提取物处理24和48 h后南方根结线虫死亡率比较(±SD)1)Table1 Comparison ofmortality of Meloidogyne incognita Chitwood treated by different solvent extracts from leaf of Parthenium hysterophorus L.for 24 and 48 h(±SD)1)
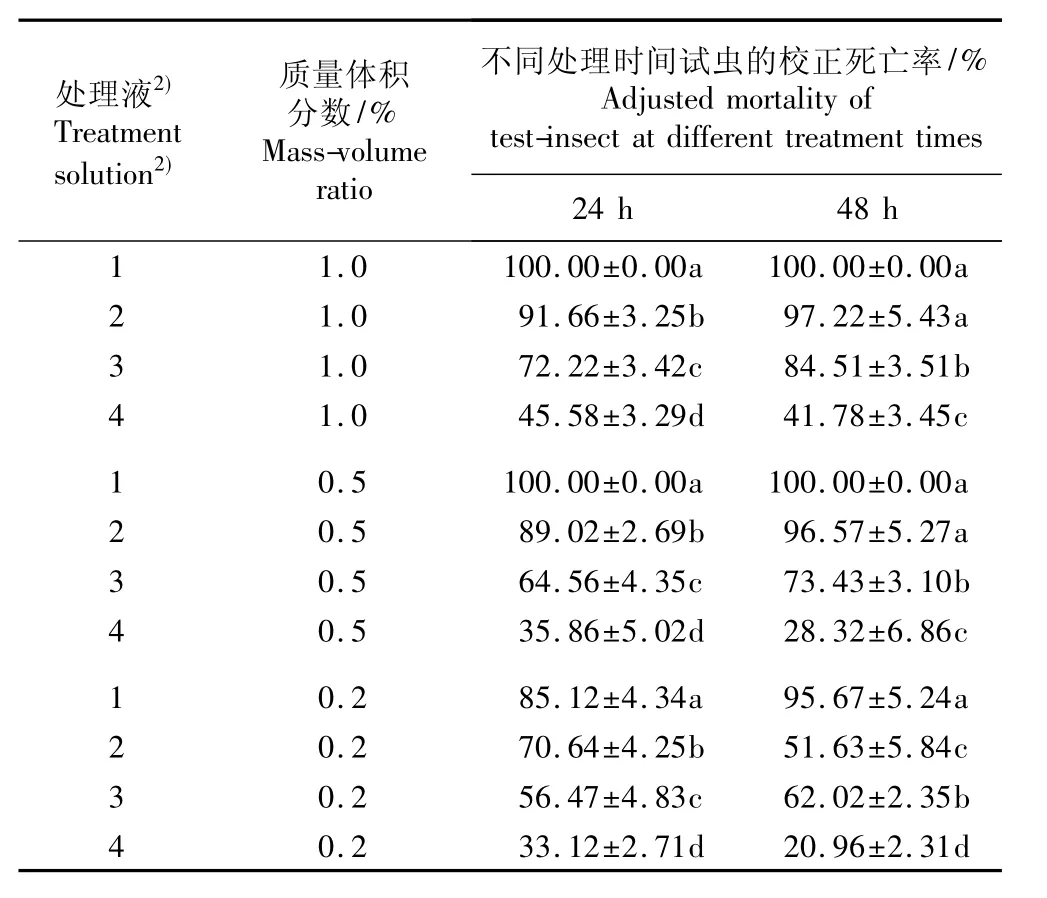
表1 用银胶菊叶不同溶剂提取物处理24和48 h后南方根结线虫死亡率比较(±SD)1)Table1 Comparison ofmortality of Meloidogyne incognita Chitwood treated by different solvent extracts from leaf of Parthenium hysterophorus L.for 24 and 48 h(±SD)1)
1)同列中不同的小写字母表示差异显著(P=0.05)The different small letters in the same column indicate the significant difference (P=0.05).2)1:蒸馏水提取物Distilled water extracts;2:甲醇提取物 Methanol extracts;3:乙酸乙酯提取物Ethyl acetate extracts;4:石油醚提取物Petroleum ether extracts.
处理液2) Treatment solution2)质量体积分数/% Mass-volume ratio不同处理时间试虫的校正死亡率/% Adjusted mortality of test-insect at different treatment times 24 h 48 h 1 1.0 100.00±0.00a 100.00±0.00a 2 1.0 91.66±3.25b 97.22±5.43a 3 1.0 72.22±3.42c 84.51±3.51b 4 1.0 45.58±3.29d 41.78±3.45c 1 0.5 100.00±0.00a 100.00±0.00a 2 0.5 89.02±2.69b 96.57±5.27a 3 0.5 64.56±4.35c 73.43±3.10b 4 0.5 35.86±5.02d 28.32±6.86c 1 0.2 85.12±4.34a 95.67±5.24a 2 0.2 70.64±4.25b 51.63±5.84c 3 0.2 56.47±4.83c 62.02±2.35b 4 0.2 33.12±2.71d 20.96±2.31d
表2 用银胶菊花不同溶剂提取物处理24和48 h后南方根结线虫死亡率比较(±SD)1)Table2 Comparison ofmortality of Meloidogyne incognita Chitwood treated by different solvent extracts from flower of Parthenium hysterophorus L.for 24 and 48 h(±SD)1)
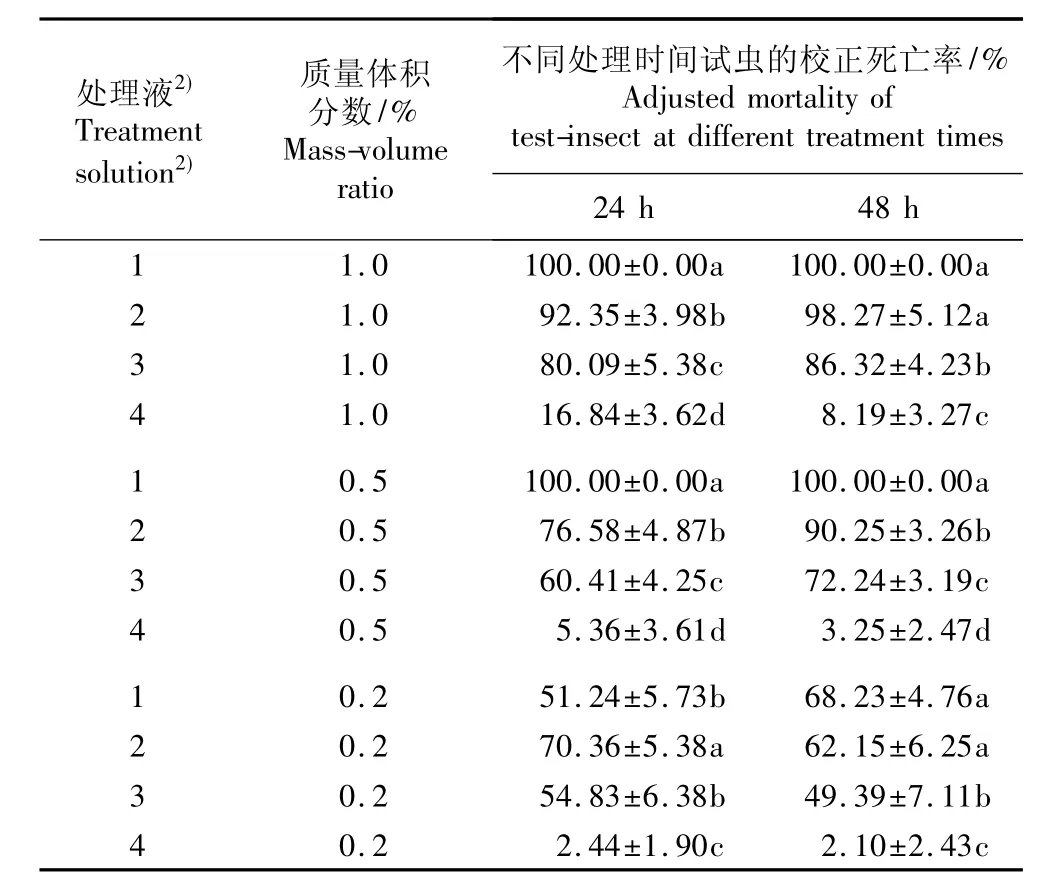
表2 用银胶菊花不同溶剂提取物处理24和48 h后南方根结线虫死亡率比较(±SD)1)Table2 Comparison ofmortality of Meloidogyne incognita Chitwood treated by different solvent extracts from flower of Parthenium hysterophorus L.for 24 and 48 h(±SD)1)
1)同列中不同的小写字母表示差异显著(P=0.05)The different small letters in the same column indicate the significant difference (P=0.05).2)1:蒸馏水提取物Distilled water extracts;2:甲醇提取物 Methanol extracts;3:乙酸乙酯提取物Ethyl acetate extracts;4:石油醚提取物Petroleum ether extracts.
处理液2) Treatment solution2)质量体积分数/% Mass-volume ratio不同处理时间试虫的校正死亡率/% Adjusted mortality of test-insect at different treatment times 24 h 48 h 1 1.0 100.00±0.00a 100.00±0.00a 2 1.0 92.35±3.98b 98.27±5.12a 3 1.0 80.09±5.38c 86.32±4.23b 4 1.0 16.84±3.62d 8.19±3.27c 1 0.5 100.00±0.00a 100.00±0.00a 2 0.5 76.58±4.87b 90.25±3.26b 3 0.5 60.41±4.25c 72.24±3.19c 4 0.5 5.36±3.61d 3.25±2.47d 1 0.2 51.24±5.73b 68.23±4.76a 2 0.2 70.36±5.38a 62.15±6.25a 3 0.2 54.83±6.38b 49.39±7.11b 4 0.2 2.44±1.90c 2.10±2.43c
2.2.2 甲醇提取物中不同萃取物的杀虫活性比较 将银胶菊叶和花甲醇提取物的碱水层、三氯甲烷Ⅰ层和Ⅱ层萃取物配制成质量体积分数1.0%的处理液,对南方根结线虫的毒杀活性差异明显,24和48 h的校正死亡率见表3。表3结果显示:银胶菊叶和花甲醇提取物的碱水层萃取物以及花甲醇提取物的三氯甲烷Ⅰ层萃取物对南方根结线虫的毒杀活性均最强,24和48 h的校正死亡率均为100.00%,显著高于其他萃取物(P<0.05);而其叶甲醇提取物的三氯甲烷Ⅰ层和花甲醇提取物的三氯甲烷Ⅱ层萃取物也均具有一定的杀线虫活性,处理24和48 h后南方根结线虫的校正死亡率均在50%以上;相对而言,银胶菊叶甲醇提取物的三氯甲烷Ⅱ层萃取物对南方根结线虫的毒杀活性最弱,处理24和48 h后南方根结线虫的校正死亡率均在50%以下,显著低于其他萃取物(P<0.05)。
表3 用银胶菊花和叶甲醇提取物的不同萃取物处理24和48 h后南方根结线虫死亡率比较(±SD)1)Table 3 Comparison ofmortality of Meloidogyne incognita Chitwood treated by different partitioned extracts from methanol extracts of flower and leaf of Parthenium hysterophorus L.for 24 and 48 h(± SD)1)
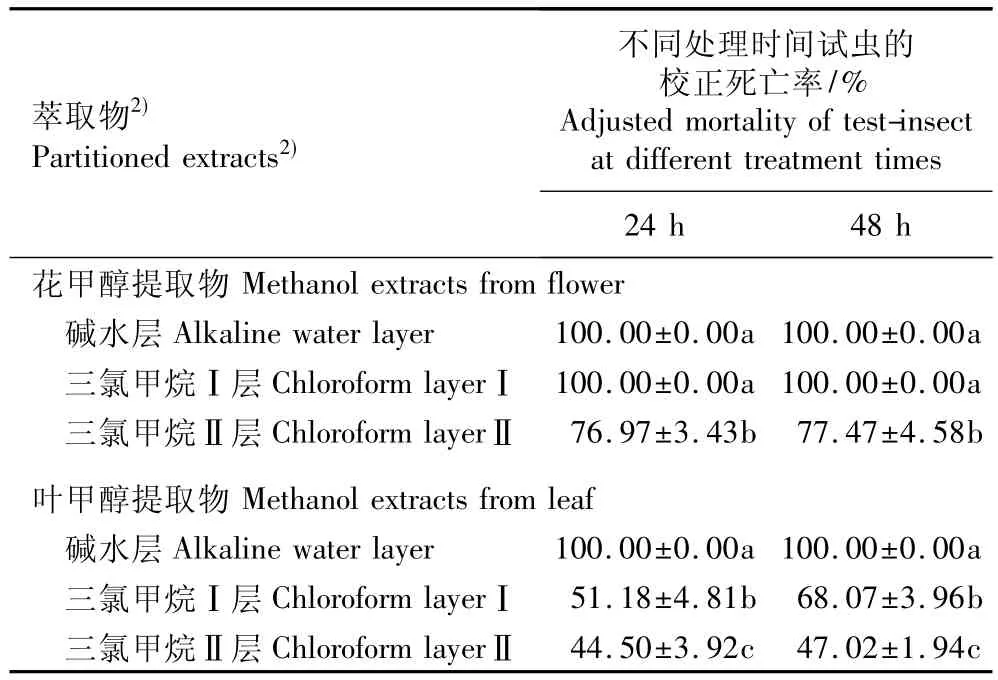
表3 用银胶菊花和叶甲醇提取物的不同萃取物处理24和48 h后南方根结线虫死亡率比较(±SD)1)Table 3 Comparison ofmortality of Meloidogyne incognita Chitwood treated by different partitioned extracts from methanol extracts of flower and leaf of Parthenium hysterophorus L.for 24 and 48 h(± SD)1)
1)同列中不同的小写字母表示差异显著(P=0.05)The different small letters in the same column indicate the significant difference (P=0.05).2)萃取物的质量体积分数为1.0%Mass-volume ratio of partitioned extracts is 1.0%.
萃取物2) Partitioned extracts2)不同处理时间试虫的校正死亡率/% Adjusted mortality of test-insect at different treatment times 24 h 48 h花甲醇提取物Methanol extracts from flower碱水层Alkaline water layer 100.00±0.00a 100.00±0.00a三氯甲烷Ⅰ层Chloroform layerⅠ 100.00±0.00a 100.00±0.00a三氯甲烷Ⅱ层Chloroform layerⅡ 76.97±3.43b 77.47±4.58b叶甲醇提取物Methanol extracts from leaf碱水层Alkaline water layer 100.00±0.00a 100.00±0.00a三氯甲烷Ⅰ层Chloroform layerⅠ 51.18±4.81b 68.07±3.96b三氯甲烷Ⅱ层Chloroform layerⅡ44.50±3.92c 47.02±1.94c
2.2.3 甲醇提取物碱水层中不同极性组分的杀虫活性比较 用银胶菊叶和花甲醇提取物碱水层的不同极性组分(A1~A11)处理48 h后,南方根结线虫的校正死亡率见表4。由表4可见:在花甲醇提取物碱水层的11个组分中,用质量体积分数0.2%和0.1%的A2〔溶剂为V(三氯甲烷)∶V(甲醇)=10∶1〕和A7〔溶剂为V(三氯甲烷)∶V(甲醇)=1∶1〕处理48 h后南方根结线虫的校正死亡率都达100.00%,显著高于其他组分;在叶甲醇提取物碱水层的11个组分中,用质量体积分数0.2%和0.1%的A2和A6〔V(三氯甲烷)∶V(甲醇)=2∶1〕处理48 h后南方根结线虫的校正死亡率都达100.00%,也显著高于其他组分;而其他组分对南方根结线虫的毒杀活性均明显低于上述4个组分。
表4 用银胶菊花和叶甲醇提取物碱水层的不同萃取组分处理48 h后南方根结线虫死亡率比较(±SD)Table 4 Comparison ofmortality of Meloidogyne incognita Chitwood treated by different partitioned constituents from alkaline water layer of methanol extracts from flower and leaf of Parthenium hysterophorus L.for 48 h(±SD)
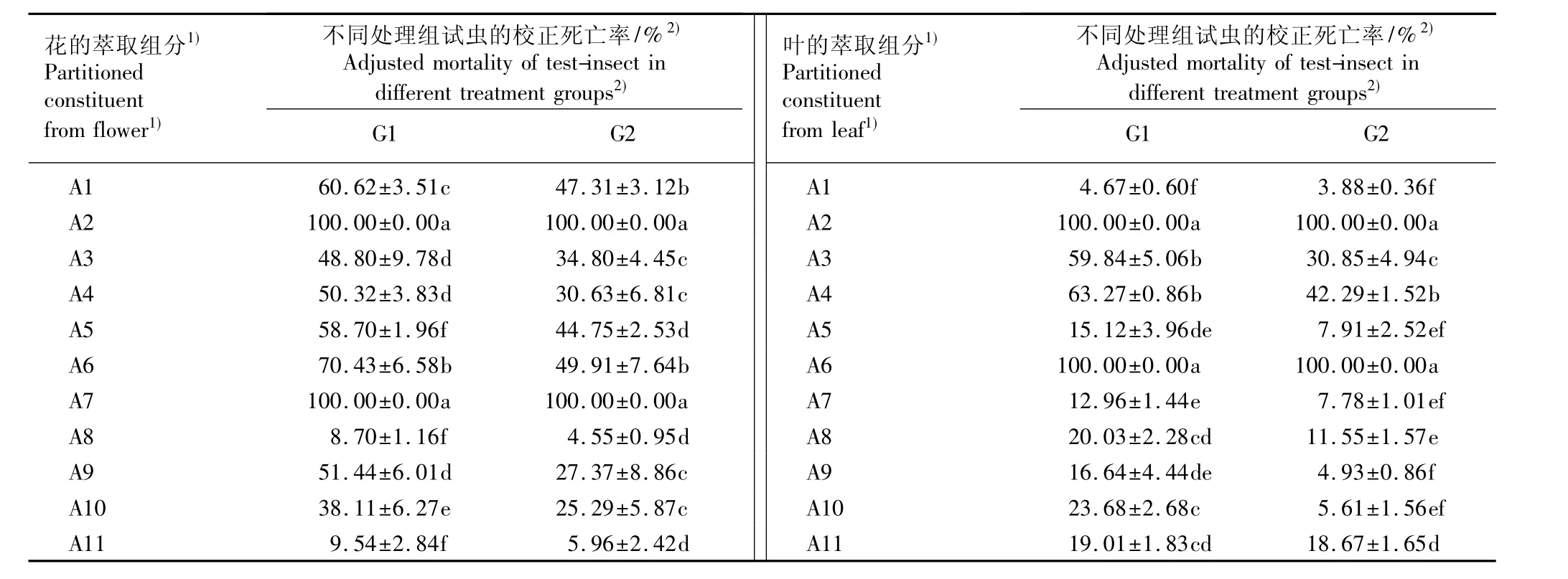
表4 用银胶菊花和叶甲醇提取物碱水层的不同萃取组分处理48 h后南方根结线虫死亡率比较(±SD)Table 4 Comparison ofmortality of Meloidogyne incognita Chitwood treated by different partitioned constituents from alkaline water layer of methanol extracts from flower and leaf of Parthenium hysterophorus L.for 48 h(±SD)
1)组分A1~A11的萃取剂依次为三氯甲烷、V(三氯甲烷)∶V(甲醇)=10∶1、V(三氯甲烷)∶V(甲醇)=8∶1、V(三氯甲烷)∶V(甲醇)=5∶1、V(三氯甲烷)∶V(甲醇)=4∶1、V(三氯甲烷)∶V(甲醇)=2∶1、V(三氯甲烷)∶V(甲醇)=1∶1、V(三氯甲烷)∶V(甲醇)=1∶2、V(三氯甲烷)∶V(甲醇)=1∶4、甲醇、V(甲醇)∶V(水)=1∶1 Partitioned solvents of A1-A11 constituents are in order of chloroform,V(chloroform)∶V(methanol)=10∶1,V(chloroform)∶V(methanol)=8∶1,V(chloroform)∶V(methanol)=5∶1,V(chloroform)∶V(methanol)=4∶1,V(chloroform)∶V(methanol)=2∶1,V(chloroform)∶V(methanol)=1∶1,V(chloroform)∶V(methanol)=1∶2,V(chloroform)∶V(methanol)=1∶4,methanol,V(methanol)∶V(water)=1∶1.2)同列中不同的小写字母表示差异显著(P=0.05)The different small letters in the same column indicate the significant difference(P=0.05).G1:各萃取组分的质量体积分数为0.2%Mass-volume ratio of partitioned constituents is 0.2%;G2:各萃取组分的质量体积分数为0.1%Massvolume ratio of partitioned constituents is 0.1%.
花的萃取组分1) Partitioned constituent from flower1)不同处理组试虫的校正死亡率/%2) Adjusted mortality of test-insect in different treatment groups2) G1 G2叶的萃取组分1) Partitioned constituent from leaf1)不同处理组试虫的校正死亡率/%2) Adjusted mortality of test-insect in different treatment groups2) G1 G2 A1 60.62±3.51c 47.31±3.12b A1 4.67±0.60f 3.88±0.36f A2 100.00±0.00a 100.00±0.00a A2 100.00±0.00a 100.00±0.00a A3 48.80±9.78d 34.80±4.45c A3 59.84±5.06b 30.85±4.94c A4 50.32±3.83d 30.63±6.81c A4 63.27±0.86b 42.29±1.52b A5 58.70±1.96 f 44.75±2.53d A5 15.12±3.96de 7.91±2.52ef A6 70.43±6.58b 49.91±7.64b A6 100.00±0.00a 100.00±0.00a A7 100.00±0.00a 100.00±0.00a A7 12.96±1.44e 7.78±1.01ef A8 8.70±1.16 f 4.55±0.95d A8 20.03±2.28cd 11.55±1.57e A9 51.44±6.01d 27.37±8.86c A9 16.64±4.44de 4.93±0.86f A10 38.11±6.27e 25.29±5.87c A10 23.68±2.68c 5.61±1.56ef A11 9.54±2.84 f 5.96±2.42d A11 19.01±1.83c d 18.67±1.65d
3 讨论和结论
实验结果证实:银胶菊是含有杀线虫活性物质的植物,与一些具有杀线虫活性的植物种类[16]类似,银胶菊不同部位提取物对南方根结线虫的毒杀活性有一定差异。用质量体积分数1.0%和0.5%的银胶菊叶和花蒸馏水提取物处理48 h后试虫的校正死亡率均达100.00%;但质量体积分数0.2%的叶蒸馏水提取物对南方根结线虫的毒杀活性则高于其花的蒸馏水提取物,这与Hasan等[17]的研究结果相似。同种植物不同溶剂提取物的杀线虫活性差异较大[18-19],而银胶菊叶和花的蒸馏水或甲醇提取物的杀虫活性较强,这与Sharma等[11]和Khurma等[12]的研究结果一致,说明银胶菊叶或花中含有的杀虫活性物质可能含有极性较大的官能团。用银胶菊叶和花的石油醚和乙酸乙酯提取物进行处理,南方根结线虫表现出明显的复活现象;用质量体积分数0.2%的石油醚和乙酸乙酯提取物进行处理,48h后试虫的校正死亡率比24 h低,说明这些提取物可能对南方根结线虫有麻痹作用,在数小时甚至数十小时之后因提取物的麻痹作用失效,试虫得以复活[14];也可能是其中的部分活性成分不稳定,转变成其他非活性物质,导致部分试虫复活。
具有杀线虫活性的植物次生代谢产物种类较多,生物碱是其中的重要成分之一[20]。银胶菊叶和花的甲醇提取物的不同溶剂萃取物中,碱水层萃取物的提取量较大而且杀线虫活性强,与其中所含的生物碱成分有关,值得进行进一步分离与开发利用研究。在银胶菊叶和花的甲醇提取物的不同溶剂萃取物中,用质量体积分数1.0%的花和叶碱水层萃取物以及花的三氯甲烷Ⅰ层萃取物分别处理48 h,试虫的校正死亡率为 100.00%,但用叶的三氯甲烷Ⅰ层萃取物处理48 h,试虫的校正死亡率仅为68.07%。与叶相比,银胶菊花甲醇提取物的三氯甲烷层萃取物有较强的杀虫活性,说明银胶菊花中的杀线虫活性成分更多或含量更高。其叶和花甲醇提取物碱水层的不同极性组分对南方根结线虫的杀虫活性不同,其中,以V(三氯甲烷)∶V(甲醇)=10∶1和V(三氯甲烷)∶V(甲醇)= 1∶1为溶剂提取的花甲醇提取物碱水层组分、以及用V(三氯甲烷)∶V(甲醇)=10∶1和V(三氯甲烷)∶V(甲醇)=2∶1为溶剂提取的叶甲醇提取物碱水层组分均具有较强的杀虫活性,说明银胶菊的杀线虫活性可能是数种活性成分单独或共同作用的结果。Datta等[21]的研究结果表明:银胶菊中的倍半萜内酯类衍生物具有一定的杀线虫活性。而本实验提取的具有杀线虫活性的提取物及组分中除生物碱外是否还含有倍半萜内酯类衍生物则有待进一步分离研究。
银胶菊对南方根结线虫的毒杀活性不仅与提取部位及溶剂的种类和极性有关,提取物浓度及作用时间等因素也对其杀线虫活性有不同程度的影响。根据研究结果,建议选择极性较大的甲醇或蒸馏水对银胶菊的叶和花进行浸提,并且有必要采取进一步的萃取分离方法对其中的杀虫活性成分进行分离纯化,以寻找有效的杀线虫生物源农药。
[1]赵 鸿,彭德良,朱建兰.根结线虫的研究现状[J].植物保护,2003,29(6):6-9.
[2]张 博,王会利,慕立义.蔬菜根结线虫的发生与防治[J].农药,2002,43(9):4-5.
[3]ZASADA I A,TENUTA M.Chemical-mediated toxicity of N-Viro Soil to Heterodera glycines and Meloidogyne incognita[J].Journal of Nematology,2004,36(3):297-302.
[4]杨秀娟,何玉仙,卢学松,等.若干植物粗提物对根结线虫幼虫的杀线虫活性测定[J].福建农业学报,2005,20(1):19-22.
[5]李 美,高兴祥,高宗军,等.苍耳等48种植物提取物的杀虫活性[J].植物资源与环境学报,2008,17(1):33-37.
[6]孙娈姿,呼天明,王佺珍,等.菊苣叶片不同溶剂提取物对粘虫的生物活性[J].植物资源与环境学报,2010,19(4):31-36.
[7]TEFERA T.Allelopathic effects of Parthenium hysterophorus extracts on seed germination and seedling growth of Eragrostis tef[J].Journal of Agronomy and Crop Science,2002,188(5):306-310.
[8]PANDEY D K,KAURAW L P,BHAN V M.Inhibitory effect of parthenium(Parthenium hysterophorus L.)residue on growth ofwater hyacinth(Eichhornia crassipes Mart Solms)Ⅱ.Relative effect of flower,leaf,stem,and root residue[J].Journal of Chemical Ecology,1993,19(11):2663-2670.
[9]陈业兵,王金信,彭学岗,等.银胶菊叶对苘麻和稗的化感作用[J].植物保护学报,2009,36(1):77-81.
[10]KUMAR S,SINGH A P,NAIR G,et al.Impact of Parthenium hysterophorus leaf extracts on the fecundity,fertility and behavioural response of Aedes aegypti L.[J].Parasitology Research,2011,108(4):853-859.
[11]SHARMA N,TRIVEDI P C.Screening of leaf extracts of some plants for their nematicidal and fungicidal properties against Meloidogyne incognita and Fusarium oxysporum[J].Asian Journal of Experimental Sciences,2002,16(1/2):21-28.
[12]KHURMA U R,ARCHANA S.Nematicidal potential of seed extracts:in vitro effects on juvenile mortality and egg hatch of Meloidogyne incognita and M.javanica[J]. Nematologia Mediterranea,1997,25(1):49-54.
[13]王海迎,宗建平,魏书娟,等.茼蒿甲醇提取物不同萃取组分对南方根结线虫发育的影响[J].农药,2009,48(1):69-71.
[14]丁 琦,罗万春,肖 婷,等.13种植物源化合物对南方根结线虫的毒力比较[J].植物资源与环境学报,2007,16(3): 35-39.
[15]宋晓凯.天然药物化学[M].北京:化学工业出版社,2004: 248-249.
[16]郑 良,FERRIS H.58种中(草)药对植物寄生线虫Meloidogyne javanica和Pratylenchus vulnus的药效研究[J].植物病理学报,2001,31(2):175-183.
[17]HASAN N,JAIN R K.Biotoxicity of Parthenium hysterophorus extracts against Meloidogyne incognita and Helicotylenchus dihystera[J].Nematologia Mediterranea,1984,12(2):239-242.
[18]杨秀娟,何玉仙,陈福如,等.不同植物提取液的杀线虫活性评价[J].江西农业大学学报:自然科学版,2002,24(3): 386-389.
[19]刘 晟,张 敏,顾 玲,等.22种中草药提取物杀根结线虫活性[J].农药,2009,48(8):598-602.
[20]丁 琦,徐守健,闫 磊,等.具杀线虫作用的植物源化合物研究[J].世界农药,2006,28(2):33-40,28.
[21]DATTA S,SAXENA D B.Pesticidal properties of parthenin(from Parthenium hysterophorus)and related compounds[J].Pest Management Science,2001,57(1):95-101.
