一株蜜蜂病原物拮抗细菌的分离与鉴定
2012-11-28张其安张庆娜吕祝章杨少波
张其安 张庆娜 吕祝章 杨少波
(1.山东华康蜂业有限公司,山东日照 276500;2.日照职业技术学院,山东日照 276826)
欧洲幼虫腐臭病简称欧幼病,是蜜蜂幼虫的一种细菌性消化道传染病,在世界各地均有发生,具有传播迅速、发病快的特点,中蜂(Apis cerana Cerana Fabricius)比意蜂(Apis mellifera ligustica Spinola)更容易受感染[1]。欧洲幼虫腐臭病是由多种致病菌共同作用而引起的,但其主要病原是蜂房蜜蜂球菌(Melissococcus pluton),其它细菌为次生菌,具有加速被感染幼虫死亡的作用[2]。蜂房蜜蜂球菌是一种革兰氏阳性菌,但有染色特性不稳定,有时候可能为革兰氏阴性菌,兼性厌氧[3-4]。蜂房蜜蜂球菌抵御不良环境的能力极强,能在蜂尸上存活数年,在粉蜜里也能保持长久的毒性,所以欧洲幼虫腐臭病是一种传染性极强的蜜蜂传染病。
蜜蜂欧洲幼虫腐臭病的防治方面的研究始于20世纪初,随着四环素、磺胺类抗生素的相继问世,使得蜜蜂欧洲幼虫腐臭病的流行得以有效的控制[5]。当前人们对无公害和绿色食品要求的与日俱增,蜂产品中多种抗生素残留的检测已经成为许多国家蜂产品质量检测的必检项目。美国、欧盟、日本等国家已禁止含有多种抗生素残留的蜂产品进入本国,这对我国蜜蜂欧洲幼虫腐臭病的防治工作又提出了新的要求[6]。本研究以蜂房蜜蜂球菌为靶标, 从土壤中分离获得一株对蜂房蜜蜂球菌有高拮抗活性的细菌,对其进行了分离、鉴定研究,并对其抗菌谱及其发酵液的抑菌效果进行了测定。
1 材料与方法
1.1 材料
S1菌株由本实验室分离获得;大肠杆菌K12(Escherichia coli K12)由山东农业大学林学院生物技术实验室提供;病原菌:蜂房蜜蜂球菌(Melissococcus pluton)、蜂房哈夫尼菌(Hafnia alvei)、幼虫芽孢杆菌(Paenibacillus larvae)、蜜蜂球囊菌(Ascosphaera apis)由本实验室保存。
1.2 土壤样品采集
在山地林区选择无人为干扰、有机质含量丰富、水分适宜的土壤采样,注明采集地点、日期、土壤号和植被状况等信息。
1.3 菌悬液制备及分离培养
称取土样10g放入无菌研钵中研碎,加入无菌蒸馏水100ml制成10-1的土壤悬液,摇床上200r/min振荡30min,静止5min,吸取上清液1mL 做系列稀释,梯度分别为10-2、10-3、10-4、10-5、10-6、10-7、10-8。分离采样涂抹法,28℃~30℃培养,从12h起开始有明显的菌落出现,根据微生物菌落的形状、大小、表面结构、边缘形状质地、光泽、透明度、正反颜色和产生的可溶性物等特征,将单菌落接种到试管斜面培养基上培养并编号。
1.4 拮抗性能的检测
采用平板对峙法测定菌株的拮抗性能,28℃培养96h,测量病原菌与筛选菌的相对距离,确定拮抗作用的大小,保留效果优良的菌株。将菌株接种于PDA液体培养基,发酵72h后灭菌并分离菌株获得无菌发酵液,采用平板扩散法测定发酵液的拮抗活性,28℃培养6h~12h,记录抑菌圈直径,从而筛选获得拮抗性和发酵性能优良的菌株。
1.5 菌株鉴定
1.5.1 菌体形态、培养特征观察及生理生化指标测定:菌株形态、培养特征观察、需氧性和运动性测定、生长温度测定、pH 5.7培养基中生长状况观察、耐盐试验、柠檬酸盐利用试验、接触酶试验、脲酶试验、糖醇类发酵试验、V-P试验、硝酸盐还原试验、淀粉水解、明胶液化、H2S产生试验、M.R.试验(甲基红试验)、纤维素分解试验,参照文献[7]的方法进行。
1.5.2 DNA的G+Cmol%值测定和Tm值测定:参照文献[14]方法进行。以大肠杆菌K12作为参比对照核实试验误差,计算G+Cmol%值。
1.5.316SrRNA序列同源性分析:以提取的总DNA为模板用16S rRNA基因的专一性引物R-ACGGCTAC CTTGTTACGACT,F-AGAGTTTGATCCTGGCTCAG作为PCR引物,通过PCR扩增染色体DNA上的16S rDNA。将阳性克隆进行测序,测序结果在NCBI数据库上Blast,从其结果中选出具有代表性的菌株,得到它们的16SrDNA全序列,在DNAMAN上建立其系统进化树。
2 结果与分析
2.1 菌株的分离筛选
经拮抗性能的检测和继代培养,筛选到一株对蜜蜂病原细菌和真菌具有较强拮抗作用的细菌,编号S1。S1发酵液稀释30~40倍后对几种病原菌仍具有拮抗作用,说明该菌株具有良好的发酵性状。
2.1 S1菌株的拮抗性能测定结果
S1菌株抑菌谱广,对多种供试病原菌有较强拮抗作用。幼虫芽孢杆菌(Paenibacillus larvae)、蜂房蜜蜂球菌(Melissococcus pluton)、蜂房哈夫尼菌(Hafnia alvei)、蜜蜂球囊菌(Ascosphaera apis)具有较强的拮抗作用,结果见表1。

表1 S1菌株对多种病原细菌和真菌的拮抗作用
2.2 S1菌株的形态特征及培养特征
菌株革兰氏染色为阳性,产芽孢,有荚膜;鞭毛为两端着生,运动能力不强;菌体呈杆状,大小为(0.6~1.0)µm×(1.7~4.6)µm。在PDA平板上菌落呈圆形,表面中间突起,有光泽、光滑、湿润;在澄清的肉汤中生长良好,在培养液表面无膜层;营养琼脂柱表面有菌落,而且不断蔓延变厚;穿刺线上有少量生长物,可以使明胶培养基液化;在尿素培养中生长良好,并产生淡黄色物质。
2.3 S1菌株生理生化特征
S1菌株各项生理生化指标如表2所示:该菌株为好氧菌;菌体在pH5.7的培养基中生长良好;不能在含有7%NaCl或0.001%溶菌酶的培养基上生长;不能利用柠檬酸作为碳源;可以利用;可以利用无机氮源(NH4)2SO4、NH4Cl、(NH4)2HPO4、NH4H2PO4和硝酸盐。菌株过氧化氢酶试验为阳性反应;脲酶试验为阴性反应;葡萄糖、木糖、山梨醇、蔗糖、甘露醇发酵试验反应为阳性,产酸并产生大量的气体,不能利用甘油发酵产酸;水解淀粉试验为阳性;可使明胶液化;能很好地水解纤维素;不产硫化氢;厌氧硝酸盐生长,但不产气;甲基红试验为阴性反应;V-P 试验为阳性反应。
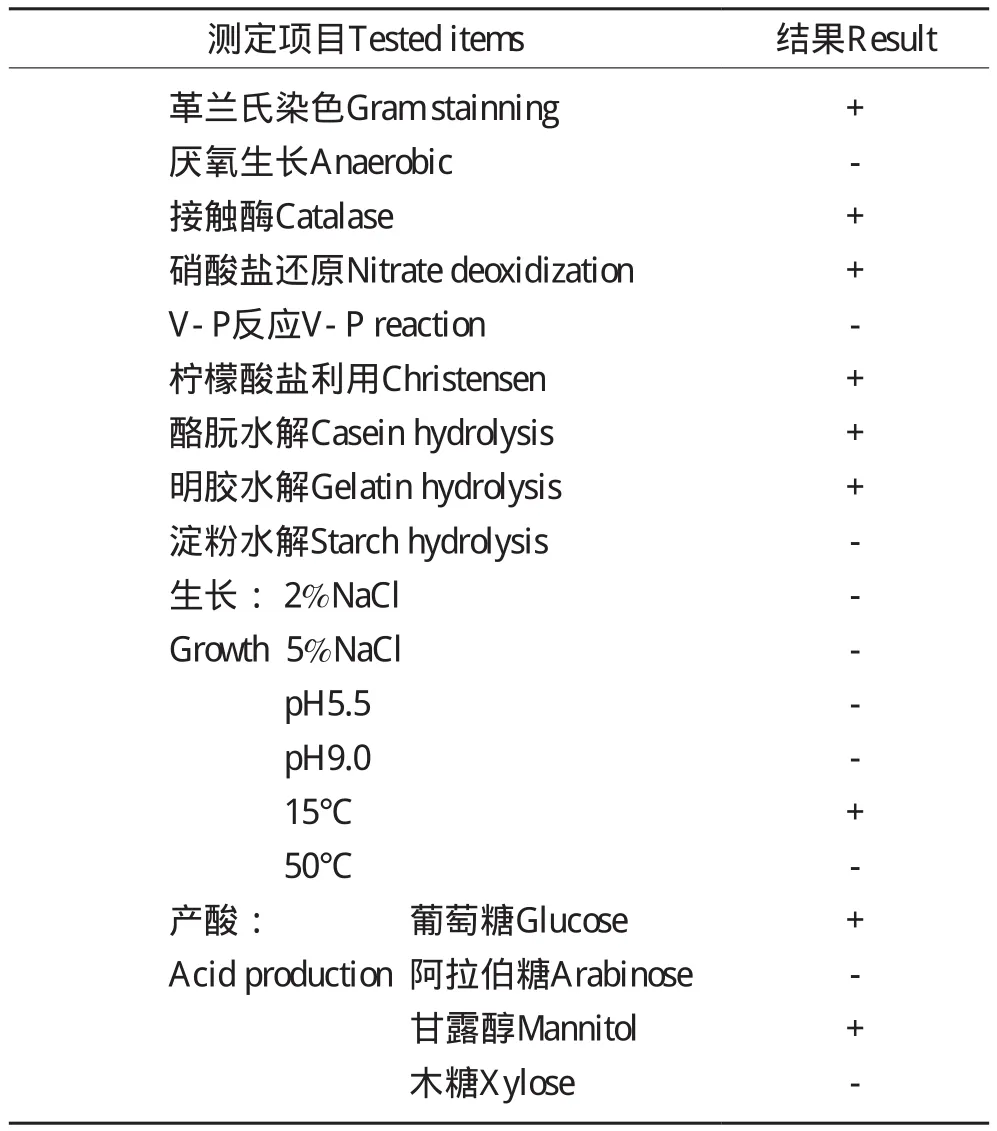
表2 S1菌株的生理生化特征
2.4 DNA的G+Cmol%值
根据DNA 变性过程中吸光度随温度上升变化曲线,获得吸光度增加值的中点对应温度(Tm)为73.2 C,代入计算公式得G+Cmol%值为45.8,该值符合文献[7]中对类芽孢杆菌DNA的G+Cmol%值的描述。
2.5 系统进化树的构建及分析
利用16Sf/16Sr一对引物扩增得到的S1菌株16S rRNA序列长度大约为1426 bp,符合常规的16S rRNA序列长度。
经测序,该菌株的16S rRNA核酸序列全长为1426 bp,将此序列与数据库中的相关种进行比较,与其同源性较高的菌株均属于类芽孢杆菌属,选取15株与S1序列相似性高的菌株进行系统发育分析,用MEGA5.0软件程序包中的Neighbor-Joining法构建以16S rRNA全序列为基础的系统进化树(图1),可以看出,S1菌株与类芽孢杆菌属中的Paenibacillus brasilensis进化距离最近,相似性为99%。因此,结合形态学特征、培养特征、生理生化特征和DNA的G+Cmol%含量分析,依据系统命名法将该菌株命名为:Paenibacillus brasilensisHK-1。
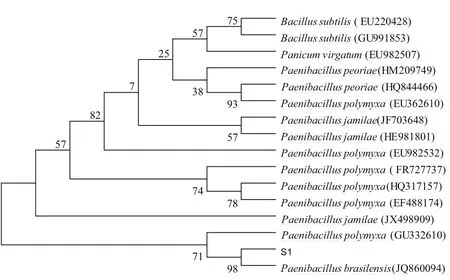
图1 利用16S rRNA同源序列和邻接法(Neighbor-Joining)构建的系统发育树
3 结果与分析
传统畜牧业中化学兽药的过量使用不仅导致了许多病虫害的抗药性,更造成了生态环境的恶化。着这种情况之下,高效且对生态和环境安全的天然抗菌剂特别是微生物源抗菌剂收到越来越多的关注[8]。本研究从浮来山林地土壤中筛选到一株对蜂房蜜蜂球菌具有拮抗活性的菌株S1。通过鉴定,S1菌株属类芽孢杆菌属,16S rRNA序列分析发现该菌株与类芽孢杆菌属中的Paenibacillus brasilensis进化距离最近,因此将该菌株命名为:Paenibacillus brasilensisHK-1。
利用微生物活体防治蜜蜂欧洲幼虫腐臭病不仅有对其释放风险的担忧,也受释放技术及环境温度、湿度等诸多因素的限制,所以研究者更期望从拮抗菌种提取活性物质用于生物防治[9]。本实验室对Paenibacillus brasilensis HK-1菌株的发酵、抗菌物质分离纯化及结构鉴别工作正在进行中,期望该菌株及其抗菌物质在控制蜜蜂欧洲幼虫腐臭病等蜜蜂细菌性疾病方面能有所作为。
[1]周婷, 冯峰, 董秉义.中华蜜蜂的欧洲幼虫腐臭病病原研究[J].昆虫学报, 2000, 43: 104-108.
[2]Govan V A, Brozel V, Allsopp M H, et al.A PCR Detection Method for Rapid Identification of Melissococcus pluton in Honeybee Larvae[J].Applied Aand Environmental Microbiology, 1998, 64(5):1983-1985.
[3]Alexander B, Philip S, David R, et al.The detection of Melissococcus pluton in honey bees (Apis mellifera) and their products using a hemi-nested PCR[J].Apidologie, 2003, 34: 19-27.
[4]Forsgren E, Cassel A, Imdorf A, et al.Distribution of Melissococcus plutonius in Honeybee Colonies with and without Symptoms of European Foulbrood[J].Microb Ecol, 2005, 50: 369-374.
[5]周婷, 冯峰, 董秉义, 等.中华蜜蜂的欧洲幼虫腐臭病病原的药物试验研究[J].畜牧兽医学报, 2001, 32(3): 283-288.
[6]张其安,王娟,杨少波.蜜蜂细菌性疾病及其防治的研究进展[J].中国蜂业, 2011, 62: 25-30.
[7]布坎南 R E, 吉本斯 N E.伯杰氏细菌鉴定手册(第八版)[M].北京:科学出版社, 1984.
[8]杨少波,刘训理.多年类芽孢杆菌及其产生的生物活性物质研究进展[J].微生物学通报, 2008, 35(10): 1621-1625.
[9]Klich M A, Lax A R, Bland J M, et al.Influence of iturin A on mycelial weight and aflatoxin production by asper-gilles parasiticus in shake culture[J].Mycopathologia, 1993, 123: 35-38.
