成年斑胸草雀弓状皮质栎核投射神经元电生理特性的性别差异
2012-11-14范博强侯国强李东风
范博强,侯国强,潘 璇,李东风
(华南师范大学生命科学学院,广东广州 510631)
成年斑胸草雀弓状皮质栎核投射神经元电生理特性的性别差异
范博强,侯国强,潘 璇,李东风*
(华南师范大学生命科学学院,广东广州 510631)
利用离体脑片膜片钳技术检测RA投射神经元电生理活动的主动和被动特性,对其性别差异进行探讨,发现鸣禽RA投射神经元电生理特性在发放频率和诱发动作电位幅值方面存在明显的性别差异.
成年斑胸草雀; 弓状皮质栎核投射神经元; 电生理特性; 性别差异
鸣禽是研究学习记忆神经机制的理想动物模型.鸣禽的鸣唱学习依赖于脑内的一组离散的核团以及它们之间的连接通路,其被称之为鸣唱控制系统[1].鸣唱控制系统由发声运动通路和前端脑学习通路组成.其中发声运动通路由高级发声中枢(high vocal centre, HVC)直接发出投射神经元与前运动核团弓状皮质栎核(robust nucleus of the arcopallium, RA)形成突触连接.发声运动通路的主要功能在于控制鸣曲的发出,直接参与鸣禽的发声运动行为.而前端脑通路也是由HVC发出,最后通过新纹状体前部巨细胞核外侧部(lateral magnocellular nucleus of the anterior neostriatum, LMAN)将前端脑通路中的信息传递给RA.其主要功能是鸣曲的习得及对鸣唱可塑性的调节[2].RA作为运动指令信息输出核团,其核团内的生理活动变化成为2条通路影响鸣唱的最直接作用靶点.因此,RA核团在鸣唱系统中占有重要的地位.RA核团主要由2类神经元组成:投射神经元和中间神经元,其电生理特性具有明显的差异[3].
鸣禽的鸣唱有着明显的性别差异.对鸣禽性别差异的研究多是从激素水平对鸣禽相关鸣唱核团进行研究,很少有从单个神经元水平比较鸣禽性别差异的报道[4-5].鸣禽鸣唱系统在单个神经元水平上是否存在与核团水平类似的性别差异?单个神经元的电生理特性是否存在性别差异?这些需要进一步深入研究.本研究利用离体脑片膜片钳技术,对不同性别的斑胸草雀中RA核团投射神经元电生理特性进行比较,观察其在电生理特性方面的差异.
1 材料与方法
1.1实验动物
健康的成年雌性和雄性斑胸草雀(Taeniopygiaguttata)各10只,体质量10~15 g,由华南师范大学生命科学学院动物房提供.
1.2试剂
切片液(mmol/L)为:Sucrose 248,KCl 5,NaHCO328,Glucose 10,MgSO4·7H2O 1.3,NaH2PO4·H2O 1.26;人工脑脊液(mmol/L)为:NaCl 125,NaHCO325,NaH2PO4·H2O 1.27,KCl 2.5,MgSO4·7H2O 1.2,CaCl22.0,Glucose 25;用蔗糖调节渗透压至350 mOsm.电极内液(mmol/L)为:KMeSO4120,NaCl 5,HEPES 10,EGTA 2,Mg-ATP 2,Na-GTP 0.3,pH 7.2,渗透压330 mOsm.
1.3主要仪器
微电极拉制器(P-97, Sutter Instrument, USA)、振动切片机(NVSIM1, WPI, USA)、正置显微镜(OLYMPUS, DP30BW, JAPAN)、微操纵器(MP-285, Sutter Instrument)、膜片钳放大器(MultiClamp 700B, Axon Instrument)、数/模转换器(DIGIDATA 1322A, Axon Instrument)、pClamp9.2软件(Axon Instruments)等.
1.4脑片的制备
麻醉后快速断头,迅速取脑置于已预通15 min 95%O2+5%CO2混合气(体积分数,下同)的冰水混合的切片液中冷却30 s~1 min,然后用振动切片机切取含有RA核团的脑片,约250~300 μm,转移到37 ℃的孵育槽,通以95%O2+5%CO2混合气,孵育30 min,然后在35 ℃人工脑脊液中孵育1 h,之后保持室温孵育.在此条件下脑片可存活8~10 h,通气时注意防止脑片随气泡翻动.
1.5膜片钳全细胞式记录
1.5.1 微电极的制备 硬质玻璃毛坯管(Sutter Instrument)拉制微电极.在全细胞记录中应用的记录电极尖端的阻抗一般为3~5 MΩ.
1.5.2 膜片钳记录 取孵育好的脑片放到记录槽内并将脑片轻轻压住,在显微镜下寻找合适的RA投射神经元[6].先封接形成细胞吸附式,然后在电压钳模式下破膜为全细胞式.分别在2种模式下记录RA投射神经元的自发与诱发电位.每个细胞记录时间大约为15~20 min.
1.6统计学分析
实验记录到的信号输入膜片钳放大器,并由数模转换器最终转入相连的计算机,记录信号的监测、存储及分析处理以及通过记录电极给予细胞的指令电压均由pClamp 9.2软件完成.所得实验数据采用t检验由Origin 8.0进行统计分析并作图.数据用平均值±标准差(Mean±SD)表示.
2 结果与分析
2.1RA核团及其神经元的形态学观察
在低倍显微镜下(5×),雄鸟RA核团呈卵圆形,轮廓清晰,与周围组织界限明显.雌鸟RA核团外形与雄鸟类似,轮廓界限较雄鸟略模糊.在高倍镜下(40×),可明显观察到密集交错的神经纤维和微细血管.
2.2吸附式记录模式下RA核团单个投射神经元自发放频率
在吸附式膜片钳记录模式下比较了RA核团投
射神经元自发放频率的性别差异(图1).雌鸟RA投射神经元的平均发放频率为(6.53±1.53)Hz(n=20),雄鸟RA投射神经元的平均发放频率为(11.63±0.32)Hz(n=27),雄鸟RA投射神经元自发放频率明显大于雌鸟(P<0.01).
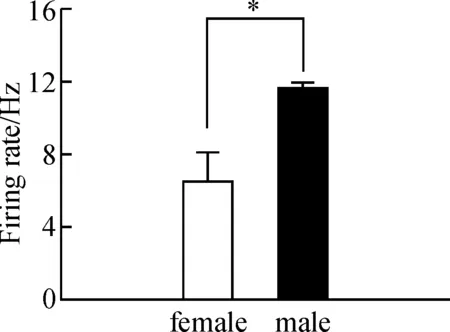
图1 成年雌雄斑胸草雀RA投射神经元自发放频率
Figure 1 The spontaneous firing rates of RA projection neurons in female and male zebra finches
2.3向RA投射神经元注入去极化电流引起动作电位发放频率的变化
在全细胞电流钳模式下,以神经元的静息电位为基础给予去极化阶跃电流刺激,根据去极化电流诱导的稳定反应,绘制随注入电流增加而诱发动作电位频率增加的F-I曲线图.比较雌鸟和雄鸟F-I曲线斜率,可以看出给予不同的去极化电流刺激,随着注入电流的增加,雄鸟RA投射神经元所诱发出动作电位的频率均明显高于雌鸟(图2).图2A和2C中雌鸟F-I曲线的斜率为(63.26±3.41)Hz/nA,雄鸟F-I曲线的斜率为(117.1± 1.04)Hz/nA.雄鸟F-I曲线的斜率显著大于雌鸟(P<0.05).图2B和2D中雌鸟F-I曲线的斜率为(75.95±7.16)Hz/nA,雄鸟F-I曲线的斜率为(122.52±5.91)Hz/nA.雄鸟F-I曲线的斜率显著大于雌鸟(P<0.05).
2.4向RA投射神经元注入去极化电流激发动作电位幅值的变化
对RA投射神经元分别注入不同强度的去极化电流,比较随去极化电流注入诱发RA投射神经元动作电位幅值的变化.对于不同强度的去极化电流,雄鸟RA神经元动作电位的幅值保持相对恒定,而雌鸟RA神经元对于强度过大的电流其动作电位的幅值会明显降低.而在不同强度去极化电流注入的情况下,雌鸟RA神经元所诱发动作电位的幅值均要显著大于雄鸟(图3).
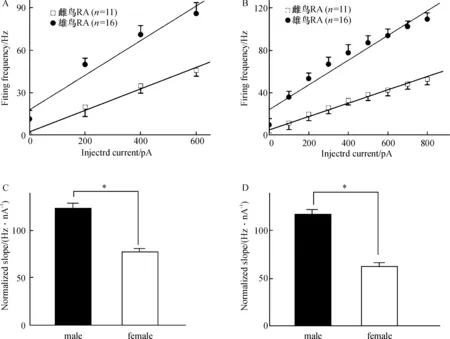
注:(A),(C):给予RA神经元去极化电流刺激,起始强度0 pA,脉冲时间1 600 ms,跃阶为200 pA,,连续4个刺激;(B),(D):给予RA神经元去极化电流刺激,起始强度0 pA,脉冲时间1 000 ms,跃阶为100 pA,连续9个刺激
图2 注入电流时成年雌雄斑胸草雀RA投射神经元发放频率
Figure 2 The firing frequency-injected current relationship of RA projection neurons between female and male zebra finches
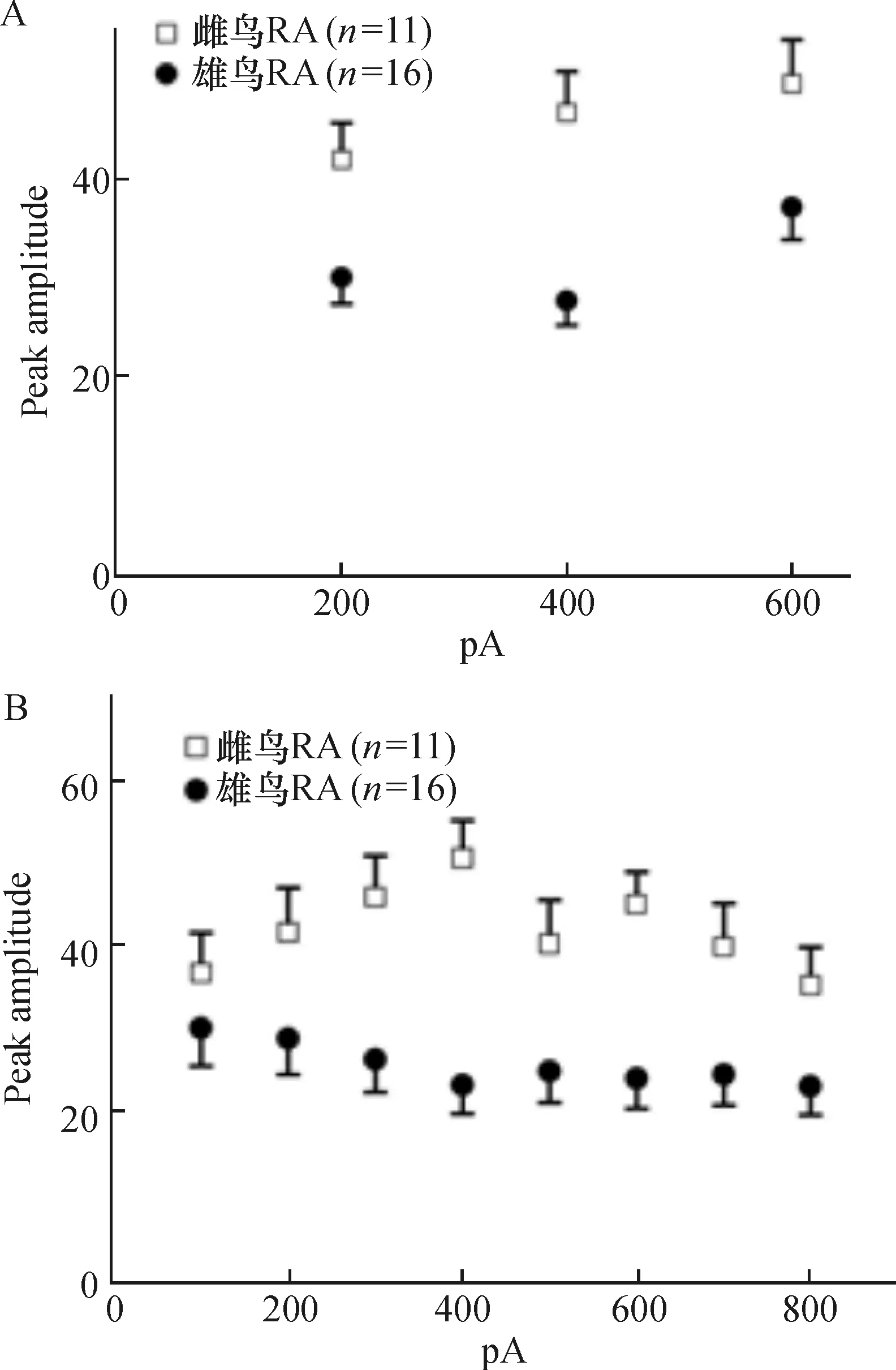
注:(A),(C):给予RA神经元去极化电流刺激,起始强度0 pA,脉冲时间1 600 ms,跃阶为200 pA,连续4个刺激;(B),(D):给予RA神经元去极化电流刺激,起始强度0 pA,脉冲时间1 000 ms,跃阶为100 pA,连续9个刺激.
图3 注入电流时雌雄成年斑胸草雀RA投射神经元动作电位幅值
Figure 3 The peak amplitude -injected current relationship of RA projection neurons between female and male zebra finches
3 讨论
3.1RA核团形态学的性别差异
鸣禽的鸣唱控制核团具有明显的性二态性,雄鸟的HVC,RA核团体积要明显大于雌鸟[5].雄鸟RA核团内神经元分布更稀疏,每一个神经元占据相对更大的位置,拥有着更多的突触连接,表明雄鸟RA神经元执行着更复杂的功能.这些结果提示,鸣禽鸣唱系统结构的性二态性与鸣禽鸣唱能力的性别差异具有很大关联.
3.2RA投射神经元自发放频率的性别差异
MEITZEN等[7]发现改变成年白冠雀光周期和体内睾酮的水平,RA投射神经元的电生理特性会发生改变.长日照会提高雄鸟体内睾酮水平,其RA投射神经元的胞体会增大,自发放频率,膜时间常数和膜电容都会上升.性激素影响神经元兴奋性在其他动物也有发现,雄珍蟾鱼的发声要远多于雌鱼,其运动神经元的发放频率也要高于雌鱼[8].LIU等[6]应用吸附式膜片钳技术证明成年斑胸草雀RA神经元自发放频率也具有明显的性别二态性,雄鸟RA神经元自发放频率明显高于雌鸟.雄鸟的鸣唱能力显著高于雌鸟,提示自发放频率的增加导致产生更多的动作电位,使神经元更好地响应突触输入.造成雌雄RA单个神经元自发放活动差异的原因可能与雌雄鸣禽体内及相关脑区内激素水平有关.
3.3注入电流引起RA投射神经元动作电位发放频率的性别差异
在细胞吸附式记录的基础上进一步破膜形成全细胞记录.全细胞记录可以获得整个细胞的功能变化信息.本实验中雄鸟RA投射神经元在吸附式电压钳和全细胞式电流钳下,均表现出稳定的自发放.而雌鸟只在吸附式电压钳下表现出较稳定的自发放,当形成全细胞式之后在电流钳下几乎记录不到自发放,表明雄鸟RA投射神经元的自发放比雌鸟更稳定和持久.
对RA投射神经元分别注入不同强度的去极化电流,均可以诱导出稳定的动作电位.将注入去极化电流期间动作电位发放的平均频率与注入电流强度作图,得到F-I曲线,该曲线反应了神经元对输入信号的反应.结果表明,无论注入强度较大或较小的去极化电流,雄鸟F-I曲线斜率都明显大于雌鸟,同时注入同样电流所诱发的动作电位频率,雄鸟也是显著高于雌鸟,说明雄鸟RA投射神经元对于电流刺激能引起更高频率的动作电位发放.
综上所述,无论是自发放还是注入去极化电流诱发动作电位,雄鸟RA投射神经元的发放频率均显著高于雌鸟,这一结果与雄鸟更善于鸣唱的行为相对应.造成这一现象的原因可能和鸣禽体内激素水平有关.
3.4注入电流引起RA投射神经元动作电位幅值的性别差异
对RA投射神经元分别注入去极化电流,均诱导出稳定的动作电位.对于不同强度的去极化电流,雄鸟动作电位的幅值保持相对恒定,而雌鸟对于强度过大的电流,其动作电位的幅值会明显降低.表明雄鸟RA投射神经元可以承受更大强度的电流刺激,这与雄鸟更擅长鸣唱的行为对应,提示雄鸟RA投射神经元可以接受更强的突触输入[6].比较注入电流诱发动作电位幅值可以发现存在明显的性别差异,雌鸟RA投射神经元诱发出动作电位的幅值明显高于雄鸟,即使在受到强度过大电流刺激而导致动作电位幅值下降时也要高于雄鸟,提示成年斑胸草雀RA投射神经元电生理特性在多个指标存在性别差异.
本实验结果,证明了成年斑胸草雀RA不仅在核团形态上存在明显的性别差异,在单个神经元水平自发放和诱发放频率,动作电位幅值等指标上也存在明显的性别差异.造成这些差异的原因可能和鸣禽体内激素水平有关,其具体机制尚有待进一步研究.
[1] MOONEY R. Neural mechanisms for learned birdsong [J]. Learn Mem, 2009, 16: 655-669.
[2] ANDALMAN A S, FEE M S. A basal ganglia-forebrain circuit in the songbird biases motor output to avoid vocal errors [J]. PNAS, 2009, 106(30): 12518-12523.
[3] SPIRO J E, DALVA M B, MOONEY R. Long-range inhibition within the zebra finch song nucleus RA can coordinate the firing of multiple projection neurons[J]. J Neurophysiol, 1999, 81: 3007-3020.
[4] MEITZEN J, PERKEL D J, BRENOWITZ E A. Seasonal changes in intrinsic electrophysiological activity of song control neurons in wild song sparrows [J]. J Comp Physiol A Neuroethol Sens Neural Behav Physiol, 2007, 193: 677- 683.
[5] KONISHI M, AKUTAGAWA E. Neuronal growth atrophy and death in a sexually dimorphic song nucleus in the zebra finch brain [J]. Nature, 1985, 315: 145-147.
[6] LIU X L, HOU G Q, LIAO S Q, et al. Sexual dimorphism of the electrophophysiological properties of the projection neurons in the robust nucleus of the arcopallium in adult zebra finches[J]. Neurosci Bull, 2010, 26(2):147-152.
[7] MEITZEN J, WEAVER A L, BRENOWITZ E A, et al. Plastic and stable electrophysiological properties of adult avian forebrain song-control neurons across changing breeding conditions [J]. J Neurosci, 2009, 29(20): 6558-6567.
[8] BASS A H, BAKER R. Sexual dimorphisms in the vocal control system of a teleost fish: Morphologyofphy siologically identified neurons [J]. J Neurobiol, 1990, 21: 1155- 1168.
Keywords: adult zebra finch; projection neuron of robust nucleus of the arcopallium (RA); electrophysiological properties; sexual dimorphism
SexualDimorphismoftheElectrophysiologicalPropertiesofProjectionNeuronsintheRobustNucleusoftheArcopalliuminAdultZebraFinches(Taeniopygiaguttata)
FAN Boqiang, HOU Guoqiang, PAN Xuan, LI Dongfeng*
(School of Life Science, South China Normal University, Guangzhou 510631, China)
Songbird is an ideal animal model for studying the mechanism of learning and memory of languages. The song system of zebra finches is highly sexually different. Uncover the mechanism underlying sexual-difference is important for the neural basis of birdsong. The role of single neuron on sexual-difference is rarely reported. Our current studies focus on RA single projection neurons. The active and passive electrophysiological properties were examined by cell attached patch or whole-cell patch recordings. We report here that the firing rate and peak amplitude of action potential in RA projection neurons in adult zebra finches are sexual dimorphism.
2011-06-24
国家自然科学基金项目(30970363;31172092)
*通讯作者, dfliswx@126.com
1000-5463(2012)01-0109-04
Q424
A
【责任编辑 成 文】
