PMA- LAMP方法检测灭菌乳中金黄色葡萄球菌的研究
2012-10-25胡惠秩满朝新董鑫悦刘珊珊薛玉清杨士芹谢鲲昊姜毓君
胡惠秩,满朝新,董鑫悦,刘珊珊,薛玉清,杨士芹,谢鲲昊,刘 颖,卢 雁,姜毓君,,*
(1.东北农业大学乳品科学教育部重点实验室,黑龙江哈尔滨 150030;
2.东北农业大学国家乳业工程技术研究中心,黑龙江哈尔滨 150030)
PMA- LAMP方法检测灭菌乳中金黄色葡萄球菌的研究
胡惠秩1,满朝新2,董鑫悦1,刘珊珊1,薛玉清1,杨士芹1,谢鲲昊1,刘 颖1,卢 雁2,姜毓君1,2,*
(1.东北农业大学乳品科学教育部重点实验室,黑龙江哈尔滨 150030;
2.东北农业大学国家乳业工程技术研究中心,黑龙江哈尔滨 150030)
近年来,金黄色葡萄球菌引起的食品安全事件频发,这就需要建立一种快速准确地检测食品中金黄色葡萄球菌的方法。传统方法检测食品中金黄色葡萄球菌活菌存在很多缺点。由于细胞死亡后其DNA依然能够存活许久,所以传统方法不能有效区分DNA来自死菌还是活菌。通过荧光染料PMA与快速检测技术LAMP相结合的方法快速、灵敏的检测灭菌乳中金黄色葡萄球菌,并对死/活菌进行区分。根据金黄色葡萄球菌nuc基因设计引物,并对LAMP反应体系及PMA-LAMP方法进行优化,同时优化了灭菌乳中提取DNA的方法。在纯培养的金黄色葡萄球菌中,PMA-LAMP方法检测灵敏度为3.2CFU/mL,PMA-PCR方法的检测灵敏度为3.2×102CFU/mL;对人工污染灭菌乳中的金黄色葡萄球,PMA-LAMP方法检测灵敏度为5×101CFU/mL,而PMA-PCR方法检测灵敏度为5×103CFU/mL。整个反应需要大约6h,说明PMA-LAMP方法检测灭菌乳中金黄色葡萄球菌特异性强、灵敏度高、时间短且操作简便,有望成为快速检测金黄色葡萄球菌活菌的新方法。
PMA-LAMP,金黄色葡萄球菌,乳,检测
金黄色葡萄球菌(Staphylococcus aureus)广泛分布于自然界中,食品受污染的机会很多,是引起食物中毒的主要致病菌之一,同时也是引起奶牛患乳房炎的重要病原菌。近年来,由金黄色葡萄球菌引起的食物中毒事件频发[1-2]。因此,建立一种快速、准确的检测方法对预防和控制金黄色葡萄球菌的感染具有重要意义。传统的金黄色葡萄球菌生物检测方法存在很大缺陷,检测时间较长。近年来,一些基因水平的检测方法,如PCR方法和RT-PCR方法[3-6],由于在检测病原菌方面快速、高灵敏度和高特异性等优点,已经显示出长远的发展前景。然而,由于这些检测方法灵敏度低,需要精密的仪器和特殊的试剂及检测扩增产物时方法复杂[7]。这些因素在一定程度上限制了传统核酸扩增方法在食品安全检测中的应用。环介导等温扩增技术(Loop-Mediated Isothermal Amplification,简称 LAMP)是日本学者Notomi等[8]在2000年研发的一种新型的核酸扩增技术。因其高效、特异、操作简便、快速等优点,目前已在食品安全检测、临床医学和生物学等领域中应用[9-11]。环境中细胞失去生存能力后,其DNA依然具有持续生存能力,则基于DNA的检测方法不能区分阳性信号是来自靶微生物中的活细菌还是死细菌,就可能导致对病原菌风险的过高估计或得出假阳性结果。在食品检测方面,基因水平的检测方法往往高估了样品中活菌的水平。叠氮溴化丙锭(PMA)和叠氮溴化乙锭(EMA)是两种对DNA具有高度亲和力的DNA荧光染料,不能透过完整的细胞膜(壁),只能选择性地通过不完整的死细胞[12-14]。用PMA和EMA处理后的样品暴露于可见光下,所带的光敏性稷氮基团转化为高活性的氮宾中间体,与死细胞DNA形成不可逆的共价键,致使DNA不能发生扩增反应;同时,那些留在溶液中没有与DNA分子进行交联的PMA和EMA在强光照射的同时与水分子反应生成没有活性的羟胺[15]。由于EMA具有细胞毒性并且不稳定,使其应用受到较大的限制。因此,建立一种以无细胞毒性的PMA与LAMP技术相结合,应用于牛乳中金黄色葡萄球菌活细胞的选择性检测方法有重要意义。

表1 实验所用菌株、来源及PMA-LAMP方法特异性的检测结果Table 1 Bacterial strains used in this study,their sources and results of PMA-LAMP assay
1 材料与方法
1.1 材料与仪器本研究所用标准实验菌株分别来自美国典型菌种保藏中心(ATCC)和中国医学微生物菌种保藏管理中心(CMCC),分离株由本实验室分离保存,详见表1。金黄色葡萄球菌ATCC13565作为检测灵敏度和优化实验的标准菌株,其他三株金黄色葡萄球菌(ATCC25923,CMCC26074,CMCC26075)和26株致病菌用来进行特异性检测。Bst DNA Polymerase
New England Biolabs公司;Taq DNA Polymerase、甜菜碱(betaine)、SYBR Green I Sigma公司;细菌基因组
DNA提取试剂盒 北京百泰克生物技术有限公司;PMA 美国Biotium公司;LAMP及PCR引物 上海英俊生物技术有限公司。

表2 金黄色葡萄球菌nuc基因扩增引物序列Table 2 Sequences of LAMP and PCR primers
1.2 培养条件
实验所用的金黄色葡萄球菌接种于20mL NB液体培养基中,摇床200r/min 37℃培养8h。其他菌种分别接种于20mL复合增菌培养基BPW中,按照每种细菌最适生长温度培养过夜,吸取1mL培养菌液,提取细菌基因组DNA。
1.3 实验方法
1.3.1 细菌基因组DNA及牛乳中DNA的提取 本研究采用试剂盒法快速提取基因组DNA。牛乳中DNA的提取主要为:样品中加入DNA提取液,在蛋白酶K及溶菌酶的作用下,37℃振荡3h。之后加入SDS,在55℃条件下水浴。离心之后将上清液转入新的离心管中,在沉淀中加入DNA提取液和SDS。在涡旋振荡器上振荡之后,合并所有的上清液,加入氯仿∶异戊醇进行离心,回收水相,弃掉上清液,加入TE缓冲液溶解DNA。
1.3.2 LAMP引物设计与合成及样品处理 根据nuc基因的6个特定的不同区域,利用LAMP引物设计软件PrimerExplorerV4设计4条引物:两条外引物F3和B3及两条内引物FIP和BIP。灵敏度对比实验,基于nuc基因序列,利用PrimerExpress V3.0软件设计,LAMP及PCR引物序列见表2,引物由上海英俊生物技术有限公司合成。PMA溶解于二甲亚砜(DMSO)中,配制成1mg/mL的PMA溶液,-20℃避光保存。取1mmL制备好的菌悬液置于1.5mL微量离心管中,加入3μL 1mg/mL的PMA溶液,使PMA的终质量浓度为3μg/mL;PMA与菌悬液混合均匀后在室温条件下避光培养5min,利用卤素灯曝光5min,光照交联时样品置于冰上(避免过热),交联后的悬浮液离心,所得沉淀用于DNA的提取。
1.3.3 反应体系 LAMP体系为50μL,由10× ThermoPoL Buffer 5μL、2.5mmol·L-1dNTP 8μL、100mmol·L-1MgSO44μL、40mmol·L-1FIP 2μL、40mmol·L-1BIP 2μL、10mmol·L-1F3 1μL、10mmol·L-1B3 1μL、10mmol·L-1甜菜碱6μL、8U·μL-1Bst DNA Polymerase 2μL、金黄色葡萄球菌基因组DNA模板2μL组成。PCR法反应体系为 50μL:10×PCR Buffer 5μL、引物为 Nuc-1、Nuc-2各 2μL、dNTP 5μL、Taq DNA Polymerase 2μL、金黄色葡萄球菌基因组DNA模板4μL,加ddH2O至50μL。
1.3.4 金黄色葡萄球菌热处理致死条件的优化 本研究选择热处理的方法致死菌体,按照1.2的方法培养金黄色葡萄球菌,取出后在无菌条件下移入离心管中,6000r/min离心15min收集菌体,再用灭菌的0.85%的生理盐水重新悬浮菌体,根据OD值调节菌液浓度达到5×108CFU/mL,分装为1mL,置于水浴锅中,95°C分别加热1、2、3、4、5min,然后迅速放置冰上,涂于固体平板上16h后观察是否有菌落生成,确定最佳致死时间。
1.3.5 曝光时间的优化 按照1.3.4方法中得到的最佳热致死时间,将制备好的1mL死菌悬液加入PMA使终浓度为5μg/mL,实验分为6组,一组不加PMA处理,另外五组加PMA处理。黑暗下孵育10min,然后用650W卤素灯照射曝光,曝光时间分别为1、3、5、7、10min,之后置于距离光源20cm处,以上操作均在冰上进行,防止温度过高。最后用LAMP对其模板DNA进行扩增,来确定最佳曝光时间。
1.3.6 孵育时间的优化 前期菌液制备同上,制备好的1mL死菌悬液加入PMA使终浓度为5μg/mL,实验分为6组,一组不加PMA处理,另外五组加PMA处理。参考文献,处理组黑暗下孵育时间分别选为3、4、5、8、10min,然后在650W卤素灯下曝光,样品置于距离光源20cm处,以上操作均在冰上进行,防止温度过高。最后用LAMP对其模板DNA进行扩增,来确定最佳曝光时间。
1.3.7 PMA浓度的优化 按照1.2的方法培养菌种,调整菌液浓度为5×108CFU/mL。按照1.3.4的方法致死菌体,分装活菌液和死菌液各1mL。活菌液中加入PMA使终浓度分别为0、1、3、5、10、20、50、100μg/ mL,按上述实验得到的最佳热致死时间、最佳曝光时间及孵育时间进行处理,将菌液涂于固体平板上进行平板计数。死菌液中加入PMA使终浓度为0、0.5、1、2、3、4、5、8、10μg/mL。避光孵育3min,曝光5min,提取菌体DNA进行LAMP实验以确定PMA对死菌的影响。以上操作均在冰上进行,防止温度过高。
2 结果与分析
2.1 金黄色葡萄球菌LAMP方法的建立
以金黄色葡萄球菌nuc基因为靶基因,设计4条引物,以试剂盒提取的金黄色葡萄球菌基因组DNA为模板,在Bst DNA Polymerase作用下LAMP扩增,61℃水浴作用60min,反应结束后目测观察扩增效果。实验结果见图1所示,琼脂糖凝胶电泳验证结果显示,阳性反应管中发生LAMP扩增反应,出现典型的LAMP扩增电泳条带,而阴性对照组未发生反应。

图1 LAMP方法的建立Fig.1 Establish the system of LAMP
2.2 PMA处理菌体条件的优化
从表3可知,当PMA浓度大于3μg/mL之后,对活菌的生长产生抑制;当浓度达到50μg/mL时,活菌大部分被抑制;当浓度达到100μg/mL时,活菌全部被杀死。这些说明PMA具有一定的杀菌作用,所以,样品在进行PMA处理时,不适合选取过高浓度,会对实验结果产生影响。当PMA浓度小于3μg/mL时处理死菌,有扩增条带出现,说明部分死菌的DNA没有与PMA结合,从而能够进行扩增。当PMA浓度增大到3μg/mL时,无扩增条带出现,说明此时PMA的浓度能充分与死菌结合,抑制其DNA扩增(由于篇幅限制,图表未列出)。所以,根据致死时间、孵育时间及曝光时间的优化实验结果,我们最后选择PMA处理的浓度为3μg/mL,最佳致死时间为5min,最佳孵育时间为3min,最佳曝光时间为5min。
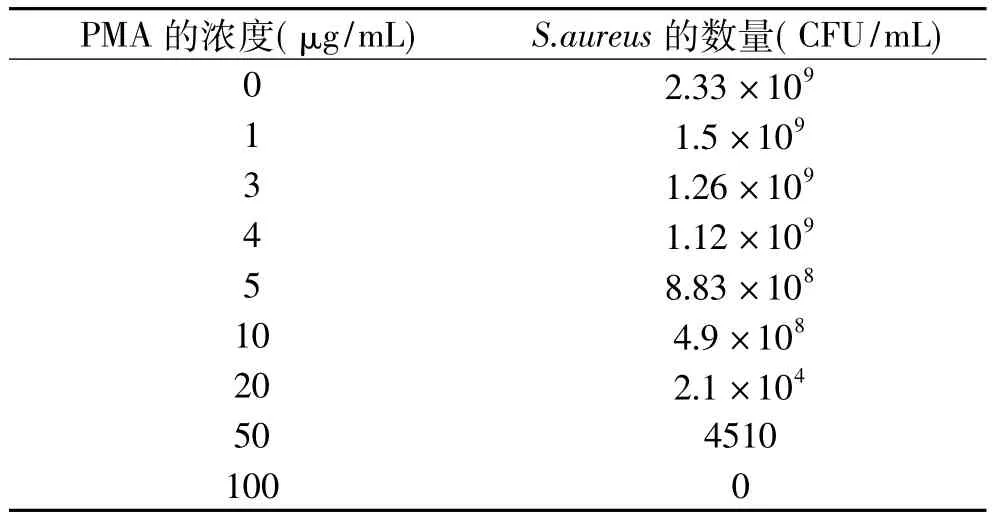
表3 PMA浓度对活菌的影响Table 3 Different PMA concentrations on the impact of viable Staphylococcus aureus
2.3 PMA-LAMP检测金黄色葡萄球菌方法的建立
从优化的结果中得到了完整的PMA处理菌体的反应条件,所以PMA-LAMP方法结合的体系基本建立,需进一步验证。分别取1mL浓度为5×108CFU/mL的金黄色葡萄球菌活菌液和死菌液,加入PMA至终浓度为3μg/mL,暗处放置3min,然后在距650W卤素灯20cm处曝光5min。整个过程都在冰上进行,以防止温度过高。同时分别取1mL未经PMA处理的活菌液和死菌液作为对照。将上述菌液用细菌基因组DNA提取试剂盒提取其 DNA,以此为模板进行LAMP反应。从图2中可以看出,泳道二至泳道四都有梯形条带产生,泳道五没有条带产生,说明泳道二至泳道四发生LAMP扩增。由此可知,3μg/mL浓度的PMA能够完全抑制5×108cfu/mL的死菌DNA的扩增,但不能抑制相同浓度的活菌DNA的扩增。经PMA处理的活菌与未经PMA处理的活菌的LAMP扩增结果一致。因此,PMA-LAMP方法能够有效地抑制死菌的扩增,使其只检测活菌,从而防止产生假阳性结果。

图2 PMA-LAMP方法的建立Fig.2 Establish the system of PMA-LAMP for detection Staphylococcus aureus
2.4 PMA-LAMP检测金黄色葡萄球菌的灵敏度
为了分析PMA-LAMP方法的检测灵敏度,取菌体浓度为3.2×108CFU/mL的菌液按1∶1的比例混合活菌和死菌,10倍梯度稀释,之后用PMA处理,分别提取其DNA后经LAMP扩增,1.5%琼脂糖凝胶电泳进行观察,结果见图3。为了与PMA-LAMP方法的灵敏度进行比较,取前述提取的DNA作为模板进行PCR反应,结果未显示,PMA-LAMP方法的灵敏度比PMA-PCR方法的灵敏度高100倍。
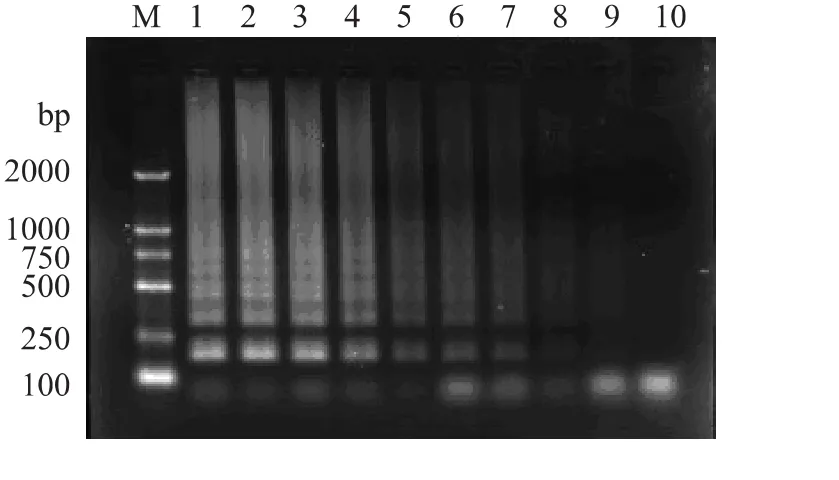
图3 PMA-LAMP方法的灵敏度Fig.3 PMA-LAMP detection sensitivity of Staphylococcus aureus
2.5 PMA-LAMP方法应用于灭菌乳中金黄色葡萄球菌的检测
本研究选择灭菌乳作为模拟实际受检样品,乳中没有金黄色葡萄球菌,符合污染条件,然后人工添加金黄色葡萄球菌于灭菌乳中,使乳中活菌浓度为5×107CFU/mL,十倍梯度稀释,用PMA进行处理之后,将上述1.3.1方法提取的DNA作为模板,进行LAMP反应,1.5%琼脂糖凝胶电泳观察结果如图4所示。该PMA-LAMP方法对灭菌乳中细菌样本经过108倍稀释后提取的DNA模板进行验证,仍能有效扩增,说明该方法对灭菌乳中金黄色葡萄球菌的检测灵敏度为5×101CFU/mL。为了与PMA-LAMP检测灭菌乳中金黄色葡萄球菌的灵敏度进行比较,本研究用上述的DNA作为模板进行PCR扩增反应,结果未显示,PMA-PCR检测灵敏度为5×103CFU/mL,比PMA-LAMP方法检测灵敏度低100倍,结果未显示。

图4 PMA-LAMP方法检测灭菌乳中金黄色葡萄球菌的灵敏度Fig.4 Agarose gel electrophoresis of detection limit of Staphylococcus aureus in Sterilized milk using PMA-LAMP reaction
2.6 PMA-LAMP检测灭菌乳中金黄色葡萄球菌的特异性
将4株金黄色葡萄球菌标准菌株ATCC13565、ATCC25923、CMCC26112、CMCC26074和其他26株常见致病菌,按照1.3.1方法进行处理得到DNA后,进行LAMP特异性检测,检测结果见表1所示:4株金黄色葡萄球菌全部检出,其他26株致病菌的检测全部呈阴性,说明PMA-LAMP检测方法具有良好的特异性。
3 结论
金黄色葡萄球菌在人类居住的环境中分布广泛,尤其是牛乳、肉、蛋类等食品中易受其污染。我国每年因金黄色葡萄球菌食物中毒事件也频频发生,人们生活受到严重影响[16]。本研究采用PMALAMP方法对金黄色葡萄球菌nuc基因进行检测,nuc基因编码的耐热核酸酶(Thermostable nuclease,Thermonuclease[TNase]),是一种细胞外酶,由致病性菌株产生。不仅为金黄色葡萄球菌所特有,而且在不同菌株之间具有较高的保守性[17-18],广泛用于金黄色葡萄球菌的检测[19-20]。全部检测时间大约是6h,包括从人工污染的灭菌乳中提取DNA 4h,PMA处理时间及LAMP反应时间大约1.5h,琼脂糖凝胶电泳检测时间0.5h;而用传统的PCR及荧光PCR方法进行检测至少需要一天的时间,并且设备投入高,不易推广使用。通过对30株常见致病菌进行PMALAMP扩增,所试的4株金黄色葡萄球菌均为阳性结果,说明PMA-LAMP方法具有高度特异性。同时,该方法具有较高的检测灵敏度,PMA-LAMP方法对纯培养的金黄色葡萄球菌检测灵敏度为3.2CFU/mL,PMA-PCR方法的检测灵敏度为3.2×102CFU/mL;对人工污染灭菌乳中的金黄色葡萄球菌PMA-LAMP方法检测灵敏度为5×101CFU/mL,而PMA-PCR方法检测灵敏度为5×103CFU/mL,PMA-LAMP方法的检测灵敏度比PMA-PCR方法高2个数量级。本研究同时优化了乳中提取 DNA的方法,在 Meiri-Bendeck[21]等人研究的基础上进行了改进,使得提取效果更显著,提取过程更省时。总之,本研究建立的金黄色葡萄球菌PMA-LAMP方法具有高度灵敏性和特异性,不需要使用精密昂贵的实验设备,操作简单,适合基层检验检疫机构推广使用。
[1]Olsen S J,DeBess E E,McGivern T E,et al.A nosocomial outbreak of fluoroquinolone-resistant Salmonella infection[J].The New England Journal of Medicine,2001,344(21):1572-1579.
[2]Jorgensen H J,Mork T,Hogasen H R,et al.EnterotoxigenicStaphylococcus aureusin bulk milk in Norway[J].Journal of Applied Microbiology,2005,99(1):158-166.
[3]Gabriela Martinez,Josee Harel,Marcelo Gottschalk.Specific detection by PCR of Streptococcus agalactiae in milk[J].The Canadian Journal of Veterinary Research,2001,65:68-72.
[4]Braketad O G,Aasbakk K,Maeland J A.Detection ofStaphylococcus aureusby polymerase chain reaction amplification of the nuc gene[J].Journal of Clinical Microbiology,1992,30 (7):1654-1660.
[5]Stratidis J,Bia F J,Edberg S C.Use of real-time polymerase chain reaction for identification of methicillin- resistantStaphlococcus aureusdirectly from positive blood culture bottles[J].Diagnostic Microbiology and Infectious Disease,2007,58 (2):199-202.
[6]Sabet N S,Subramaniam G,Navaratnam P.Detection of mecA and ermA genes and simultaneous identification ofStaphylococcus aureususing triplex real-time PCR from Malaysian S.aureus strain collections[J].International Journal of Antimicrobial Agents,2007,29(5):582-585.
[7]曾冰冰,肖凯军,石磊,等.LAMP方法在食品微生物检测中的应用[J].现代食品与药品杂志,2007,17(1):22-25.
[8]Notomi T,Okayama H,Masubuchi H,et al.Loop-mediated isothermal amplification of DNA[J].Nucleic Acids Res,2000,28 (12):E63.
[9]Boehme CC,Nabeta P,Henostroza G,et al.Operational feasibility of using loop-mediated isothermal amplification for diagnosis of pulmonary tuberculosis in microscopy centers of developing countries[J].J Clin Microbiol,2007,45:1936-1940.
[10]Iwamoto T,Sonobe T,Hayashi K.Loop-mediated isothermal amplification for direct detection of Mycobacterium tuberculosis complex,M.avium,and M.intracellulare in sputum samples[J].J Clin Microbiol,2003,41:2616-2622.
[11]Jayawardena S,Cheung CY,Barr I,et al.Loop-mediated isothermal amplification for influenza A(H5N1)virus[J].Emerg Infect Dis,2007,13:899-901.
[12]Nogva H K,Dromtorp S M,Nissen H,et al.Ethidiummonoazide for DNA-based differentiation of viable and dead bacteria by 5'-nuclease PCR[J].Bio Techniques,2003,34:804-813.
[13]Nocker A,Cheung C,Camper A.Comparison of propidium monoazide with ethidium monoazide for differentiation of live vs dead bacteria by selective removal of DNA from dead cells[J].Microbiol Meth,2006,67:310-320.
[14]Hein I,Schneeweiss W,Stanek C,et al.Ethidium monoazide and propidium monoazide for elimination of unspecific DNA background in quantitative universal real-time PCR[J].Microbiol Methods,2007,71:336-339.
[15]DeTraglia M C,Brand J S,Tometsko A M.Characterization of azidobenzamidines as photoaffinity labeling for trypsin[J].Biol Chem,1978,253:1846.
[16]Huang B,Deng Z A,Tan M X,et al.Contamination status,staphylococcal enterotoxin-producing property and drμg resistance ofStaphylococcus aureusisolated from food products[J].Chinese JournalofHealth Laboratory Technology,2009,19(6): 1380-1382.
[17]陈宁庆.实用生物毒素学[M].北京:中国科学技术出版社,2002.
[18]Madism B M,BaselskiV S.Rapid idetification ofStaphylococcus aureus[J].J Clin Microbiol,1983,18(3): 722-724.
[19]Lachica R V F,C Genigeorgis,P D Hoeprich.Metachromic agar-diffusion methods for detecting staphylococcal nuclease activity[J].J Appl Microbiol,1971,21:585-587.
[20]Odd G Brakstad,Kjetill Aasbakk,Johan A.Detection ofStaphylococcus aureusby polymerase chain reaction amplification of the nuc gene[J].Journal of Clinical Microbiology,1992(6): 1654-1660.
[21]Meiri-Bendeck I,Lipkin E,Friedmann A,et al.A PCR-based method for the detection of Streptococcus agalactiae in dariy[J].J Dairy Sci,2002,85:1717-1723.
Detecting of viableStaphylococcus aureusby loop-mediated isothermal amplification coupling with propidium monoazide in dairy products
HU Hui-zhi1,MAN Chao-xin2,DONG Xin-yue1,LIU Shan-shan1,XUE Yu-qing1,
YANG Shi-qin1,XIE Kun-hao1,LIU Ying1,LU Yan2,JIANG Yu-jun1,2,*
(1.Key Lab of Dairy Science,Ministry of Education,Northeast Agricultural University,Harbin 150030,China;
2.National Dairy Engineering Research Center,Northeast Agricultural University,Harbin 150030,China)
In recent years,the increasing number ofStaphylococcus aureusoutbreaks linked to food product highlighted the need to develop technique with rapid,simple and accurate.The conventional technologies for rapid and sensitive detection ofS.aureusviable cells in produce had several limitations.The signal from viable versus dead cells could not be distinguished due to the persistence of DNA after the cell death,resulting in overestimate the number of cells.In the present study,some problems had been solved by developing a new concept with DNA-intercalating dye propidium membrane(PMA)combining with loop-mediated isothermal amplification(LAMP).The test was used to analyseS.aureusand routine dairy products.a series of primers targeted six distinct sequences of nuc gene were designed,which was characteristic ofS.aureus.Also,the LAMP assay and the performance of PMA-LAMP for detecting viableS.aureuswere optimized.Moreover,they improved the method for extraction DNA from dairy samples.In pure culture,the detection limit of PMA-LAMP was 3.2CFU/mL,up to 100-fold more sensitive than PCR.In dariy products,PMA-LAMP assay could detect as less as 5×101CFU/mL compared to that of PCR-PMA was 5×103CFU/mL.The complete LAMP-PMA assay for took about 6h,demonstrating the method was rapid and convenient.In conclusion,PMA-LAMP offers a novel DNA-based detection method for distinction between viable and dead cells with wide application in food products.
PMA-LAMP;Staphylococcus aureu;dairy;detection
TS207.3
A
1002-0306(2012)21-0300-06
2012-03-16 *通讯联系人
胡惠秩(1985-),女,硕士,研究方向:食品微生物与生物技术。
国家科技支撑计划项目(2012BAK17B04)。
