海藻酸钠-壳聚糖固定化磷脂酶A2的研究
2012-10-25张佳宁宋云花邹小雨于殿宇
张佳宁,宋云花,王 玥,邹小雨,于殿宇
(东北农业大学食品学院,黑龙江哈尔滨 150030)
海藻酸钠-壳聚糖固定化磷脂酶A2的研究
张佳宁,宋云花,王 玥,邹小雨,于殿宇*
(东北农业大学食品学院,黑龙江哈尔滨 150030)
采用海藻酸钠-壳聚糖作为载体对磷脂酶A2进行固定,以固定化酶的活力回收率为指标,通过单因素实验和响应面分析对固定化条件进行优化,最优固定化条件为:海藻酸钠浓度2.0%,壳聚糖浓度2.0%,钙离子浓度0.25mol/L,戊二醛质量百分浓度0.3%,交联时间7h,此时固定化酶活力回收率达到74.8%;对固定化酶酶学性质进行研究,其最适温度为55℃,最适pH为5.0。该固定化酶重复使用7次后活力可以保持54%以上。扫描电子显微镜(SEM)结果也显示海藻酸钠-壳聚糖能较好的固定磷脂酶A2。
海藻酸钠-壳聚糖,磷脂酶A2,固定化,SEM
磷脂酶A2(PLA2)是一类能够在磷脂甘油部分的Sn-2位点选择性断裂酯键的酶[1],其可将磷脂水解成一系列生物活性介质[2];由于PLA2酶源来自猪胰腺,相对短缺,未推广开。最早将酶法脱胶用于工业生产的是德国Lurgi公司,国内也有不少相关报道,现今用于脱胶的酶主要是 Novo公司推出的Lecitase 10L、Lecitase Novo[3]和Lecitase Ultra。其中,猪胰脏来源的磷脂酶Lecitase 10L已不用于油脂脱胶,而被更具优势的微生物Rohalase MPL所代替[4]。酶的固定化是用一定的材料将活性酶束缚或限制于一定的区域内,但仍能进行酶所特有的催化反应,并可回收及重复使用的一种新技术[5]。它具有诸多优势,如:易于将固定化酶与底物、产物分开,方便后续的分离和纯化;对温度和pH适应范围增大;可以增加产物的收率;酶的使用效率高,使用成本低;适于产业化生产[6]等。目前,对于磷脂酶A2的固定化方法报道较少,Anders Falk Vikbjerg等曾采用大孔树脂对磷脂酶A2进行固定化[7],Juhan Kim等将磷脂酶A2固定于海藻酸盐-硅酸盐凝胶并将其应用于蛋黄溶血磷脂产品的生产[8],而将磷脂酶A2固定于海藻酸钠-壳聚糖载体未见报道。制备固定化酶的方法主要有吸附、包埋、共价键结合和交联法等,其中包埋法不需要化学修饰酶蛋白的氨基酸残基,具有反应条件温和、很少改变酶分子结构、酶活力损失小等优点[9]。海藻酸钠、壳聚糖是最为常见的包埋材料[10-11],因此可用其来作为固定化酶的载体。二价金属离子如Ca2+与可溶性海藻酸钠反应生成海藻酸钙微凝胶[12],而海藻酸钠、壳聚糖可与戊二醛基形成Schiff氏碱,在胶囊表面形成一层致密的保护膜,可增加微胶囊球的强度[13]。本实验以海藻酸钠-壳聚糖为包埋材料,戊二醛为交联剂,固定化PLA2,最终选择出最优的固定化条件。
1 材料与方法
1.1 材料与仪器
Rohalase MPL(实测酶活力:2500u/mL) 德国AB公司;无油磷脂 大庆日月星蛋白有限公司;海藻酸钠(脱乙酰度85%) 天津市光复精细化工研究所;壳聚糖 青岛利中甲壳质公司;戊二醛(50%)天津市耀华化学试剂有限责任公司;柠檬酸、磷酸氢二钠、氢氧化钠、碳酸氢钠、氯化钠、Tris试剂、盐酸、醋酸 化学纯,天津市科密欧化学试剂有限公司。
LGJ-1型冷冻干燥机 上海医用分析仪器厂; DF-101S集热式恒温加热磁力搅拌器 郑州金育科贸有限公司;PHS-3C型精密酸度计 上海大普仪器有限公司;恒温水浴锅 余姚市东方电工仪器厂。
1.2 实验方法
1.2.1 实验设计 对所选用的磷脂酶A2(Rohalase MPL)采用海藻酸钠-壳聚糖为基质进行固定,以海藻酸钠浓度、壳聚糖浓度、钙离子浓度、戊二醛质量百分浓度和交联时间为变量,以酶活回收率为指标,对固定化条件进行单因素实验,而后对其进行响应面优化实验;进而对固定化酶酶学性质进行研究,以期得到海藻酸钠-壳聚糖固定化磷脂酶A2的最优固定化条件。
1.2.2 固定化磷脂酶A2的方法 称取一定量的海藻酸钠在40℃水浴中保温溶解,同时称取一定量的壳聚糖在5%的醋酸溶液于40℃水浴中保温溶解,再向完全溶解的壳聚糖醋酸溶液中加入一定量的CaCl2溶液,充分混匀。用移液枪准确移取1mL稀释10倍的酶液于一定浓度的10mL海藻酸钠溶液中,搅拌均匀,静止一段时间后,用灭菌后的10mL注射器、约5滴/s的速度将其注入一定浓度的10mL壳聚糖醋酸-CaCl2混合溶液中,以转速180r/min搅拌,形成光滑的微胶囊球,再加入一定浓度戊二醛,同时快速搅拌,将其置于4℃环境固定化一定时间。将微胶囊以 pH8.0NaHCO3、0.1mol/L NaCl、0.1mol/L pH5.5 NaAc、pH8.0 Tris-HCl顺序洗涤后,进行冷冻干燥,备用[14]。
1.2.3 响应面法对固定磷脂酶A2方法的优化 通过单因素实验结果,采用Box-benhnken响应面设计,以壳聚糖浓度(A)、交联时间(B)和氯化钙浓度(C)为自变量,固定化酶酶活回收率(R1)为响应值设计响应面实验。自变量水平编码见表1。

表1 因素水平编码表Table 1 Code of factors and levels
1.2.4 游离酶和固定化酶活力的测定 取稀释十倍的磷脂酶3mL,加入27mL 0.35%卵磷脂悬液,在冰浴中混合均匀后分装于6支50mL的离心管中。三支放在冰浴中15min作为对照,同时另外三支在50℃水浴中保温15min后迅速放于冰浴中,均在冰浴条件下用4.0mmol/L的NaOH滴定,滴定终点以pH计测量的pH为7.0终止。记录空白组、实验组所消耗的NaOH的体积数V0、V(mL),换算成国际单位(U),1U为1min水解1μmol卵磷脂所需的酶量。
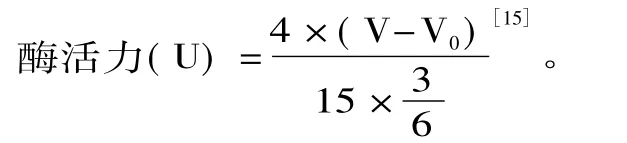
1.2.5 固定化酶活回收率的计算方法 酶活回收率(%)=固定化酶活力/固定化前游离酶的活力×100
2 结果与讨论
2.1 磷脂酶A2固定化条件的确定
2.1.1 壳聚糖浓度对固定化酶活力回收率的影响 取海藻酸钠浓度为2%,CaCl2溶液浓度为0.25mol/L,戊二醛质量百分浓度为0.3%,固定化时间为6.5h,壳聚糖浓度分别为 1.0%、1.5%、2.0%、2.5%、3.0%、3.5%,按1.2.2的方法对磷脂酶A2进行固定化,以酶活回收率为指标进行测定,测定结果见图1。

图1 壳聚糖浓度对磷脂酶固定化的影响Fig.1 Effect of chitosan concentration on activity of immobilized PLA2
如图1所示,当壳聚糖浓度大于2.0%时,固定化酶活力回收率开始下降。这是由于过大的壳聚糖浓度,使得微胶囊表面的聚电解质膜更加致密,造成底物扩散困难、固定化酶活力回收降低,而且壳聚糖浓度过高形成的胶囊不易洗涤分离。因此,壳聚糖浓度选择在2.0%。
2.1.2 海藻酸钠浓度对固定化酶活力回收率的影响取壳聚糖浓度为2%,CaCl2溶液浓度为0.25mol/L,戊二醛质量百分浓度为0.3%,海藻酸钠浓度分别为0.5%、1.0%、1.5%、2.0%、2.5%、3.0%,固定化时间为6.5h,按1.2.2的方法对磷脂酶A2进行固定化,以酶活回收率为指标进行测定,测定结果见图2。
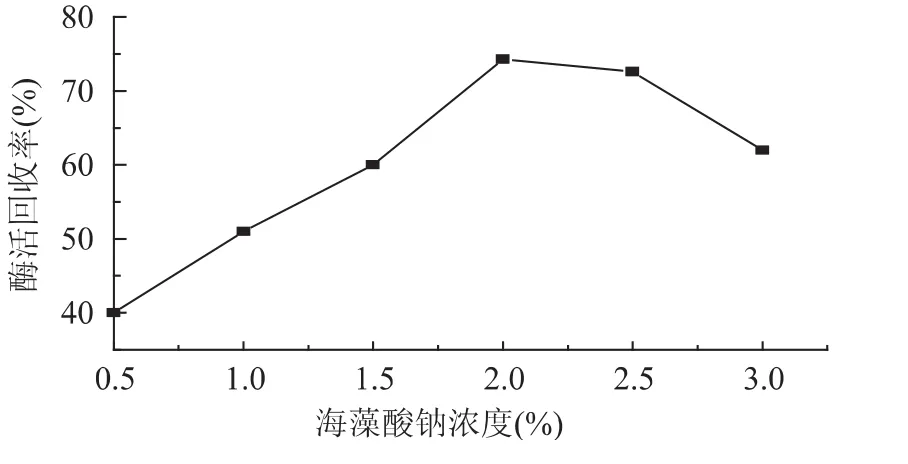
图2 海藻酸钠浓度对磷脂酶固定化的影响Fig.2 Effect of sodium alginate concentration on activity of immobilized PLA2
由图2可看出,海藻酸钠的浓度为2.0%时,酶活回收率最高。这是因为当海藻酸钠的浓度过大时,其黏性也就越大,所形成的小球有拖尾现象,且此时所形成的凝胶孔径较小,影响了酶与底物的结合;反之,若海藻酸钠浓度太小,所形成的小球呈扁球状,此时凝胶的孔径较大,固定化酶容易流失,所以酶活较低。因此,合适的海藻酸钠浓度成球难易适中,且易形成酶活较高、强度适中的小球。
2.1.3 钙离子浓度对固定化酶活力回收率的影响取壳聚糖、海藻酸钠浓度分别为2%,戊二醛质量百分浓度为0.3%,固定化时间为6.5h,氯化钙浓度分别为0.1、0.15、0.2、0.25、0.3、0.35mol/L,按1.2.2的方法对磷脂酶A2进行固定化,以酶活回收率为指标进行测定,测定结果见图3。
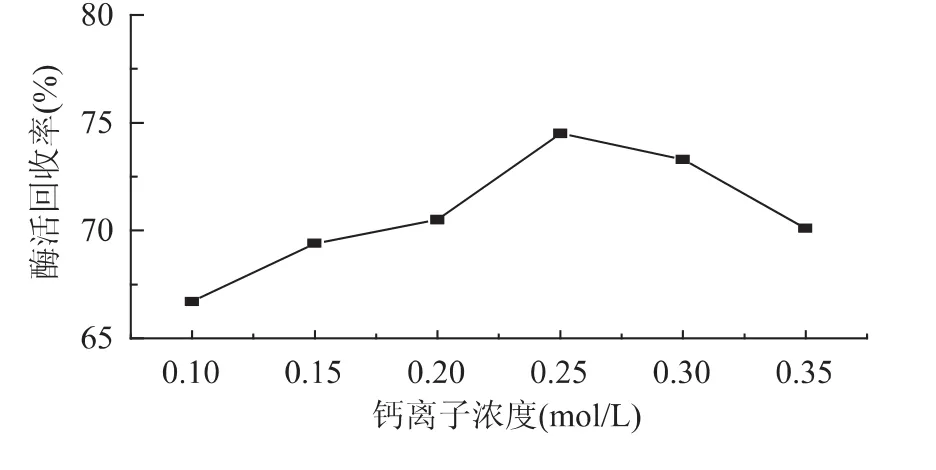
图3 钙离子浓度对磷脂酶固定化的影响Fig.3 Effect of calcium ion concentration on activity of immobilized PLA2
由图3可看出,氯化钙的浓度为0.25mol/L时,酶活回收率最高。这是因为当钙离子浓度较低时,所形成的凝胶强度较差,包埋不完全,包埋在内部的酶容易流失。而钙离子浓度较大时,过多的钙离子附着于凝胶表面,钙离子与酶作用,导致酶活力降低。
2.1.4 戊二醛质量百分浓度对固定化酶活力回收率的影响 取壳聚糖、海藻酸钠浓度分别为2%,氯化钙浓度为0.25mol/L,固定化时间为6.5h,戊二醛质量百分浓度分别为0.2%、0.25%、0.3%、0.35%、0.4%、0.45%,按1.2.2的方法对磷脂酶A2进行固定化,以酶活回收率为指标进行测定,测定结果见图4。

图4 戊二醛浓度对磷脂酶固定化的影响Fig.4 Effect of glutaraldehude concentration on activity of immobilized PLA2
由图4可看出,戊二醛的质量百分浓度为0.3%时,酶活回收率最高。这是因为戊二醛是一种双官能团试剂,可以和载体上的氨基进行Schiff反应,再与酶发生Schiff反应。从图4结果可知,当戊二醛浓度低于0.3%时,相对酶活随戊二醛浓度的增加而增大,此时,戊二醛、磷脂酶A2和海藻酸钠-壳聚糖发生了强烈的交联反应,随着戊二醛浓度的增大微胶囊的强度也逐渐增大;随着戊二醛浓度进一步增加,由于酶分子活性基团被戊二醛过多的修饰,酶活回收率也开始慢慢下降。因此,确定最适戊二醛质量百分浓度为0.3%。
2.1.5 交联时间对固定化酶活力回收率的影响 取壳聚糖、海藻酸钠浓度分别为2%,氯化钙浓度为0.25mol/L,固定化时间为6.5h,戊二醛质量百分浓度0.3%,交联时间分别为3.5、4.5、5.5、6.5、7.5、8.5h,按
1.2.2的方法对磷脂酶A2进行固定化,以酶活回收率为指标进行测定,测定结果见图5。
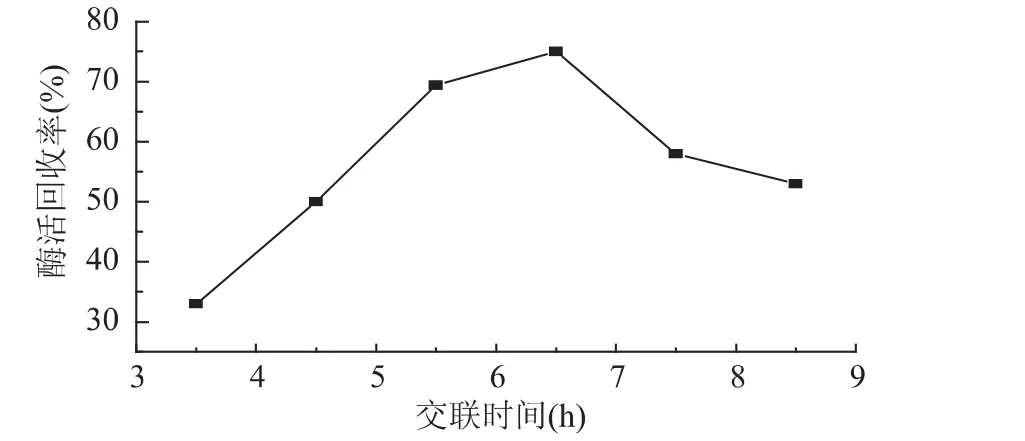
图5 交联时间对磷脂酶固定化的影响Fig.5 Effect of the time of cross-linking on PLA2immobilization
由图5可知,固定化开始时,由于海藻酸钠-壳聚糖包埋逐渐紧密,酶的流失减少,固定化酶的活力回收率呈升高趋势;6.5h时固定化酶活达到最大,再延长时间只会使Ca2+与酶作用,酶活降低,因此选用6.5h为最佳固定化时间。
2.1.6 磷脂酶A2固定化最佳条件的确定 通过单因素实验结果,采用Box-benhnken响应面设计,以壳聚糖浓度(A)、交联时间(B)和氯化钙浓度(C)为自变量,固定化酶酶活回收率(R1)为响应值设计响应面实验。实验设计方案及结果见表2。
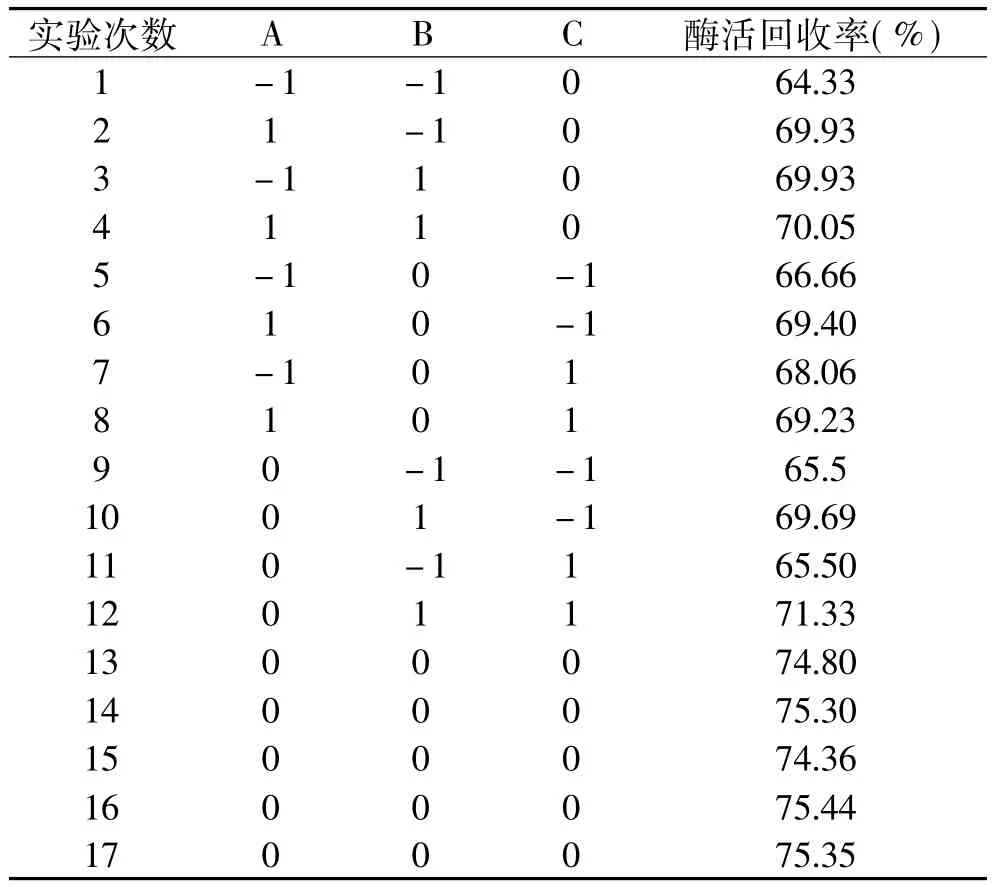
表2 响应面设计方案及实验结果Table 2 Design proposal and experiment result of response surface
利用Design Expert 8.0软件对实验结果进行方差分析,结果见表3(p值<0.05为显著项)。
通过对实验数据进行多元回归拟合,得到酶活回收率(R1)对壳聚糖浓度(A)、交联时间(B)和氯化钙浓度(C)的回归方程为:R1=75.05+1.2A+1.97B +0.36C-1.37AB-0.39AC+0.41BC-3.08A2-3.41B2-3.63C2。
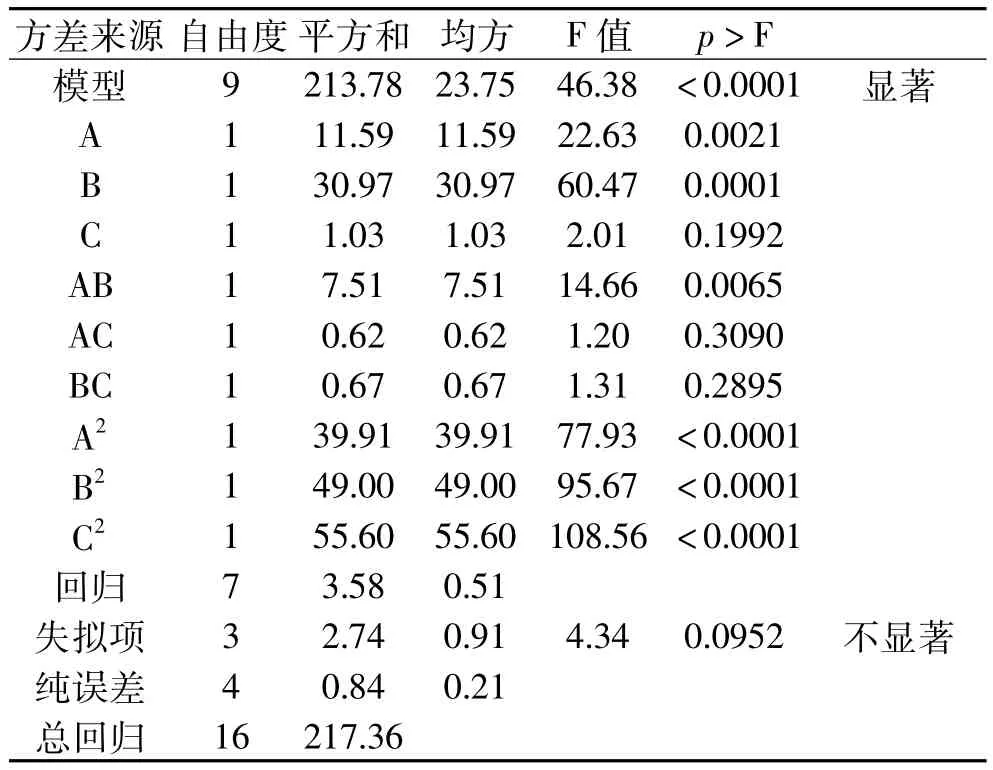
表3 方差分析结果Table 3 The test results of variance analysis
由表3可知,方程因变量与自变量之间的线性关系明显,该模型回归显著(p<0.0001)失拟项不显著(p>0.05),并且该模型 R2=98.35%,R= 96.23%,说明该模型与实验拟合良好。图6~图8分别给出了壳聚糖浓度、交联时间和氯化钙浓度的交互作用对固定化酶酶活回收率的响应曲面图。
由图6可以看出,酶活回收率的极值出现在实验范围内,在壳聚糖浓度为1.9%~2.1%,交联时间约为时6.5h,酶活回收率在74%以上。
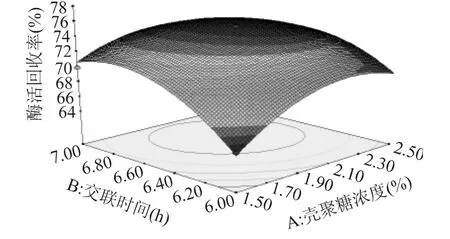
图6 壳聚糖浓度和交联时间对酶活回收率影响的响应面Fig.6 Influence of chitosan concentration and the time of cross-linking on the enzyme activity recovery
由图7可以看出,酶活回收率的极值出现在实验范围内,在壳聚糖浓度为1.9%~2.1%,钙离子浓度约为0.25mol/L时,酶活回收率在74%以上。
从图8看出,酶活回收率的极值出现在实验范围内,在交联时间为6.4~6.6h之间,钙离子浓度约为0.25mol/L时,酶活回收率在74%以上。
应用响应面优化分析方法对回归模型进行分析,寻找最优响应结果见表4。
为检验响应面方法所得结果的可靠性,按照表4整理值进行实验,得到的酶活回收率为74.8%。预测值与实验值之间的良好拟合性证实了模型的有效性。
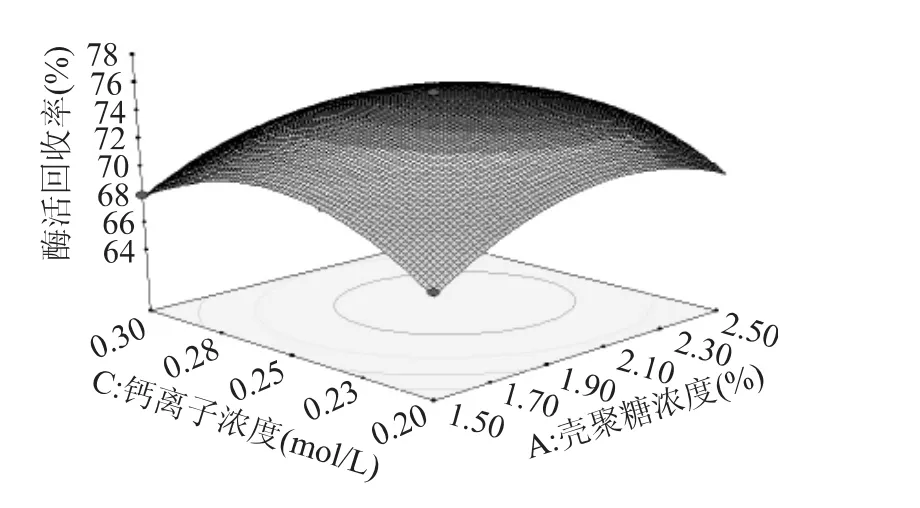
图7 钙离子浓度和壳聚糖浓度对酶活回收率的影响Fig.7 Influence of calcium ion and chitosan concentration on the enzyme activity recovery
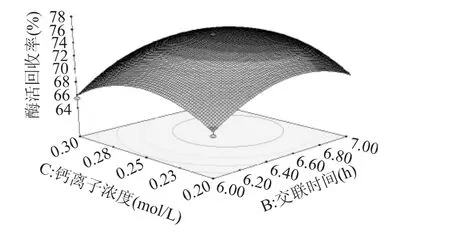
图8 钙离子浓度和交联时间对酶活回收率的影响Fig.8 Influence of calcium ion concentration and the time of cross-linking on the enzyme activity recovery
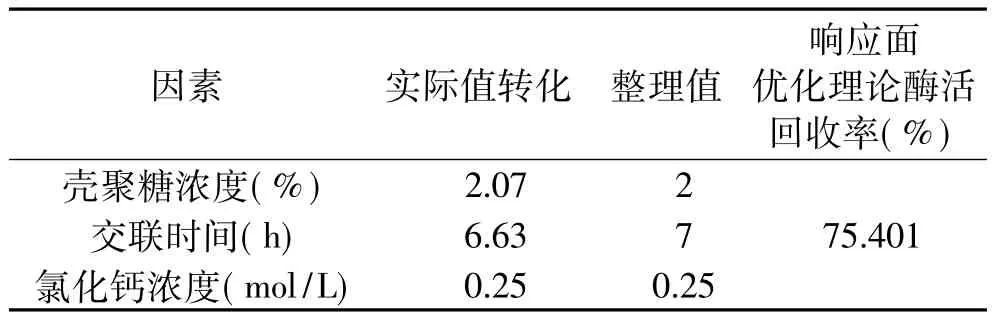
表4 响应面寻优结果Table 4 Results of response surface optimization
2.2 固定化酶的性质研究
2.2.1 固定化酶和游离酶的热稳定性比较 取一定量的固定化酶和游离酶,分别于35、40、45、50、55、60℃下测定游离酶和固定化酶酶活力,结果见图9。
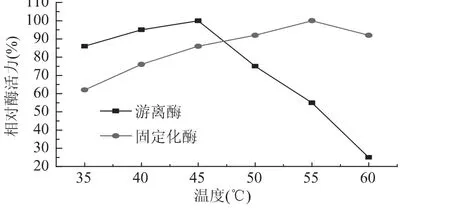
图9 温度对固定化酶相对酶活力的影响Fig.9 Effect of temperature on relative activity of immobilized lipase and free lipase
由图9可以看到,当温度在45℃时,游离酶达到最适温度,而固定化酶的最适温度为55℃,表明固定化后的酶耐热性有所提高,更加适应苛刻的条件。
2.2.2 pH对固定化酶和游离酶酶活力的影响 取一定量的固定化酶和游离酶,分别在pH为3.5、4.0、4.5、5.0、5.5、6.0条件下测定固定化酶和游离酶的活力,结果见图10。
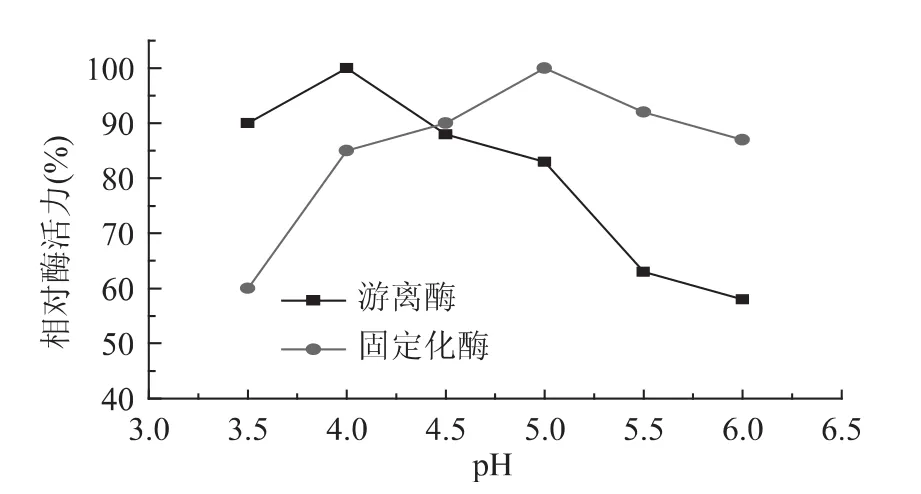
图10 pH对固定化酶相对酶活力的影响Fig.10 Effect of pH on relative activity of immobilized lipase and free lipase
由图10可以看到,当pH为4.0时,游离酶达到最适pH,而固定化酶的最适pH为5.0,表明固定化后酶的pH适应范围更加宽泛。
2.2.3 固定化酶的操作稳定性 游离酶无法从反应体系中分离,因此不能重复利用。而固定化酶则可以从反应体系中分离,可以重复使用。以5%粉末无油磷脂为底物,进行酶解反应,分别在相同条件下连续进行7批次操作,测定其酶活力。以第一批次样品测得活力为100%,实验结果如图11所示。
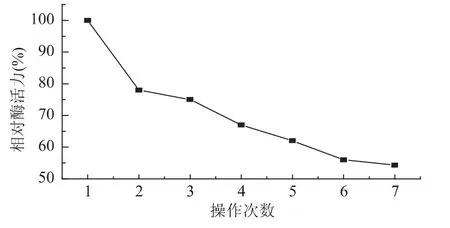
图11 重复使用次数对固定化酶相对酶活力的影响Fig.11 Effect of repeated use frequency on relative activity of immobilized lipase
由图11结果可知,重复7次以后,酶活力降为原来的54.3%,相对活力的下降可能是由于在不断搅拌的作用下,海藻酸钠-壳聚糖载体持水性发生变化,固定化酶凝胶结构的改变和酶的泄漏损失所造成的结果。
2.2.4 海藻酸钠-壳聚糖固定化磷脂酶A2微胶囊的SEM 图12中a、b分别为海藻酸钠-壳聚糖包埋的微胶囊冷冻干燥后颗粒的扫描电镜(SEM)图片。从图中可以看出,海藻酸钠-壳聚糖形成球形凝胶状结构,由于形成的球状结构较其他形状具有更大的表面积,因而保证了固定化酶在使用过程中可以充分的与物料接触,进而提高反应速率;此外,由于制作过程采用了冷冻干燥技术,使得固定化酶颗粒内部的水分直接由冰升华,内部形成了许多褶皱结构,这些褶皱可以有效地拦截、包埋磷脂酶A2,有效地提高了包埋效率,同时,减小底物和产物在微胶囊内部的扩散阻力,提高反应速度;此外,对固定化后的磷脂酶A2作出酶活力检测,可以确定出固定化的效果,进一步验证了海藻酸钠-壳聚糖能较好的固定化磷脂酶A2。

图12 SEM图像Fig.12 SEM images
3 结论
研究表明:以海藻酸钠-壳聚糖作为载体包埋磷脂酶A2的固定化方法,具有很好的固定化效果。得到了最佳的固定化条件为:海藻酸钠浓度为2.0%,壳聚糖浓度为2.0%,钙离子浓度为0.25mol/L,戊二醛质量百分浓度为0.3%,交联时间为7h。该固定化酶的最适温度为55℃,比游离酶升高了10℃;最适pH为5.0,与游离酶相比pH向碱性偏移1.0,固定化酶活力回收率为74.8%;经7次重复使用后,酶活力降为原来的54.3%,说明固定化酶的稳定性较好。
SEM结果显示:海藻酸钠-壳聚糖包埋的微胶囊内部形成了许多空隙结构,这些空隙可以有效地拦截、包埋脂酶A2,有效地提高了包埋效率,同时,在一定程度上增加了酶促反应的机会并提高反应的效率。
本文以海藻酸钠-壳聚糖为载体制备固定化磷脂酶A2,具有工艺简单、条件温和及操作简便的特点。通过实验可知,固定化酶的稳定性较好,制备的固定化酶可多次再生,重复使用7次,酶活力回收仍可达54%以上。
[1]Keiji Tabuchi,Zenya Ito,Shigeki Tsuji,et al.The contribution of phospholipase A2to the cochlear dysfunction induced by transient ischemia[J].Hearing Research,2000,144:1-7.
[2]Shigeru Kawai.Characterization of diacylglyceroloil mayonnaise emulsified using phospholipase A2-treated egg yolk[J].Characterization of Dag Oil Mayonnaise,2004,81(11):993-997.
[3]Kim C.Enzymatic oil-degumming by a novel microbial phospholipase[J].Eur J Lipid Sci Technol,2001,103:333-340.
[4]王瑛瑶,栾霞,魏翠平,等.酶技术在油脂加工业中的应用[J].中国油脂,2010,35(7):8-11.
[5]李彦峰,李军荣,伏莲娣.固定化酶的制备及应用[J].高分子通报,2001(2):13-23.
[6]尹志娜.固定化酶及其在食品和生物领域的研究进展[J].生命科学仪器,2009,7:11-15.
[7]Anders Falk Vikbjerg,Huiling Mu,Xuebing Xu.Synthesis of structured phospholipids by immobilized phospholipase A2catalyzed acidolysis[J].Journal of Biotechnology,2007,128: 545-554.
[8]Juhan Kim,Chang-Soo Lee,Jongmin Oha,et al.Production of egg yolk lysolecithin with immobilized phospholipase A2[J].Enzyme and Microbial Technology,2001,29(10):587-592.
[9]刘秀伟,司芳,郭林,等.酶固定化研究进展[J].化工技术经济,2003,21(4):12-16.
[10]WonKeehoon,Kim Sangbum,Kim Kwang-Je,et al.Optimization of lipase entrapment in Ca-alginate gel beads[J].Process Biochem-isty,2005,40:2149-2154.
[11]曾嘉,郑连英.壳聚糖微球固定化葡萄糖氧化酶的研究[J].食品工业科技,2002,23(1):29-31.
[12]王康,何志敏.海藻酸凝胶性质对蛋白质扩散的影响[J].化学工程,2004,32(5):53-56.
[13]王瑾,默馨,于殿宇,等.壳聚糖/海藻酸钠固定化β-葡萄糖苷酶的研究[J].食品工业科技,2009(3):164-167.
[14]孙万成,将笃孝,罗毅皓.壳聚糖/海藻酸钠微胶囊固定化磷脂酶 A1及其结构考察[J].食品科学,2005,26(9): 100-103.
[15]吴伟,李维琳,喻子牛,等.大豆卵磷脂的酶法改性研究[J].中国粮油学报,2005,20(6):71-75.
Study on phospholipase A2immobilized by sodium alginate-chitosan
ZHANG Jia-ning,SONG Yun-hua,WANG Yue,ZOU Xiao-yu,YU Dian-yu*
(Food Science College,Northeast Agriculture University,Harbin 150030,China)
The phospholipase A2was immobilized on the sodium alginate-chitosan supporter.The single-factor tests of immobilized condition were made through investigating the ratio of enzyme activity recovery,and then the results were selected by the response surface methodology.The optimal condition of the immobilized:the concentration of sodium alginate and chitosan were both 2.0%,calcium ion concentration was 0.25mol/L,glutaraldehude concentration was 0.3%,the time of cross-linking was 7h,with these conditions,the ratio of immobilized enzyme activity recovery was 74.8%.The immobilized PLA2characterization:the optimal temperature for the immobilized PLA2was 55℃,the optimal pH was 5.0,and after seven times repeated reaction,the relative activity of immobilizaed phospholipase was greater than 54%.The result of SEM images showed that sodium alginate-chitosan supporter could better immobilized PLA2.
sodium alginate-chitosan;phospholipase A2;immobilized;SEM
TS221
B
1002-0306(2012)21-0201-06
2012-04-24 *通讯联系人
张佳宁(1988-),女,在读硕士,研究方向:粮食油脂及植物蛋白。
农业科技成果转化资金项目(2010GB2B200134);国家十二五科技支撑计划项目(2011BAD02B01)。
