一种代谢芦荟苷的微生物筛选及其酶学性质初步研究
2012-10-25牛艳丰寇正福刘坐镇许建和江邦和
牛艳丰,寇正福,刘坐镇,,许建和,江邦和
(1.华东理工大学,上海200237;2.上海华震科技有限公司,上海 200237)
一种代谢芦荟苷的微生物筛选及其酶学性质初步研究
牛艳丰1,寇正福1,刘坐镇1,2,许建和1,江邦和2
(1.华东理工大学,上海200237;2.上海华震科技有限公司,上海 200237)
通过基因工程手段筛选到代谢芦荟苷的菌种——大肠杆菌(E.coliBL21(DE3),PET28(a))(ECUST0416,CGMCC NO.6114),发酵产生的酶液能够水解芦荟苷为芦荟大黄素。30℃、250r/min条件下发酵11h,产酶量可以达到148U/L发酵液。初步研究了酶液在不同温度、pH、底物浓度、PBS浓度、NaCl浓度、反应时间下的活性,从而确定酶活测定的最佳条件为:30℃、pH7.5、5mL粗酶液与5mL 40mmol/L PBS(pH7.5)混合组成反应体系、底物浓度3mg/mL、Nacl 0.6%、反应时间为20min。酶反应产物经高效液相检测,纯度为98.5%,酶催化反应转化率为73%。质谱和核磁共振图谱结果表明,酶解产物为芦荟大黄素。
芦荟苷,芦荟大黄素,优化,酶学性质
芦荟大黄素(aloe-emodin),又称芦荟泻素,化学名称为1,8-二羟基-3-羟甲基蒽醌,是重要的蒽醌类物质,主要存在于芦荟叶表层中,具有抗肿瘤、抗菌、抗病毒、抗氧化等一系列生物活性,在医药、保健食品、化妆品、日用洗涤用品行业上被广泛应用[1]。目前有关文献资料报道中,化学合成制备芦荟大黄素最常见的方法是以芦荟苷为起始原料,经过水解氧化反应得到芦荟大黄素。目前,利用芦荟苷(aloin)制备芦荟大黄素的方法有铁盐催化酸解法[2]、高温氧化法[3]、过硫酸盐氧化法[4]等化学方法。以上几种方法要用强酸或高温或者通入氧气,需要特殊设备或者加入大量的金属盐,反应条件不温和,对反应设备要求较高,而且能耗也相对较高。本文利用微生物产生的酶作为催化剂,采用生物转化芦荟苷制备芦荟大黄素,具有反应条件温和、不需要特殊设备、能耗低、对环境友好等特点,是一种新型的生物合成方法。

图1 芦荟苷和芦荟大黄素的结构Fig.1 The structure of aloin and aloe-emodin
1 材料与方法
1.1 材料与仪器
菌种 带有卡那抗性的大肠杆菌E.coliBL21 (DE3),购自上海睿星生物技术有限公司;筛选培养基 蛋白胨1%,NaCl 0.5%,琼脂2%,用1mol/L NaOH调节pH至7.5,121℃灭菌20min,灭菌后待到55℃左右,加入0.4%芦荟苷和15μg/mL卡那霉素,摇匀后倒平板;平板培养基、种子培养基和发酵培养基 均为 LB培养基(KanR,灭菌冷却后添加15μg/mL卡那霉素);K2HPO4·3H2O、KH2PO4、NaCl、酵母膏、蛋白胨等 北京益利精细化学品有限公司,分析纯;芦荟苷标准品(≥95%)、芦荟大黄素标准品(≥98%) 西安天丰生物科技有限公司。
Agilent 1200高效液相色谱 美国安捷伦科技有限公司;万分之一电子天平 梅特勒-托利多仪器有限公司;PHS-3B pH计 上海精密科学仪器有限公司;KYC-100B恒温摇床 上海福玛实验设备有限公司;SPX-150B-Z生化培养箱 上海博迅实业有限公司;LS-30立式压力蒸汽灭菌器 上海博迅实业有限公司;SWCJ-2D超净工作台 苏州净化设备有限公司。
1.2 实验方法
1.2.1 菌种筛选 将vector pet28a(NcoI&EcoRI)载体转入E.coliBL21(DE3)菌株,得到带卡那抗性的大肠杆菌(E.coliBL21(DE3)、PET28(a))。将该菌接种到筛选培养基上,37℃培养24h,再从平板中挑取单菌落培养。重复60个周期,得到能够代谢芦荟苷制备芦荟大黄素的E.coli(BL21(DE3)、PET28(a)) (ECUST0416,CGMCC NO.6114)菌株。
1.2.2 发酵方法
1.2.2.1 菌种活化 将菌株用接种针划线接种于平板培养基,37℃培养24h。
1.2.2.2 种子培养 从平板上挑取菌落接种于种子培养基(250mL瓶装液50mL),37℃、250r/min振荡培养4h(至OD600在0.6~1.0之间),4℃静置过夜。
1.2.2.3 发酵培养 按4%接种量将种子液接种于发酵培养基(250mL瓶装液50mL),于30℃、250r/min振荡培养11h。
1.2.3 粗酶液制备 发酵终止后,将发酵液(含菌体)经4℃、12000r/min,离心15min,弃沉淀,上清液即为酶液。
1.2.4 酶反应条件研究
1.2.4.1 最适温度 将30mg芦荟苷,5mL酶液,5mL PBS(40mmol/L,pH7.5,1.2%NaCl)加入到50mL三角瓶中,分别在20、25、30、35、40、50、60℃条件下,210r/min振荡反应20min,反应结束后测定酶活,以酶活力最大值为100%表示。
1.2.4.2 最适pH 分别将30mg芦荟苷,5mL酶液,5mL pH不同的PBS(40mmol/L,pH4、5、6、7、7.5、8、9、10,1.2%NaCl)加入到50mL三角瓶中,在30℃、210r/min振荡反应20min,反应结束后测定酶活,以酶活力最大值为100%表示。
1.2.4.3 最适底物浓度 考察了相对酶活力与芦荟苷浓度的关系,分别将0.5、10、20、30、50、75mg芦荟苷,5mL酶液,5mL PBS(40mmol/L,pH7.5,1.2% NaCl)加入到50mL三角瓶中,分别在30℃、210r/min振荡反应20min,反应结束后测定酶活,以酶活力最大值为100%表示。
1.2.4.4 最适PBS浓度 分别将30mg芦荟苷,5mL酶液,5mL各种浓度 PBS(0、20、40、80、120、160、200mmol/L,pH7.5,1.2%NaCl)加入到50mL三角瓶中,分别在30℃、210r/min振荡反应20min,反应结束后测定酶活,以酶活力最大值为100%表示。
1.2.4.5 最佳NaCl浓度 分别将30mg芦荟苷,5mL酶液,5mL PBS(40mmol/L,pH7.5,0.2、0.4、0.6、0.8、1.0、1.5%NaCl)加入到50mL三角瓶中,分别在30℃、210r/min振荡反应20min,反应结束后测定酶活,以酶活力最大值为100%表示。
1.2.4.6 最佳反应时间 分别将30mg芦荟苷,5mL酶液,5mL PBS(40mmol/L,pH7.5,1.2%NaCl)加入到50mL三角瓶中,分别在30℃、210r/min振荡反应1/3、1/2、1、2、3、5、6、8、9、10h,反应结束后测定酶活,以酶活力最大值为100%表示。
1.2.5 酶活测定方法
1.2.5.1 酶活单位(U) 在30℃、pH7.5条件下,每小时每升反应体系酶水解芦荟苷产生的芦荟大黄素微摩尔数定义为一个酶活单位。
1.2.5.2 测定方法 将5mL酶液、5mL磷酸缓冲液(PBS)(40mmol/L,pH7.5,1.2%NaCl)、30mg芦荟苷,加入到50mL三角瓶中,30℃、210r/min振荡反应20min,HPLC测定反应液中芦荟大黄素的含量。
1.2.5.3 液相色谱(HPLC)检测条件[5]色谱柱: Eclipse XDB-C18柱(4.6mm×250mm,5μm);检测波长:254nm;流动相:甲醇∶水溶液(80∶20,V∶V);流速: 0.8mL/min;柱温:室温。
1.2.6 酶解产物鉴定
1.2.6.1 酶促反应制备芦荟大黄素 将300mg芦荟苷,50mL酶液,50mL磷酸缓冲液(40mmol/L,pH7.5,1.2%NaCl)加入到500mL三角瓶中,30℃、210r/min振荡反应8h。用200mL甲苯萃取、分液,重复操作3次,合并萃取液。于60℃真空浓缩至30mL左右。待冷却至室温后放置冰箱,在4℃下保持 1h,再在-10℃下保持2h。抽滤,洗涤两次,60℃真空干燥。HPLC测定结晶中芦荟大黄素的含量,计算酶反应转化率。酶反应产物进行质谱和核磁共振检测。
酶促反应转化率(%)=酶解生成芦荟大黄素的摩尔数/酶解前加入芦荟苷的摩尔数×100
1.2.6.2 质谱条件 电子轰击(ESI)离子源;喷雾电压4.5kV;毛细管温度200℃;毛细管电压45V;鞘气(N2)流速40个单位;流动相:甲醇∶0.01mol/L乙酸铵水溶液(50∶50,V∶V);流速:0.20mL/min;负离子一级质谱全扫描。
1.2.6.3 核磁共振条件 在Varina XL 400(400MHz)超导核磁共振仪上进行。以DMSO-d为溶剂,工作频率为400.13MHz。
2 结果与讨论
2.1 菌种的筛选和培养筛选出的带卡那抗性的大肠杆菌E.coliBL21
(DE3),在培养时筛选培养基变为棕红色,液体培养基变成黑红色。该大肠杆菌在30℃、210r/min条件下培养11h,产酶量可以达到148U/L发酵液。
2.2 酶反应条件研究
2.2.1 最适反应温度 不同温度对该酶促反应的影响如图2所示。从图2中可以看出,酶活力先是随温度的升高而升高,当温度为30℃时达到最大,而后随着温度的升高逐渐下降。因此,反应的最适温度为30℃,过高的温度会使酶不可逆失活。
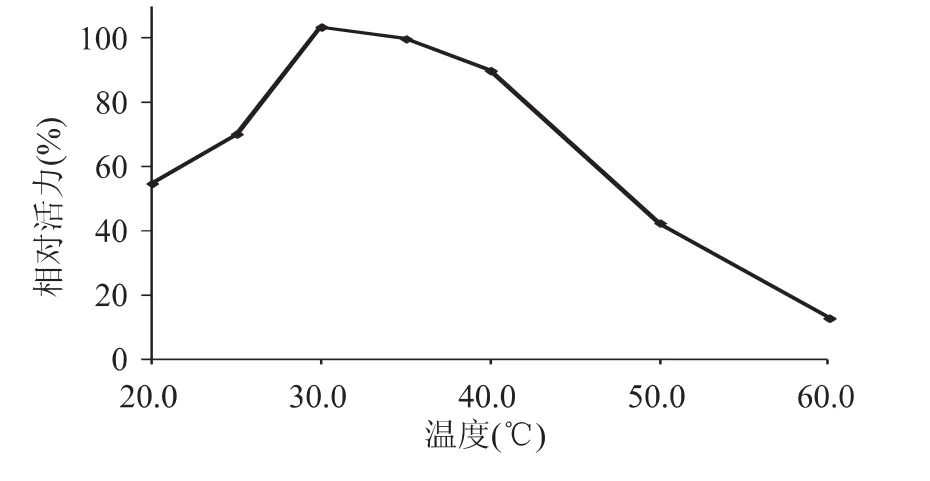
图2 温度对酶活力的影响Fig.2 Effect of temperature on enzyme activity
2.2.2 最适pH 不同pH对酶活影响如图3所示。由图3中可以看出,pH在4~6之间酶活上升缓慢,介于6与7.5之间时,酶相对活力急剧上升,而在pH大于7.5时,酶相对活力急剧下降。因此,该酶促反应对pH极其敏感,最适pH为7.5。

图3 pH对酶活的影响Fig.3 Effect of pH on enzyme activity
2.2.3 底物浓度对酶活的影响 结果如图4所示。从图4中可以看出,酶活力随底物浓度的增加而增加,当底物浓度超过3mg/mL时,酶活力趋于稳定。可见该酶促反应最适底物浓度为3~8mg/mL,选取3mg/mL为最适底物浓度。
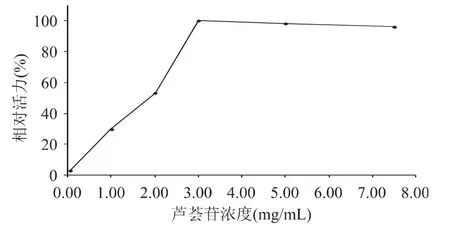
图4 芦荟苷浓度对酶促反应的影响Fig.4 Effect of aloe concentration on enzyme activity
2.2.4 磷酸盐缓冲液(PBS)浓度对酶活的影响 不同浓度的PBS对酶活的影响如图5所示。从图5中可以看出,酶活力随PBS浓度的增加而增加,当PBS浓度为40mmol/L时,酶相对活力最高,而后,随着PBS浓度增大,酶活力下降。因此,最佳PBS浓度为40mmol/L。
2.2.5 NaCl浓度对酶活的影响 结果如图6所示。从图6中可以看出,酶活力随NaCl浓度的增加而增加,当NaCl终浓度为0.6%时,酶相对活力最高,随后,随着NaCl浓度增大,酶活力下降。故NaCl最佳终浓度为0.6%。

图5 磷酸盐缓冲液(PBS)对酶活的影响Fig.5 Effect of phosphate buffer on enzyme activity

图6 NaCl浓度对酶活的影响Fig.6 Effect of sodium chloride on enzyme activity
2.2.6 反应时间 酶促反应随反应时间的变化如图7所示。从图中可以看出,在20~60min内,酶相对活力急剧下降,芦荟大黄素含量不断上升。1~10h内酶活下降速度减慢,芦荟大黄素的含量持续积累。在8~10h内,芦荟大黄素含量基本保持不变。因此,测定酶活的最佳反应时间为20min,使用酶活制备芦荟大黄素最佳反应时间为8h。

图7 酶活与芦荟大黄素总量随反应时间的变化Fig.7 Effect of reaction time on enzyme activity and aloe-emodin production
2.3 酶解产物鉴定
产物经HPLC检测,纯度为98.5%,酶催化反应转化率为73%。产物进行负离子一级质谱全扫描,质谱图如图8所示,显示产物分子量为270,与文献[5-6]报道的芦荟大黄素的分子量一致。产物核磁共振图谱如图9所示,图谱数据与文献[7]报道的芦荟大黄素的结构一致。由此确定产物为芦荟大黄素。
3 结论
本文筛选得到水解芦荟苷为芦荟大黄素的菌株,并对酶学性质进行了初步研究,为芦荟大黄素的制备提供了一种新型方法。

图8 酶解产物质谱分析图Fig.8 Mass spectrum of the enzymatic-biotransformated product

图9 酶解产物的核磁共振图谱Fig.9 Nuclear magnetic resonance the enzymatic-biotransformated product
以芦荟苷为唯一碳源,结合基因工程技术筛选出了代谢芦荟苷的菌种——大肠杆菌(E.coliBL21 (DE3),PET28(a)),在培养时可以使筛选培养基变为棕红色,使液体培养基变成黑红色。发酵产生的酶液能够水解芦荟苷为芦荟大黄素,产酶量可以达到148U/L发酵液。
初步研究了酶液在不同温度、pH、底物浓度、PBS浓度、NaCl浓度、反应时间下的活性,从而确定酶活测定的最佳条件为:30℃、pH7.5、5mL粗酶液和5mL 40mmol/L PBS(pH7.5)混合组成反应体系、底物浓度3mg/mL、NaCl 0.6%、反应时间为20min。酶反应产物经高效液相检测,纯度为98.5%,酶催化反应转化率为73%。质谱图和核磁共振图谱结果表明,酶解产物为芦荟大黄素。
[1]Choi J S,Lee S K,Sung C K,et al.Phytochemical study on aloe vera[J].Archives of Pharmacal Research,1996,19(2): 163-167.
[2]张仰明,周电根,王文捷,等.两步氧化法制备双醋瑞因的新工艺[P].中国:CN101104583,2008-01-16.
[3]Carlino S,Di N G.Process For Preparing Aloe-Emodin[P].US:2008/0125611(A1),2008-05-29.
[4]苏为科,朱兴一,张志敏.一种芦荟大黄素的制备方法:中国,CN101508637[P].2009-08-19.
[5]MA X H,SHEN S,HAN F M,et al.The electrospray ionization-mass spectra ofRadix et rhizomarhei anthraquinones[J].Journal of Hubei University(Natural Science),2006,28(4): 403-406.
[6]Fuh M R S,Lin H J.Analysis of rhubarb by liquid chromatography-electrospray-mass spectrometry[J].Tamkang Journal of Science and Engineering,2003,6(1):31-36.
[7]VittoriN,Collins,M.Production ofrhein and rhein derivatives:US,5652265[P].1997-07-29.
Microbiological screening for aloin metabolism and preliminary study of its enzymatic properties
NIU Yan-feng1,KOU Zheng-fu1,LIU Zuo-zhen1,2,XU Jian-he1,JIANG Bang-he2
(1.East China University of Science and Technology,Shanghai 200237,China;
2.Shanghai Huazhen Sci.&Tech.Co.,Ltd.,Shanghai 200237,China)
AE.coli(BL21(DE3),PET28(a))(ECUST0416,CGMCC NO.6114)was obtained by Genetic Engineering Technology as the target bacteria which produced protease converting aloin into aloe-emodin.148U of protease in 1L fermented culture medium could be achieved under the fermentation conditions as 30℃,250r/min for 11h.The enzymatic activity was studied and the best activity determination method was:5mL crude enzyme,5mL 40mmol/L Phosphate Buffer(pH7.5),Snbstrate concentration 3mg/mL,NaCl 0.6%,reaction at 30℃ and pH7.5 for 20min.The enzymatic biotransformed product was determined by HPLC with a purity of 98.5%and identified as aloe-emodin by MS and NMR.
aloin;aloe-emodin;optimize;enzyme properties
Q939.97
A
1002-0306(2012)21-0184-04
2012-04-05
牛艳丰(1985-),男,硕士,研究方向:生物化工工艺优化。
