邻苯二甲醛荧光衍生化法测定食用海藻中还原型谷胱甘肽
2012-10-24李铉军朱爱花崔胜云
李铉军,韩 玲,朱爱花,崔胜云
(延边大学长白山生物资源与功能分子教育部重点实验室,吉林延吉 133002)
邻苯二甲醛荧光衍生化法测定食用海藻中还原型谷胱甘肽
李铉军,韩 玲,朱爱花,崔胜云*,†
(延边大学长白山生物资源与功能分子教育部重点实验室,吉林延吉 133002)
用质谱和光谱测定方法研究了OPA和还原型谷胱甘肽(GSH)荧光衍生化反应,发现OPA分子苯环上相邻醛基的歧化反应,使得其与GSH发生衍生化反应时生成三环和二环结构的两种衍生化产物,其中三环结构的衍生化产物具有较强的荧光发射特性。利用OPA荧光衍生化法分别测定了马尾藻、鹿角菜、龙须菜中GSH的含量。在含OPA的PBS缓冲溶液、激发波长λex=350nm时,样品溶液在428nm处发射灵敏的荧光,检测限达3.6×10-8mol/L。用标准加入法分别测定样品中GSH含量分别为:0.0714mg/g(马尾藻),0.1183mg/g(鹿角菜),0.1970mg/g(龙须菜),方法的回收率达到99.22%~100.41%。
谷胱甘肽,邻苯二甲醛,马尾藻,鹿角菜,龙须菜,荧光发射
马尾藻(Sargassum siliquastrum)、鹿角菜(Silvetia siliquosa)、龙须菜(Gracilaria lemaneiformis)是我国沿海盛产的药食两用藻类,由于其含有在人体内具有重要活性功能的活性成分和味美可口被人们视为健康食品广泛食用。据国内外文献报道,上述藻类提取物中海藻多糖具有抗氧化、抗癌、提高免疫力等活性功能[1-3]。至于其他活性成分测定,目前报道的还有蛋白质、氨基酸、萜类、甾醇类、生物碱、维生素、抗生素、环状多硫化合物、大环内酯类、微量元素等[4-5],但鲜见还原型谷胱甘肽(GSH)含量测定的报道。GSH是动、植物体内广泛分布的含半胱氨酸残基的三肽,在生物体内参与构成重要的抗氧化防御系统,具有细胞信号转导、抗氧化、参与氨基酸吸收和转运、基因表达、抗癌、重金属解毒等多种生物活性功能[6-10]。由于GSH分子中含氧化性的巯基和可被水解的两个肽键,故只在特定的细胞环境中稳定存在。通常分析操作中的样品破壁提取、分离等前处理过程,会带来有别于胞内的相对苛刻的化学环境,这会导致肽键的水解和巯基的氧化变性,无法得到GSH的完整的分析信息,这可能是许多生物样品测试结果中尽管有氨基端含量信息,但缺少GSH含量信息的原因。这一信息缺失对植物生物活性成分定位中GSH的活性地位的评价也带来困难。本研究利用含OPA衍生化试剂的PBS缓冲液作为提取液,采用细胞破壁、衍生化为一体的样品前处理方法来生成相对稳定的荧光衍生化产物,避开导致样品前处理过程中GSH的肽键断裂和巯基的氧化变性所致的漏检或灵敏度降低的化学环境,由此灵敏测定了马尾藻、鹿角菜和龙须菜中的GSH的含量,同时对荧光衍生化反应机理也进行了进一步的探讨。本研究对上述食用藻类中GSH营养地位及GSH含量测定的方法学研究具有实际意义。
1 材料与方法
1.1 材料与仪器
马尾藻、鹿角菜、龙须菜 均购自山东省青岛市;还原型谷胱甘肽 Aldrich公司;邻苯二甲醛 国药化学试剂公司;实验用水 三次蒸馏水;其他试剂 均为分析纯;
RF-5301PC荧光分光光度仪 日本岛津公司;HP1100-1946A液-质联用仪 美国惠普公司;UV-8500紫外分光光度仪 天美公司;KQ-500DE数控超声波清洗器;UP-400S超声波细胞粉碎机;Mini-10K微型离心机;AP-220ZN空气泵;pHS-3C实验室酸度计。
1.2 实验方法
1.2.1 光谱测定OPA溶液的配制 在容量瓶中用适量甲醇溶解一定量的OPA,然后加入PBS缓冲溶液定容并配制成1×10-2mol/L贮备液,测定时用PBS缓冲溶液稀释即得。
1.2.2 待测样品的提取 准确称取0.2g在80℃烘箱干燥2h后的藻类于50mL锥形瓶中,加入含有一定浓度衍生化试剂(OPA)的0.02mol/L的PBS缓冲溶液20mL作为提取液,超声破壁40min,抽滤,取清液。取10mL清液,加入2倍体积乙醇,放置30min,以8000r/min离心5min除蛋白,取上清液作为供试品。测定时取1mL供试品加入PBS缓冲液定容至10mL进行测定。
1.2.3 质谱测定 实验中发现,荧光衍生化反应受酸度的影响较大,但在pH=7~8的酸度范围内的PBS缓冲溶液中,OPA和GSH皆生成稳定的荧光衍生化产物。为了减小缓冲液盐对质谱仪的影响,质谱测定溶液是分别称取一定量的OPA于两个容量瓶中,用适量甲醇溶解,其中一份加入一定量的GSH,再分别用三次蒸馏水稀释、定容来配制pH=7的OPA溶液和OPA和GSH混合溶液。所配制的溶液从HP1100-1946A液-质联用仪质谱端口进样,测定质谱图。质谱条件为:离子源:ESI;碰撞电压:70eV;干燥气:氮气;干燥器流量:4L/min;干燥气温度:350℃;雾化器压力:55psi;毛细管电压:3500V。
1.2.4 样品测定 参照Cohn和Leroy等[11-12]确立的GSH和OPA荧光衍生化法测定GSH的方法。分别取提取液4mL于6份具塞试管中,其中5份加入PBS缓冲液配制的GSH标准系列溶液,然后用PBS缓冲液皆定容至5mL。选择350nm波长为激发波长,记录428nm处的荧光发射强度。利用荧光发射强度与GSH浓度之间的线性关系,利用标准加入法进行GSH含量测定。
1.3 数据处理
数据处理、回归分析及画图是使用Origin数理统计和画图软件。
2 结果与分析
2.1 OPA和GSH荧光衍生化反应
Leroy等[12]报道,OPA和GSH在PBS(pH=8.0)缓冲溶液中发生反应生成具有三元环状的衍生化产物,该衍生化产物具有较强的荧光发射能力,借此可用荧光分光光度法灵敏测定GSH的含量。由于OPA的苯环邻位两个醛基通常在弱碱性条件下易发生Canizzaro歧化反应,因此溶液的酸度对衍生化产物的生成可能有影响。为了探讨OPA歧化反应对衍生化反应的影响,利用电喷雾质谱端口分别测定了OPA和OPA+GSH混合溶液的质谱图,结果见图1。

图1 OPA和GSH混合溶液的质谱图Fig.1 Mass spectra of OPA and GSH mixture solution
如图1所示,OPA分别在m/z=135.0和m/z=149.1处观察到OPA的质子化的分子离子峰和邻苯二甲酸酐的质子化的分子离子峰。当OPA溶液中含有GSH时,除了m/z=308.1处的GSH的质子化的分子离子峰外,分别在m/z=406.1和m/z=424.1处分别出现OPA和GSH相互作用生成的两种衍生化产物的质谱峰。图1的结果表明,OPA在中性水溶液中也发生歧化反应生成邻-羧基-苯甲醇,该歧化产物在电喷雾气相中脱水缩合生成邻苯二甲酸酐,同时也发现由于OPA的歧化反应导致生成两种与GSH作用产物。
为了进一步探讨OPA的歧化作用对与GSH衍生化反应及其光谱特性的影响,在pH=8的PBS缓冲溶液中分别测定了OPA和OPA+GSH的混合溶液的UV-vis吸收光谱并设定衍生化产物的最大吸收波长作物激发波长测定了荧光发射光谱图,结果见图2。
如图2(A)所示,OPA溶液只出现λmax=258nm处出现苯环π→π*跃迁的B吸收带和λmax=300nm处出现羰基n→π*跃迁所致吸收带。当溶液中含GSH时,分别在λmax=340nm处和λsh=350nm处出现衍生化产物的吸收峰和吸收肩峰。分别选择该吸收波长为激发波长,测定OPA+GSH的混合溶液的荧光光谱,见图2(B),尽管λmax=340nm处比起λsh=350nm具有较强的吸收强度,但所对应的的衍生化产物的荧光发射强度弱于λsh=350nm所对应的荧光发射强度,说明λsh=350nm具有吸收肩峰的荧光衍生化产物具有较强的荧光发射能力。根据图1~图2的质谱和光谱解析,OPA和GSH的混合溶液中发生图3所示衍生化反应。

图2 OPA和GSH混合溶液的UV-vis吸收光谱图和荧光光谱图Fig.2 Uv-vis spectra and fluorescent spectra for mixture solutionof OPA and GSH

图3 OPA和GSH衍生化反应Fig.3 Derivatizing reaciont between OPA and GSH
如图3所示,OPA与GSH衍生化反应包括OPA的两个醛基和GSH的巯基和胺基的直接缩合反应和OPA经歧化后通过苯环上的羟基和羧基与GSH巯基和胺基的缩合反应。直接缩合产物分子具有较高的共轭度和三元环状结构的刚性结构、故该衍生化产物的荧光发射能力比起OPA歧化后的缩合生成的衍生化产物更强。
2.2 GSH含量测定
图4分别为含过量OPA的马尾藻、鹿角菜、龙须菜提取液及该提取液加GSH标准系列溶液时的荧光发射光谱图。
图4的结果表明,在含OPA的提取液在428nm发出较强的荧光,说明样品提取液中含有GSH,当该提取液中加入GSH标准溶液时,荧光法射强度随加入GSH的浓度呈良好的线性关系,其回归方程分别为If=1.52731+2.32532C(马尾藻),If=2.37603+1.14786C(鹿角菜),If=2.85815+0.83633C(龙须菜),相关系数均大于0.99。根据图4~图5的测定结果和回归方程,用标准加入法测定了马尾藻、鹿角菜、龙须菜中的GSH含量,结果见表1。

图4 样品的荧光光谱图Fig.4 Fluorescent spectra of the sample
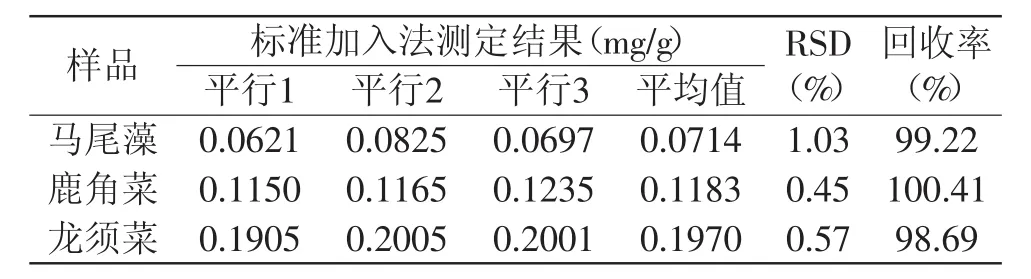
表1 GSH含量测定结果Table 1 Determination results for GSH
表1结果表明,标准加入法测定马尾藻、鹿角菜、龙须菜中的三次测定GSH的平均值分别为0.0714、0.1183、0.1970mg/g,回收率范围98.69%~100.41%。检测限是参照文献[13]进行了测定。利用标准GSH溶液测定了荧光光谱图,发现荧光发射强度在1×10-7~1×10-6mol/L呈良好的线性关系,其线性回归方程为If=0.1542+2.2364CGSH。然后在相同条件下分别平行测定空白溶液8次,其荧光值()为0.8985±0.02124。根据YE=μ+kσ(式中,YE指可被检出的最小分析信号,指平均空白信号值,k为置信度相关的整数,这里取k=3,μ代表平均空白信号值、σ代表标准偏差)则YE=0.8985+3×0.02124,将其代入线性回归方程换算得检测限为3.6×10-8mol/L。
3 结论
3.1 由于OPA的歧化作用,在pH=7~8的溶液中OPA和GSH相互作用生成两种衍生化产物。一种是OPA的相邻醛基与GSH的巯基和胺基缩合生成的三环共轭结构的衍生化产物,另一种是OPA歧化产物的羧基和羟基与GSH的巯基和胺基缩合生成二环共轭产物,其中前者具有更强的荧光发射能力。
3.2 在过量OPA的PBS缓冲溶液中,OPA和GSH的衍生化产物所发射的荧光强度与GSH浓度间呈良好的线性关系,加标回收率也达到98%以上。因此,在本研究实验条件下尽管发生OPA的歧化作用,但仍可准确测定GSH的含量。
3.3 马尾藻、鹿角菜、龙须菜三种可食藻类中都含较丰富的GSH,其中龙须菜中GSH的含量最高,达到0.1970mg/g。
[1] 刘洪丽,胡庭俊,何颖. 马尾藻多糖分离提取及抗氧化活性初步观察[J]. 江苏农业科学,2009(6):337-339.
[2] 李来好,杨贤庆,吴燕燕. 马尾藻的营养成分分析和营养学评价[J]. 青岛海洋大学学报,1997,27(3):319-325.
[3] 陆崇玉,邓赘,宋欣. 龙须菜活性成分的研究开发进展[J]. 时珍国医国药,2001,22(3):711-712.
[4] Ling Z G, Hua T J, Liu H L, et al. Inhibitory effect of Sargassum polysaccharide on oxidative stress induced by infectious bursa disease virus in chicken bursal lymphocytes[J]. International Journal of Biological Macromolecules,2001,49:607-615.
[5] 朱地琴,唐庆九,张劲松. 龙须菜多糖提取工艺优化及其体外免疫活性研究[J]. 天然产物研究与开发,2008,20(6):983-987.
[6] 樊跃平,于健春,余跃. 谷胱甘肽的生理意义及其各种测定方法比较评价[J]. 中国临床营养杂志,2003,11(4):136-139.
[7] 杜琳,张荃. 植物谷胱甘肽与抗氧化胁迫[J]. 山东科学,2008,21(2):27-32.
[8] 金春英,崔京兰,崔胜云. 氧化型谷胱甘肽对还原性谷胱甘肽清除自由基的协同作用[J]. 分析化学,2009,37(9):1349-1353.
[9] Nazzareno B, Suzanne M K, Rosenarie M, et al. Plasmamembrane glutathione transporters and their roles in cell physiology and pathophysiology[J]. Molecular Aspects of Medicine,2009(30):13-28.
[10] Ralf D. Metabolism and functions of glutathione in brain[J].Progress in Neurobiology,2000,62:649-671.
[11] Cohn V H,Lyle J. A fluorometric assay for glutathione [J].Anal Biochem,1966,14(3):434-440.
[12] Leroy P,Nicolas A. Rapid liquid chromatographic assay of glutathione in cultured cells[J]. Biomedical Chromatography,1993 (7):86-89.
[13] 王秋林,王浩毅. 血浆中游离还原型及氧化型谷胱甘肽的荧光测定法[J]. 光谱学与光谱分析,2005,25(11):1834-1838.
Determination of glutathione in edible marine algae using OPA fluorescence derivatizing method
LI Xuan-jun,HAN Ling,ZHU Ai-hua,CUI Sheng-Yun*,†
(Key Laboratory of Natural Resources of Changbai Mountain&Functinal Molecules,Ministry of Education Yanbian University,Yanji 133002,China)
The derivatizing reaction between OPA and reduced glutathione(GSH) were investigated using ESIMS,spectrometric analysis.Because of Cannizaro reaction of OPA in the solution,two derivitized products had been formed with conjugated tricyclic structure and bicyclic structure,in which much more fluorescent emmision properties was observed by derivatized product with tricyclic conjugated structure.In PBS buffer soluiton,using OPA as derivatizing agent,GSH content in Sargassum siliquastrum,Silvetia siliquosa,Gracilaria lemaneiformis had been determined by fluorometryic analysis.In OPA+PBS mixture buffer solution with excitation wavelength at 350nm,the sample emmited strong fluorescence at 428nm,the detection limit was 3.6×10-8mol/L.GSH contents determined with standard addition methods in the samples were 0.0714mg/g(Sargassum siliquastrum),0.1183mg/g(Silvetia siliquosa),0.1970mg/g(Gracilaria lemaneiformis) respectively,and the reconveries were in the range of 99.22%~100.41%.
glutathione;OPA;Sargassum siliquastrum;Silvetia siliquosa;Gracilaria lemaneiformis;fluorescence
0652.3
A
1002-0306(2012)22-0081-04
2012-06-12 *通讯联系人 †并列第一作者
李铉军(1977-),男,硕士,讲师,研究方向:食品分析。
崔胜云(1957-),男,博士,教授,研究方向:生物有机分析。
国家自然科学基金(21165021)。
