松籽壳多糖超声辅助溶剂法提取及抗氧化性研究
2012-03-20李桂娟张财华
李桂娟 李 冲 姜 雪 龚 伟 张财华 杨 丽
(长春工业大学化学工程学院,吉林 长春 130012)
松籽壳是松籽加工的副产品,中国每年大约产松籽壳500万t,但松籽壳开发利用较低,仅有从松籽壳中提取黄酮和将松籽壳制备成活性炭的报道[1,2]。松籽壳多糖(pine nut shell polysaccharide,PSP)是从松籽壳中提取的一种酸性多糖。研究[3,4]表明,从天然产物中提取出来的多糖能参与生物体内细胞中的各种活动,具有重要与特殊的生理活性。在提高人体免 疫力和 抗 衰 老[5,6]、抗 肿 瘤、抗 病 毒[7,8]、抗 感 染、抗凝血、抗氧化[9]、降血糖、调血脂[10]等方面都表现出显著的药理作用与药用疗效[11]。多糖的抗氧化研究[12]表明,多糖的抗氧化性可能是多糖抗肿瘤、抗衰老、抗感染等其它活性的重要原理之一。近年来利用超声法提取植物中的多糖受到人们的关注[13,14],但关于松籽壳多糖的提取和抗氧化性的研究还鲜有报道。本试验采用超声波辅助溶剂法,通过单因素和正交试验,对松籽壳中可溶性多糖的提取工艺进行研究,旨在探索松籽壳多糖的提取方法,分析其清除自由基的能力。为松籽壳多糖的提取工艺及其抗氧化活性研究提供理论基础,为松籽壳的进一步开发利用提供参考。
1 材料与方法
1.1 材料与仪器
1.1.1 材料与试剂
松籽:购自吉林省长白县农贸市场;
无水乙醇、苯酚:AR 级,天津市北联精细化学品开发有限公司;
乙醚:AR 级,天津天泰精细化学品有限公司;
浓硫酸、碳酸氢钠、正丁醇、三氯甲烷:AR 级,北京北化精细化学品有限责任公司;
葡萄糖:AR 级,北京化工厂;
水杨酸:AR 级,天津市福晨化学试剂厂;
七水合硫酸亚铁、过氧化氢:天津市福晨化学试剂厂;
邻苯三酚:天津市光复精细化工研究所;
氯化硝基四唑氮蓝(NBT):海惠世生化试剂有限公司;
三羟甲基氨基甲烷(Tris):国药集团化学试剂有限公司。
1.1.2 主要仪器设备
高速万能粉碎机:FW-100,北京中兴伟业仪器公司;
电热恒温水浴锅:TMTE-7000,余姚市长江温度仪表厂;
数控超声波清洗器:KQ-300DE,昆山市超声仪器有限公司;
紫外可见分光光度计:UV754N,苏州江东精密仪器有限公司;
电子天平:ML203,梅特勒托利多(上海)仪器有限公司;
电热恒温干燥箱:DF206,上海基玮仪器设备有限公司;
离心机:LGR10-4.2,北京医用离心机厂;
旋转蒸发器:RE1002,上海豫康科教仪器设备有限公司;
电动搅拌器:JJ-1,金坛市恒斗仪器厂;
循环水多用真空泵:SHB-Ⅲ,郑州长城科工贸有限公司。
1.2 试验方法
1.2.1 超声波辅助溶剂法提取工艺流程
松籽壳去杂质→粉碎→过筛→干燥→乙醇乙醚混合溶液脱脂→干燥→超声提取→过滤→浓缩→加入无水乙醇→静置→离心沉淀→干燥→粗多糖
1.2.2 热水提取法工艺流程 热水提取法工艺流程与1.2.1基本相同,不同的是超声提取工艺改为热水提取。
1.2.3 原料预处理 去除果仁和杂质后的松籽壳用粉碎机粉碎,过80目筛,置于干燥箱中50 ℃烘干。取适量干燥后的松籽壳粉,用配好的乙醇∶乙醚(V∶V)1∶1混合溶剂按料液比为1∶3(m∶V)浸泡,于三口烧瓶中60 ℃加热回流1h,过滤,所得滤渣烘干,备用。
1.2.4 多糖含量的测定 采用苯酚-硫酸法[15]。
1.2.5 超声波辅助提取工艺单因素试验
(1)提取时间对多糖含量的影响:提取次数3次,料液比1∶40(m∶V),提取温度60 ℃,提取功率450 W,分别提取10,20,30,40,50 min,考察提取时间对松籽壳多糖含量的影响。
(2)提取温度对多糖含量的影响:提取次数3次,料液比1∶40(m∶V),提取功率450 W,提取时间15min,在温度分别为50,60,70,80 ℃条件下进行提取,考察提取温度对松籽壳多糖含量的影响。
(3)料液比对多糖含量的影响:提取次数3次,提取温度60 ℃,提取功率450 W,提取时间15 min,在料液比为1∶20,1∶30,1∶40,1∶50,1∶60(m∶V)条件下进行提取,考察料液比对松籽壳多糖含量的影响。
(4)提取次数对多糖含量的影响:提取次数3次,料液比1∶40(m∶V),提取温度60 ℃,提取功率450 W,提取时间15min,提取3次,考察提取次数对松籽壳多糖含量的影响。
1.2.6 抗氧化性能研究试验
(1)清除羟基自由基试验:取5 支具塞试管,分别标号1,2,3,4,5。分别向试管中依次加入6mmol/L FeSO4溶液2mL、不同质量浓度的松子壳多糖溶液2 mL,6 mmol/L H2O2溶液2mL,摇匀,静置10min,再加入6mmol/L 水杨酸溶液2mL,摇匀,静置30min后于510nm 处测定不同质量浓度下松子壳多糖的吸光度值(Ai)。
另取5支具塞试管,标号为1′,2′,3′,4′,5′。用水代替水杨酸,重复上述操作,测定某质量浓度下松子壳多糖的吸光度值(Aj)。
再取1支具塞试管,标号为0。用水代替抗氧化剂,测得空白对照吸光光度值(Ao)。
按式(1)计算羟基自由基清除率:

式中:
E—— 清除率,%;
Ai—— 松籽壳多糖吸光度;
Aj—— 松籽壳多糖本底吸光度;
Ao—— 空白对照吸光度。
(2)清除超氧阴离子试验:取5 支具塞试管,分别标号1,2,3,4,5。分别取0.1mol/L pH 为8.2的Tris-HCl缓冲液2.5mL于试管中,置25 ℃水浴中预热20min,加不同质量浓度的松子壳多糖溶液0.2mL,0.98mmol/L 的NBT 0.6mL,10 mmol/L 的 邻 苯 三 酚0.3 mL,混 合 均 匀 后 在25 ℃水浴中反应4min,立即用2滴8mol/L的0.1mL HCl终止反应,并在波长为530nm 处测定吸光度A 值。
另取5 支具赛试管分别标号1′,2′,3′,4′,5′作为空白组,空白管用蒸馏水代替松子壳多糖溶液。重复上述步骤。
按式(2)计算超氧阴离子基清除率:

式中:
E—— 清除率,%;
Ab—— 空白样品吸光度;
As—— 样品吸光度。
2 结果与讨论
2.1 单因素试验
2.1.1 超声提取时间对松籽壳多糖含量的影响 由图1可知,在10~30min时,提取物中多糖的含量随着超声提取时间的增加而明显提高,30min之后,随着超声提取时间的增加,提取物中多糖的含量下降。导致这种现象的原因可能是随着时间的增加,松籽壳细胞膜的破碎度逐渐增大,溶出物的含量也随之增多,多糖含量增加。随着时间的进一步增加,当溶解度达到饱和时,有效成分不再被溶解,产率也就不再有明显提高。随着超声时间的延长,杂质的含量相应增多,有效成分的溶解量随之减少,即提取物中的多糖含量随之减小。因此选取30min为最佳超声提取时间。
2.1.2 超声提取温度对松籽壳多糖含量的影响 由图2可知,提取温度低于60 ℃时,松籽壳多糖的含量随着温度的升高而迅速增大,这可能是温度较低时,一部分胞壁结构未受到根本性破坏,而仅发生变形和裂纹,而随着温度的提高,热效应使分子的运动加速,进一步破坏了胞壁结构,从而使松籽壳中水溶性多糖得到更充分的释放,温度超过60 ℃后,松籽壳提取物中的多糖含量呈现下降趋势。分析原因,可能是温度高于60 ℃后,在高温和超声波剪切的协同作用下,使部分松籽壳多糖受到破坏,导致松籽壳提取物中多糖的含量减少。所以选取60 ℃为最佳超声提取温度。

图1 超声提取时间与多糖含量的关系曲线Figure 1 Ultrasonic extraction time and the curve of the polysaccharide content
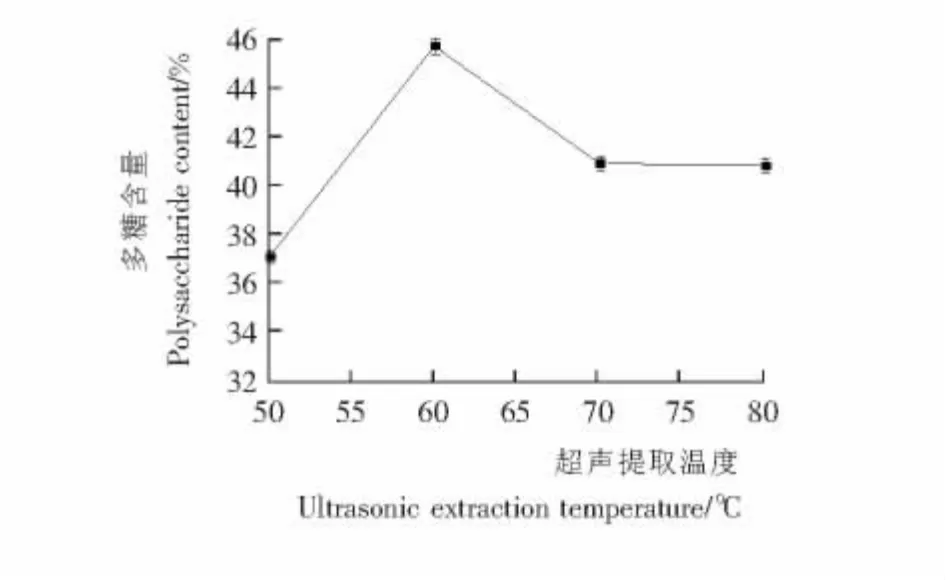
图2 超声提取温度与多糖含量的关系曲线Figure 2 Ultrasonic extraction temperature and the curve of the polysaccharide content
2.1.3 料液比对松籽壳多糖含量的影响 由图3可知,当料液比在1∶20~1∶30(m∶V)时,松籽壳提取物中多糖的含量随着料液比的增加而逐渐提高,料液比为1∶40(m∶V)时出现最大值。这是因为随着料液比的增大,松籽壳多糖含量将逐渐增大,杂质的含量也将增大,但料液比达到一定值后,杂质的去除效率将明显影响提取物中多糖含量,因而选取1∶40(m∶V)为最佳料液比。
2.1.4 超声提取次数对松籽壳多糖含量的影响 由图4可知,松籽壳提取物中多糖的含量随着超声提取次数的增加而提高,提取次数从1次增加到2次时多糖提取率上升明显,从2次增加到3次时松籽壳提取物中多糖的提取率趋于平缓,所以从经济合理性考虑,选取超声提取2次为最佳提取次数。
2.2 正交试验
在单因素试验的基础上,对影响松籽壳多糖提取率的主要因素(超声次数、料液比、提取时间和提取温度)进行L9(34)正交试验研究,确定最佳提取工艺参数。正交试验因素水平见表1,试验结果与分析见表2,方差分析见表3。

图3 料液比与多糖含量的关系曲线Figure 3 Solid-liquid ratio curve with the polysaccharide content

图4 超声提取次数与多糖含量的关系曲线Figure 4 Ultrasonic extraction times and the relationship of the polysaccharide content

表1 L9(34)正交试验因素水平表Table 1 The factors and levels for the L9(34)orthogonal design
由表2可知,超声提取松籽壳多糖的最佳工艺条件为A3B2C3D1,即超声提取时间为30 min,超声提取温度为60 ℃,超声提取料液比为1∶50(m∶V),超声提取次数为1次。此工艺下多糖提取率为44.26%。
在提取时间、提取温度、料液比及超声提取次数4个因素中,由极差值R 可知,对超声提取物中多糖的含量的影响强弱顺序为提取温度>提取次数>提取料液比>提取时间。
方差结果(表3)表明,B 因素对提取结果的影响显著。即提取温度影响最大,而提取时间、料液比和提取次数对结果无显著影响。因此,考虑到工艺条件、生产效率、经济合理性等,确定超声提取松籽壳多糖的最佳提取工艺条件:超声提取时间为30min,超声提取温度为60 ℃,超声提取料液比为1∶50(m∶V),超声提取次数为1次。

表2 L9(34)正交试验试验结果Table 2 Results of L9(34)orthogonal experiments

表3 方差分析表Table 3 Analysis results of variance
2.3 超声波辅助提取法和热水提取法的比较
两种提取方法对松籽壳多糖含量的影响见表4。由表4可知,超声波辅助法提取不仅多糖含量高,提取时间短,而且超声提取法温度低于热水浸提法,因此,超声波辅助提取法不仅节省能源,更利于活性物质的不变性与不失活。

表4 超声波辅助提取与热水浸提法结果的对比Table 4 Comparison of ultrasonic assisted extraction with hot water extraction results
2.4 松籽壳多糖抗氧化性研究
2.4.1 清除羟基自由基 由图5可知,松籽壳多糖对羟基自由基具有清除能力,且清除能力的强弱与多糖浓度成正相关系。当多糖浓度达到0.8mg/mL 时,松籽壳多糖的对羟基自由基的清除率就超过50%,这表明松籽壳多糖具有良好的清除羟基自由基的能力。
2.4.2 清除超氧阴离子自由基 由图6可知,松籽壳多糖对超氧自由基具有一定程度的清除能力,且清除能力与多糖浓度呈正相关性。当松籽壳多糖浓度达到2.2mg/mL 时松籽壳多糖对超氧阴离子基的清除率接近50%。可见,松籽壳多糖清除超氧自由基的能力与清除羟基自由基的能力相比较弱。

图5 多糖浓度与羟基自由基清除率关系曲线Figure 5 The curve between polysaccharide concentration and hydroxyl radical scavenging rate

图6 多糖浓度与超氧阴离子自由基清除率关系曲线Figure 6 The curve between polysaccharide concentration and superoxide anion radical clearance rate
3 结论
(1)以水为提取剂,通过单因素试验和正交试验,采用超声辅助法提取了松籽壳多糖。结果表明,超声波辅助提取松籽壳多糖的最佳工艺条件为超声时间30min,提取温度60℃,料液比1∶50(m∶V),超声提取次数1次,在此条件下,多糖含量为44.26%。
(2)与常规水提法相比,超声波提取不仅具有时间短、能耗低等优点,同时还能够提高多糖的含量。
(3)羟基自由基清除试验表明松籽壳多糖与其它植物提取的多糖相同,对Fenton体系产生的活性羟基具有较好的清除能力,并且该清除作用随着松籽壳多糖浓度增加而提高。超氧阴离子自由基的清除试验表明松籽壳多糖对超氧阴离子自由基有清除作用,且该清除作用规律与羟基自由基清除试验相同,但作用能力与对羟基自由基的清除能力相比较弱。
1 胡志杰,郑尊彬.水蒸气活化法制备松籽壳活性炭工艺[J].林业科技开发,2008,22(6):85~87.
2 董周永,任辉,周亚军.松籽壳总黄酮超声提取工艺响应面优化[J].食品与机械,2011,27(5):100~102.
3 Rupérez P,Ahrazem O,Leal J A.Potential antioxidant capacity of sulfated polysaccharides from the edible marine brown seaweed fucus vesiculosus[J].Agric.Food Chem.,2002,50(4):840~845.
4 官波,郑文诚.山药多糖提取工艺的优化[J].食品与机械,2010,26(1):98~101.
5 Omarsdottir S,Freysdottir J,Barsett H,et a1.Effects of lichen heteroglycans on proliferation and IL-10secretion by rat spleen cells and IL-10and TNF-alpha secretion by rat peritoneal macrophages in vitro[J].Phytomedicine,2005,12(6-7):461~467.
6 Nirmal P,Samir A R,Mahmoud A E,et a1.Characterization of aloeride,a new high-molecular-weight polysaccharide from aloe vera with potent immunostimulatory activity[J].Agric.Food Chem.,2001,49(2):1 030~1 034.
7 Park S D,Yung S L,Cheorl H.Immunopontiating and antitum or activities of the purified polysaccharide phellodendron Chinese schneid[J].Life Sciences,2004,75(22):2 621~2 632.
8 Zhu W,Chui L C,Ooi V E,et al.Antiviral property and mechanism of a sulphated polysaccharide from the brown alga Sargassum patens against Herpes simplex virus typel[J].Phytomedicine,2006,13(9-10):695~701.
9 亓树艳,王荔,莫晓燕.大枣多糖的提取工艺及抗氧化作用研究[J].食品与机械,2012,28(4):117~120.
10 尹秀莲,游庆红.超声辅助复合酶法提取桑黄多糖[J].食品与机械,2011,27(4):58~60.
11 陈旋,张翼,张剑波,等.植物多糖的研究进展[J].中国新药杂志,2007,16(13):1 000~1 005.
12 朱良,张杰平,王一飞.繁枝蜈蚣藻多糖的抗氧化活性研究[J].食品科学,2008,29(3):453~456.
13 Lrakoze Pierre,Claver,Haiha,et al.Optimization of ultrasonic extraction of polysaccharides from Chinese malted sorghum using response surface methodology[J].Pakistan Journal of Nutrition,2010,9(4):336~342.
14 Wang Y J,Cheng Z,Mao J W,et al.Optimization of ultrasonic assisted extraction process of Poria cocos polysaccharides by response surface methodology[J].Carbohydrate Polymers,2009,77(4):713~717.
15 钟先锋,黄桂东,邓泽元,等.荷叶多糖的提取工艺研究[J].食品与机械,2007,23(1):87~89.
