美人鱼发光杆菌杀鱼亚种感染卵形鲳鲹的病理学观察
2012-03-14
(中国水产科学研究院 南海水产研究所,广东 广州 510300)
卵形鲳鲹(Trachinotus ovatus)属鲈形目(Perciformes),鲹科(Carangidate),鲳鲹亚科(Trachinotinae),鲳鲹属(Trachinotus),俗名黄腊鲳、金鲳、卵鲹、红三、红沙等,是一种暖水性鱼类,广泛分布于世界各大洋,在东南亚、澳大利亚、日本、美洲热带和温带的大西洋海岸等地均有分布[1]。在中国的东海、南海和黄海,特别是广东、广西、海南和福建沿海均有一定的资源量。近年来海南省近海网箱养殖的卵形鲳鲹出现大批死亡,本研究小组已经对病原进行分离、鉴定,结果证实其病原菌为美人鱼发光杆菌杀鱼亚种(Photobacterium damselaesubsp.piscicida)[2]。由美人鱼发光杆菌杀鱼亚种引起的疾病称为发光杆菌病,该菌能引起多种海水鱼类发病,以前称巴斯德杆菌症(Pasteurelosis)或假性结核病(Pseudotuberculosis),病原为杀鱼巴斯德杆菌(Pastrurella piscicida),1995年更名为美人鱼发光杆菌杀鱼亚种,本病是以脾脏、肾脏及肝脏等器官的表面及实质出现大量灰白色坏死结节为主要临床特征,发病率约为 60%,致死率约为 50%,潜伏期大约一周左右[3]。本研究采取腹腔注射和浸泡两种方式感染卵形鲳鲹,对其进行系统的病理学观察。目前尚未见美人鱼发光杆菌杀鱼亚种感染卵形鲳鲹病理学方面的报道,该研究将为阐明致病机理及诊断提供一定的帮助。
1 材料与方法
1.1 实验用鱼与菌株
卵形鲳鲹购自海南省陵水新村某养殖场,体质量约50 g,外观无伤,游动活泼、摄食正常。实验在南海水产研究所热带水产开发中心陵水实验站进行,卵形鲳鲹暂养在9个1 m3水体的玻璃钢桶中,置于通风的室内,温度在 27℃±1.5℃,水源为经沙虑处理的天然海水,小型充气机全天充气。人工感染所用的美人鱼发光杆菌杀鱼亚种 TOS1菌株由本研究小组分离自发病卵形鲳鲹的肾脏和脾脏[2]。
1.2 实验分组及人工感染
取90尾健康的卵形鲳鲹,平均分成 3组,分别为腹腔注射、浸泡和对照组,每组30尾,每组3个平行,每个平行组 10尾鱼放养于一个玻璃钢桶中,每天早晚投喂商品饲料各1次,换水和清洗桶底1次,暂养 7 d后进行人工感染。TOS1菌株在培养基上28℃培养 24 h后,用灭菌的磷酸盐缓冲液(PBS,pH=7.2,0.01 mol/L)配制成 1.0×109cfu/mL用于腹腔注射,每尾注射0.1 mL。浸泡组处理方式为,在桶中加入少量海水,用培养的菌液配制成 1.0×107cfu/mL,将鱼放入浸泡1 h。对照组是用PBS(0.01 mol/L)每尾腹腔注射0.1 mL。实验过程中观察各组的临床症状,并记录累积死亡率。
1.3 组织病理切片的制备及观察
取典型发病症状的病鱼,解剖后分别取鳃、心、肝脏、肾脏、脾脏、肠等器官的小块组织,置于10%的中性福尔马林固定液中固定24 h以上,经酒精逐级脱水,二甲苯透明,浸蜡,包埋,进行切片,厚度为 5 μm,然后经二甲苯脱蜡,酒精逐级复水,用苏木精-伊红(H.E)染色,再经酒精逐级脱水,二甲苯透明,中性树胶封片,最后用Leica DM显微镜观察并拍照。
1.4 超薄切片的制备及电镜观察
取典型发病症状的病鱼,解剖后取肾脏、脾脏和肝脏等组织,切成 1 mm3大小的小块,置于 2.5%戊二醛固定液中固定,经乙醇脱水,环氧树脂包埋,超薄切片,醋酸铀及柠檬酸铅染色,用透射电镜观察、拍照。
2 结果
2.1 人工感染的累积死亡率及临床症状
各处理组的卵形鲳鲹在感染第21天后不再发生新的死亡病例,因此在感染后28 d则停止临床观察,各组累积死亡率见图1。结果显示,腹腔注射后的3~7 d是死亡的高峰期,累积死亡率高达63.3%,到第21天累积死亡率仅上升至73.3%。浸泡组的累积死亡率较低,到第21天累积死亡率才达到30%。通过腹腔注射和浸泡致病的卵形鲳鲹在临床症状上可分为急性和慢性,通过观察,发现腹腔注射途径的以急性型病例为主,而浸泡感染的主要以慢性型症状。感染的卵形鲳鲹仍表现为游动速度快,活力和摄食好,当发现鱼活力下降,拒绝摄食,在桶底慢游时,卵形鲳鲹则会很快死亡。部分急性型症状的鱼通常在感染7 d内死亡,但鱼体表症状不明显,解剖濒死的病鱼通常发现鳃部轻微出血,腹腔有积液,在脾脏和肾脏会出现灶状坏死(图2-1,2-2)。而慢性型症状的鱼通常在感染7 d后,仅少数的鱼会死亡,鱼活力下降,摄食量减少,解剖濒死的病鱼能观察到肾脏和脾脏肿大呈暗红色,在其表面和实质布满直径0.5~1.0 mm 白色颗粒状结节,也可在心脏内观察到少量的白色坏死结节(图2-3,2-4)。同时在急性和慢性症状卵形鲳鲹的肾脏和脾脏内均分离到与感染菌株形态、生理生化及16S RNA分子鉴定完全一致的菌株。

图1 美人鱼发光杆菌TOS1感染卵形鲳鲹的累积死亡率Fig.1 Accumulative mortalities of Trachinotus ovatus infected with Photobacterium damselae TOS1 strain

图2 美人鱼发光杆菌感染卵形鲳鲹的临床症状Fig.2 Clinical signs of Trachinotus ovatus infected with Photobacterium damselae
2.2 组织病理变化
2.2.1 鳃
急性型的卵形鲳鲹鳃丝排列不整齐,呈波状扭曲,鳃丝组织的完整性受到破坏,次级鳃片水肿、变性,有蛋白样物质渗出,泌氯细胞增生(图3-1)。慢性型的卵形鲳鲹,次级鳃丝完全融合,鳃丝上皮细胞脱落、坏死,鳃中央静脉窦扩张、严重充血,鳃丝发生局灶状坏死(图3-2)。
2.2.2 心脏
急性型的卵形鲳鲹心肌纤维排列整齐,但心肌细胞会发生多灶性坏死,组织中有大量的细胞核碎片(图3-3)。慢性型的卵形鲳鲹,心外膜增厚,肌间隙明显增宽、水肿,心肌纤维变性横纹模糊,断裂,排列紊乱,心肌细胞发生肉芽肿病变(图3-4)。
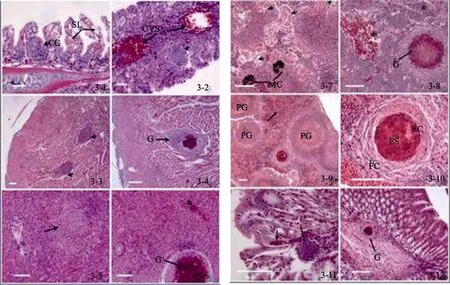
图3 美人鱼发光杆菌感染卵形鲳鲹的组织病理学变化Fig.3 Histopathological changes of Trachinotus ovatus infected with Photobacterium damselae
2.2.3 肝脏
急性型的卵形鲳鲹肝细胞肿大,肝索结构紊乱,肝细胞发生颗粒变性,有的肝小叶的肝细胞大面积发生凝固性坏死(图3-5)。慢性型的卵形鲳鲹,肝细胞变性,肝血窦扩张、充血及血管发生栓塞现象,肝细胞发生肉芽肿病变(图3-6)。
2.2.4 肾脏
急性型的卵形鲳鲹肾脏实质部的肾小管上皮细胞肿胀,有的肾小管上皮细胞脱落、坏死,与基底膜完全分离,形成一空腔,肾小球发生变性和坏死,大量的肾间质组织黑色素巨噬细胞聚集,形成多个黑色素巨噬中心(图3-7)。肾脏间质的造血组织和淋巴组织出现大面积的坏死,坏死灶周围有大量的炎症细胞浸润。慢性型的卵形鲳鲹,肾小管和肾小球结构严重破坏,数量减少,肾间质有大量的红细胞渗出,严重出血,肾造血组织发生肉芽肿病变(图3-8)。
2.2.5 脾脏
急性型的脾脏红髓和白髓结构模糊,网状内皮细胞增多,淋巴组织出现坏死,并伴有炎性细胞浸润。慢性型的脾血髓窦扩张淤血、脾间质出血,可见大量正在形成中的肉芽肿(图3-9),脾脏内成熟肉芽肿的结节中央为干酪样坏死区,H.E染色呈嗜酸性,由坏死的组织细胞、白细胞及细菌组成,坏死区被巨噬细胞和上皮细胞包裹,最外层为成纤维细胞和纤维细胞(图3-10)。
2.2.6 肠
急性型的卵形鲳鲹,肠道的组织学变化不明显。慢性型的卵形鲳鲹,肠黏膜上皮发生变性、脱落、黏膜固有层出血及局灶性坏死(图3-11),在肠黏膜固有层可观察到肉芽肿病变(图3-12)。
2.3 超微病理变化
2.3.1 脾
急性型的卵形鲳鲹脾淋巴细胞发生灶状坏死,细胞核染色质呈现环状,位于核周边,即染色质边集,病灶处巨噬细胞增多,准备吞噬异物(图4-1)。
慢性型的卵形鲳鲹脾脏内多处发生肉芽肿病变,在肉芽肿的中心仅见少量淋巴细胞核染色质聚集成大小的团块,溶酶体增多,细菌溶解,很难见到完整的细菌形态,线粒体、高尔基体和内质网完全溶解(图4-2)。
2.3.2 肾
急性型的卵形鲳鲹肾小管上皮细胞的发生空泡变性,微绒毛排列紊乱,肾小球基膜加厚,遭到破坏,肾造血组织细胞核基质减少,其他细胞器数量减少,线粒体肿胀,嵴断裂(图4-3)。慢性型的卵形鲳鲹肾脏多处发生肉芽肿病变,肾小管上皮细胞的微绒毛脱落,细胞高尔基体和内质网溶解,仅见增多溶酶体和大量的细胞器碎片(图4-4)。

图4 美人鱼发光杆菌感染卵形鲳鲹的超微病理学变化Fig.4 Ultrastructural pathologicalchanges of Trachinotus ovatus infected with Photobacterium damselae
2.3.3 心
急性型的卵形鲳鲹心肌细胞线粒体增生,部分线粒体肿胀,细胞内质网、高尔基体极少(图4-5)。慢性型的卵形鲳鲹心肌原纤维Z带排列紊乱,断裂,线粒体变性,嵴减少,可见到较大的泡状脂滴(图4-6)。
3 讨论
卵形鲳鲹是一种抗病力较强的海水鱼类,以前关于其病害方面的报道极少。但由于养殖密度的提高及近海环境污染的加重,现卵形鲳鲹病害方面的报道也开始增多,大多为细菌病,病原主要有嗜麦芽假单胞菌(Pseudomonas maltophilia)、鱼诺卡氏菌(Nocardia seriolae)和创伤弧菌(Vibrio vulnificus)等[4-7],而由病毒引起仅见神经坏死症[8],寄生虫病主要由刺激隐核虫(Cryptocaryon irritans)引起,且致死率非常高[9]。近几年在中国南方沿海调查发现,美人鱼发光杆菌杀鱼亚种的感染能导致卵形鲳鲹大批的死亡[2]。海水鱼的发光杆菌病对养殖业造成了巨大的损失,1968年,在美国切萨皮克湾的野生白鲈(Morone americanus)与条纹鲈(Morone saxatilis)首次发现发光杆菌病[10],1970年此病造成了德克萨斯州的大西洋油鲱(Brevoortia tyrannus)与条纹鲈的大量死亡[11],这种病原菌在日本造成养殖鱼(Seriola quinqueradiata)的大量死亡,在法国、意大利及西班牙等国也造成养殖鱼类严重的损失,使许多海水鱼养殖场倒闭[12]。中国台湾地区首先在淡水养殖的斑鳢(Ophiocephalus maculates)发现发光杆菌病,之后,在夏季水温偏高的时期,养殖的军曹鱼(Rachycentron canadum)也易发生此病[13-14],所以中国南方新发现的卵形鲳鲹发光杆菌病应当给予重视。
了解卵形鲳鲹发光杆菌病,首先要弄清其病理学的特征。本研究通过腹腔注射和浸泡两种方式均可成功感染卵形鲳鲹,大多器官都遭受不同程度的损伤,推测病原菌及其毒素可能进入血液循环内,而引起卵形鲳鲹全身的病变。腹腔注射感染的呈现急性型死亡病例较多,可能腹腔注射途径能使病原菌较快进入血液,在短时间内对鱼体造成较大的伤害。而浸泡感染途径中病原菌需穿越更多的免疫防线才能进入到鱼体的血液循环,对鱼体则是缓慢损伤过程,所以致死率不高,慢性型病例较多。人工感染美人鱼发光杆菌的卵形鲳鲹体表病变不明显,急性型卵形鲳鲹的鳃盖处轻微出血,腹腔有积液,而慢性型卵形鲳鲹的脾脏、肾脏和肝脏表面和实质布满直径0.5~1.0 mm的白色颗粒状结节。慢性感染的卵形鲳鲹与自然发病鱼临床症状十分接近[2],与以前报道患发光杆菌病的金头(Sparus aurata)、金枪鱼(Thunnus thynnus)等症状也类似[15-16]。组织病理学观察发现,急性症状的卵形鲳鲹一些器官或组织遭受不同程度的损伤,主要是鳃、心脏、肝脏、肾脏、脾脏、及肠道等器官出现淤血、出血、变性及坏死。而在慢性症状中,发现很多器官或组织有典型的肉芽肿病变,肉芽肿结构可分3层,肉芽肿中央为干酪样坏死区,主要为坏死的组织细胞、白细胞和细菌等;在坏死区周围有大量胞体较大、边界不清的细胞,主要为类上皮细胞和多核巨细胞,有时可见大量炎性细胞浸润类上皮细胞周围;最外层由数层成纤维细胞和纤维细胞组成的包膜包围。在鱼类疾病中能引起肉芽肿病变的病原大多是革兰氏阳性菌,常见的有分枝杆菌(Mycobacteriumsp.)及诺卡氏菌(Nocardiasp.)等[17-18],而由革兰氏阴性菌引起报道的较少,如爱德华氏菌(Edwardsiella tarda) 和美人鱼发光杆菌等[14,19]。患发光杆菌病的卵形鲳鲹内脏器官虽然有典型的肉芽肿病变特征,但发病鱼的体表病变则不明显。
通过对各器官进行比较,脾脏、肾脏和心脏病变最为严重。脾组织损坏会导致机体营养不良,免疫力下降,对外来病原侵袭的抵抗力会减弱[20]。肾组织发生的上述病变,使得鱼体内、外渗透压平衡失调,而且会使鱼机体贫血,免疫力下降[21]。心肌细胞的病变可能引起全身血液循环障碍、缺氧等一系列功能障碍[22],上述卵形鲳鲹三大重要器官发生的病理损伤,是加速或导致鱼死亡的原因之一。对其进一步的电镜观察,发现在急性病例的脾脏中,是以巨噬细胞为主的炎症细胞增多,在肾脏中,肾小管上皮细胞发生变性,微绒毛也发生病变,心脏的中线粒体增生、肿胀。在慢性病例中,各病灶部位的细胞大多发生不可逆的病理变化,亚细胞器发生溶解,发现大量的组织碎片,可见慢性型发光杆菌的卵形鲳鲹病灶是难以康复的。从组织病理学变化特征来看,国外报道的其他海水鱼类发光杆菌病形成肉芽肿病变的器官主要是脾脏、肾脏和肝脏[23-25],而本研究发现,除上述 3个器官外,卵形鲳鲹心脏和肠道内也发生典型的肉芽肿病变,说明美人鱼发光杆菌在卵形鲳鲹内所损伤的靶器官更多,这些组织器官同卵形鲳鲹的生命活动息息相关,组织器官生理功能的丧失,最终导致卵形鲳鲹死亡。作者为进一步研究卵形鲳鲹发光杆菌病的致病机理奠定基础。
[1]许晓娟,李加儿,区又君.盐度对卵形鲳鲹胚胎发育和早期仔鱼的影响[J].南方水产,2009,5 (6):31-35.
[2]王瑞旋,冯娟,苏友禄,等.卵形鲳鲹美人鱼发光杆菌杀鱼亚种的分离鉴定[J].中国水产科学,2010,17(5):1020-1027.
[3]Lopez M V,Barnes A C,Santos N M,et al.Invasion of fish epithelial cells byPhotobacterium damselaesubsp.piscicida:evidence for receptor specificity,and effect of capsule and serum[J].Microbiology,2000,146 (1):21-30.
[4]周永灿,朱传华,张本,等.卵形鲳鲹大规模死亡的病原及其防治[J].海洋科学,2001,25 (4):40-44.
[5]黄郁葱,简纪常,吴灶和,等.卵形鲳鲹结节病病原的分离与鉴定[J].广东海洋大学学报,2008,28 (4):49-53.
[6]赵典惠,刘丽波,孙际佳,等.用美人鱼弧菌与创伤弧菌人工感染卵形鲳鲹的组织病理学研究[J].大连水产学院学报,2007,22 (6):455-458.
[7]Li G F,Zhao D H,Huang L,et al.Identification and phylogenetic analysis ofVibrio vulnificusisolated from diseasedTrachinotus ovatusin cage mariculture [J].Aquaculture,2006,261(1):17-25.
[8]许海东,区又君,郭志勋,等.神经坏死病毒对卵形鲳鲹的致病性及外壳蛋白基因序列分析[J].上海海洋大学学报,2010,19(4):482-488.
[9]但学明,李安兴,林小涛,等.卵形鲳鲹对刺激隐核虫的免疫应答和免疫保护研究[J].水生生物学报,2008,32 (1):13-18.
[10]Snieszko S F,Bullock G L,Hollis E,et al.Pasteurella sp.from an epizootic of white perch(Roccus americanus)in Chesapeake Bay tidewater areas[J].J Bacteriol,1964,88 (1):1814-1815.
[11]Lewis D H,Grumbles L G,McConnell S,et al.Pasteurella-like bacteria from an epizootic in menhaden and mullet in Galveston Bay[J].J Wild Dis,1970,6(1):160-162.
[12]Magarinos B,Romalde J L,Bandin I, et al.Phenotypic,antigenic,and molecular characterization ofPasteurella piscicidastrains isolated from fish[J].Appl Environ icrobiol,1992,58 (10):3316-3322.
[13]Tung M C,Tsai S S,Ho L F,et al.An acute septicemic infection ofPasteurellaorganism in pond-cultured Formosa snake-head fish (Channa maculataLacepeda)in Taiwan[J].Fish Pathol,1985,20 (1) :143-148.
[14]Liu P C,Lin J Y, Lee K K.Virulence ofPhotobacterium damselaesubsp.Piscicidain culture cobiaRachycentra canadum[J].J Basic Microbiol,2003,43(6):499-507.
[15]Magariños B,Couso N,Noya M,et al.Effect of temperature on the development of pasteurellosis in carrier gilthead seabream (Sparus aurata) [J].Aquaculture,2001,195 (1) :17-21.
[16]Mladineo I,Miletic I,Bocina I.Photobacterium damselae subsp.piscicida outbreak in cage-reared Atlantic bluefin tunaThunnus thynnus[J].Journal of Aquatic Animal Health,2006,18(1):51-54.
[17]Puttinaowarat S,Thompson K D,Kolk A,et al.Identification ofMycobacteriumspp.isolated from snakehead,Channa striata,and Siamese fighting fish,Betta splendens,using polymerase chain reaction reverse cross blot hybridization (PCR-RCBH) [J].Journal of Fish Diseases,2002,25(4):235-243.
[18]常藕琴,石存斌,潘厚军,等.乌鳢诺卡氏菌病的组织病理学[J].水产学报,2008,32 (2):209-216.
[19]秦蕾,王印庚,张晓君.迟钝爱德华氏菌感染大菱鲆的病理学研究[J].中国水产科学,2009,16 (3):411-419.
[20]金珊,蔡完其,於宏,等.大黄鱼溶藻弧菌病细胞病理变化的初步研究[J].海洋科学,2003,27 (2):59-62.
[21]李海燕,黄文芳.鳜细菌性烂鳃病的鳃、肝、肾组织病理研究[J].华南师范大学学报,1999,(3):67-73.
[22]刘振勇,谢友佺,林小金.大黄鱼肝脏病变组织病理学观察[J].海洋水产研究,2007,28 (5):7-11.
[23]Hawke J P,Plakas S M,Minton R V,et al.Fish pasteurellosis of cultured striped bass (Morone saxatilis) in coastal Alabama[J].Aquaculture,1987,65 (3):193-204.
[24]Toranzo A E,Barreiro S,Casal J F,et al.Pasteurellosis in cultured gilthead seabream (Sparus aurata):first re-port in Spain[J].Aquaculture,1991,99 (1):1-15.
[25]Vassilis B,Zarco P,Hamish R,et al.First report of fish Pasteurellosis from Malta [J].Journal of Aquatic Animal Health,1997,9 (1):26-33.
