东山湾海水中Fe(II)和Fe(III)相互转化围隔实验研究
2012-03-14黄旭光李顺兴陈乙平蔡添寿
黄旭光,李顺兴,陈乙平,蔡添寿
(1.漳州师范学院 化学与环境科学系,福建 漳州 363000;2.厦门大学 近海海洋环境国家重点实验室,福建 厦门 361005)
铁是海洋浮游植物的微量营养和催化元素[1],它在某种程度上可以限制海洋的初级生产力,又可诱发海洋赤潮的发生[2-3]。大量的研究证明了大洋中高营养盐低叶绿素的海区中浮游植物的生长均受到铁元素的限制[4-8]。施铁实验证明铁可以激发这些海域的浮游植物特别是硅藻的迅速增殖[9]。
海水中铁的存在形态按颗粒直径可以分为:溶解态、胶体态和颗粒态。一般认为浮游植物只吸收可溶性的铁元素,胶体态和颗粒态等只有被溶解释放后才能供给浮游植物生长。而海水中高达 99%的铁元素均以胶体态和颗粒态存在[10]。大量的研究认证了海水中可溶性铁对海洋中浮游植物的生长有很强的控制作用[11-13]。溶解态的铁有游离的 Fe(II)、Fe(III)以及其水解产物等,这些均为生物可直接利用的铁。浮游植物通过细胞膜上的运输位点吸收海水中的溶解态 Fe(II)和Fe(III)[14]。海水中的Fe(II)会在短时间内迅速氧化成 Fe(III),使其在海水中往往维持一个较低的浓度,水体中相当浓度的Fe(II)也可来源于 Fe(III)的还原生成[15]。大量的研究表明水体中影响铁形态的因素有pH值、光照、有机物等[15]。极少的研究关注了水体中的浮游植物对铁元素的形态及价态的影响。李顺兴等[16-18]的相关研究认为浮游植物能引发微量元素的光还原和光溶解。
目前关于微量金属形态和价态的研究集中在野外试验。但是野外的试验由于存在许多不可控因素,直接的野外试验存在很大的不足。因此,用围隔试验来研究微量元素的价态转换是一个很好的方法[19]。因为它容易控制,受外界环境影响比较小,不易发生大的变化。本文将调查分析东山湾海水中Fe元素价态和含量与相关参数间的相关性,通过围隔试验分析 Fe浓度和价态动态变化与相关参数间的关系,探讨浮游植物对Fe的浓度和价态的影响机制。
1 材料与方法
1.1 样品采集与分析
样品采集区域如图1。样品采集时间为2008年8月,11月。用采水器采集表层海水5L备测。各采样点硝酸盐、亚硝酸盐、活性磷酸盐、氨氮、叶绿素a、浮游植物等参数的测定均按照《海洋监测规范》(GB 17378- 2007)[20]。
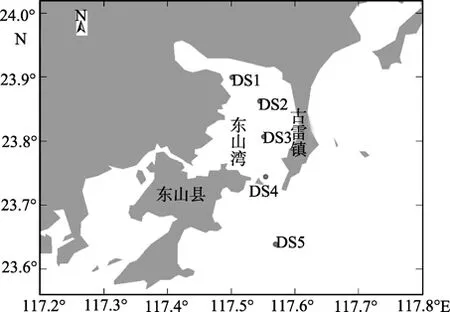
图1 采样站位分布Fig.1 Location of the sampling stations
Fe(II)测定:25 mL比色管中加入 10 mL样品(0.45 µm醋酸纤维膜过滤滤液)、加入1 mL 1%盐酸溶液,1 mL 0.1%NH4F水溶液、加入2 mL 0.1%邻菲罗啉水溶液,加入5 mL pH 4.5NaAC- HAC缓冲溶液稀释到刻度,取上清液在 515 nm处分光光度法测定[21]。
总溶解铁测定:25 mL比色管中加入10 mL样品(0.45 µm醋酸纤维膜过滤滤液),加入1 mL 1%盐酸溶液,加入 1 mL 5%抗坏血酸静置 5 min,加入 2 mL0.1%邻菲罗啉水溶液,加入 5 mL pH4.5 NaACHAC缓冲溶液稀释到刻度,取上清液在515 nm处分光光度法测定[21]。
Fe(III)浓度:为总溶解铁浓度减去 Fe(II)浓度即为Fe(III)浓度。
1.2 围隔实验
2008年8月,采取DS2和DS5站位的表层海水作为围隔实验取水地。先将聚乙烯材料制成的围隔袋固定于近岸渔排装置上,接着向聚乙烯围隔袋内倒入DS2和DS5站位的表层海水50L。每隔3 h对围隔中Fe(II)与Fe(III)的含量及各参数进行测定。
1.3 围隔加富实验
2008年8月,采取DS2和DS5站位的表层海水作为围隔加富实验取水地。同时取两处表层海水用GF/F膜过滤去除浮游植物的海水做对照,进行围隔加富实验(装置同 1.2)。4种海水分相等 2部分各50 L(共8个处理),分别投入无机Fe(II)(FeSO4﹒7H2O),Fe(III)(Fe2(SO4)3)离子,添加可溶解态 Fe(II),Fe(III)分别为20 μg/L。分别监测海水中以上可溶解态Fe(II)与Fe(III)的含量及各参数。
2 结果与分析
2.1 各参数在东山湾的分布特征
表1显示了所测的营养盐、叶绿素及 Fe(II)和Fe(III)在研究区域的分布状况。除DS1点外,其余采样点均表现为夏季营养盐高于秋季。DS1为漳江入海口位置,其受漳江水源影响较大,营养盐浓度主要受益于漳江江水流入。东山湾海域内夏、秋季活性磷酸盐的含量为 0.019~0.075 mg/L,总氮盐含量分布在0.213~0.626 mg/L之间。DS5区域氮、磷浓度较低,为贫营养程度[22],与之相比 DS2区域营养盐浓度均较高,这反映了东山湾海区内养殖业对海水质量的影响。东山湾内,从DS1~DS3区域均为海水养殖区域,特别是DS2区域,海水养殖密度最高。该区域养殖产品主要为鲍鱼等经济鱼类,为了保证鲍鱼的旺盛生长,渔农往往投入过量的饲料,大多数未被鲍鱼食用的饲料会在海水中分解,从而使该区域营养盐浓度升高。DS4为东山湾与外海海水交汇区域,由于海水流速较大,不适合养殖经济鱼类。该区域受到海水养殖污染影响较小。DS5区域为东山湾开放海域,其受到东山湾养殖污染很小,其营养盐浓度偏低,可作为低营养对比研究。
分析了各参数与 Fe(II)和 Fe(III)浓度间的相关性。如图2~图4所示,虽然可溶性总铁浓度与叶绿素 a浓度无明显相关性,但 Fe(II) 浓度及其在总溶解铁中所占比例与浮游植物叶绿素 a呈正相关性,其相关系数分别为0.7959(P<0.05)和0.9219(P<0.001)。东山湾由于受到养殖污染影响,海水营养盐浓度较高,海水中浮游植物生长也较旺盛。浮游植物生长过程中Fe也发挥着极为重要的作用[11-12]。在海水的环境下,高价Fe离子经过还原形成较易为生物可利用形式后方能被浮游植物吸收利用。该结果与李顺兴等的研究结果相似,他们认为海水中浮游植物会诱发海水中 Se(VI)和 Sb(V)被光还原成 Se(IV)和Sb(III)[16-17]。浮游植物较多,生长越旺盛引起Fe(III)还原Fe(II)的能力越强,其浓度及其在总溶解态铁中的比例也越高[15]。
对各采样点浮游植物所属种类及细胞数进行了观察统计分析如表2。结果显示,DS2采样点浮游植物细胞数均远高于其他区域,其细胞数量为 DS5采样点的 2.9~3.8倍。这主要与两采样点营养盐浓度相关。DS2与DS5两处浮游植物种类数相差不大,均小于 DS1处。DS1为淡水与海水生态交错区域,生物多样性较高。各采样点浮游植物组成无明显差异,其中硅藻细胞总数均占总细胞数的80%以上。

表1 东山湾营养盐、叶绿素a及Fe(II)、Fe(III)含量Tab.1 Concentrations of various nitrogen nutrients,chlorophyll a,Fe(II),and Fe(III) in Dongshan Bay
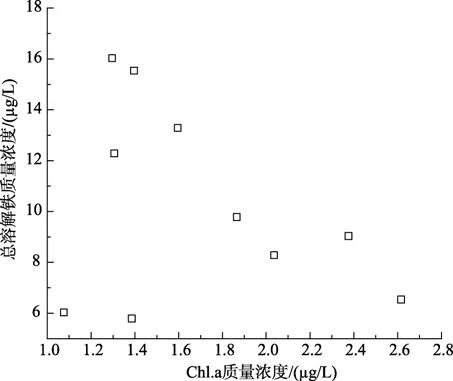
图2 总溶解铁与叶绿素a含量相关性Fig.2 Correlation of concentrations of dissolve Fe and Chl.a

图3 Fe(II)在总溶解铁中的比例与叶绿素a间的相关性Fig.3 Correlation of percentage of Fe(II) and Chl.a
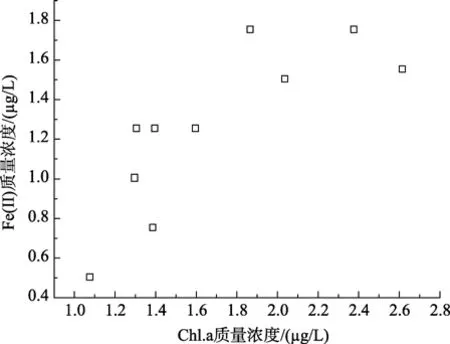
图4 Fe(II)浓度与叶绿素a间的相关性Fig.4 Correlation of concentrations of Fe(II) and Chl.a
2.2 现场围隔实验
图5~图7分别显示了围隔实验时,DS2和DS5站点海水在一天中总溶解铁、Fe(II)浓度及其在总溶解铁中的比例的变化情况。由图可以看出,两海水中的总溶解铁的含量在中午 1点左右到达最低值,总溶解铁减少量为11.5%和17.4%。最高值与初始值相比较,叶绿素a较高的DS2站点海水中Fe(II)浓度增加较叶绿素a较低的DS5站点高0.053 µg/L。随后总溶解铁的含量逐渐回升。经过24 h后,总溶解铁依然减少约7.7%和8.7%。这可能是随着光照强度的增加,海水中的浮游植物生长速度加快,迅速繁殖的浮游植物加速了对海水中可溶解铁的大量吸附、吸收,使得海水中可溶解铁的含量迅速减少。随后,海水中胶体态或颗粒态中的铁在光溶解作用下,释放大量的Fe(III),补充了海水中的溶解铁。
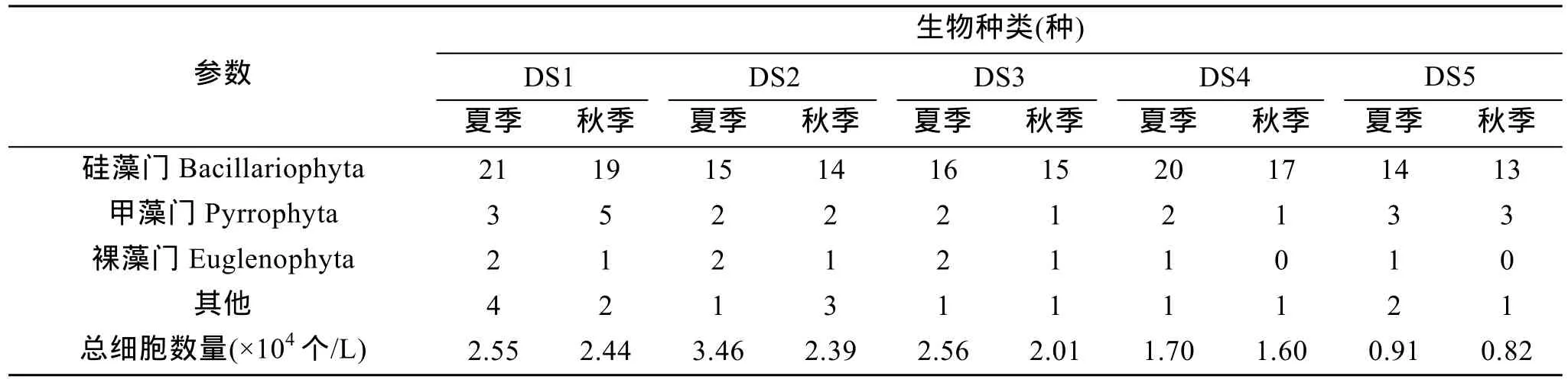
表2 浮游植物种类及细胞数统计Tab.2 Statistics of phytoplankton genus and cells

图5 总溶解铁在24 h内含量变化Fig.5 Variation of total dissolve iron in 24 hours
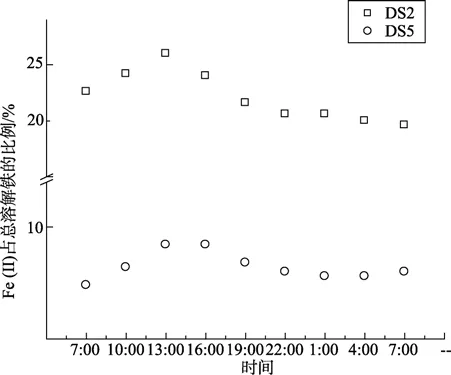
图6 Fe (II)占总溶解铁的比例24 h内变化Fig.6 Variation of percent of Fe (II) in 24 hours
DS2海水中Fe(II)浓度及其在总溶解铁中的比例基本成一致的变化规律。DS2和DS5两站点海水中的变化幅度存在差异。随着光照增强(最大光照值为7.8×104lx),到最大值时 DS2站点海水中 Fe(II)浓度及其在总溶解铁中的比例增加量分别是DS5站点的5.30与1.88倍。海水中的Fe(II)浓度相当一部分来源于Fe(III)的还原[15]。Fe(III)的直接光还原反应如下所示:
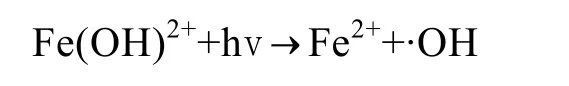

图7 Fe (II) 浓度在24 h内的变化Fig.7 Variation of Fe (II) concentration in 24 hours
光照强度和时间的加强促进了以上反应的增强[18],因而海水中的Fe(II)浓度及其在总溶解铁中的比例均升高。24 h后,对DS2和DS5站点海水中的叶绿素a进行测定。数据显示,DS2围隔中叶绿素增加量比DS5高出6.8%。该结果进一步解释了浮游植物叶绿素 a的增加会加速以上反应的进行,是因为浮游植物在光合作用的同时促进了以上光还原反应速度[16-17]。
2.3 围隔加富实验
表3为对DS2和DS5海水进行围隔铁加富实验结果。各添加了Fe(II)和Fe(III)两种价态的铁离子。海水中存在的浮游植物生长需要吸收海水中铁。24 h后,各海水中的溶解态铁均存在不同程度的减少(无浮游植物的对照海水中减少量较小)。DS2海水中其浮游植物的种类和数量均高于 DS5中,使得该海水中溶解铁的减少量高于 DS5。较多的浮游植物生长的同时吸附、吸收较多的溶解态铁。
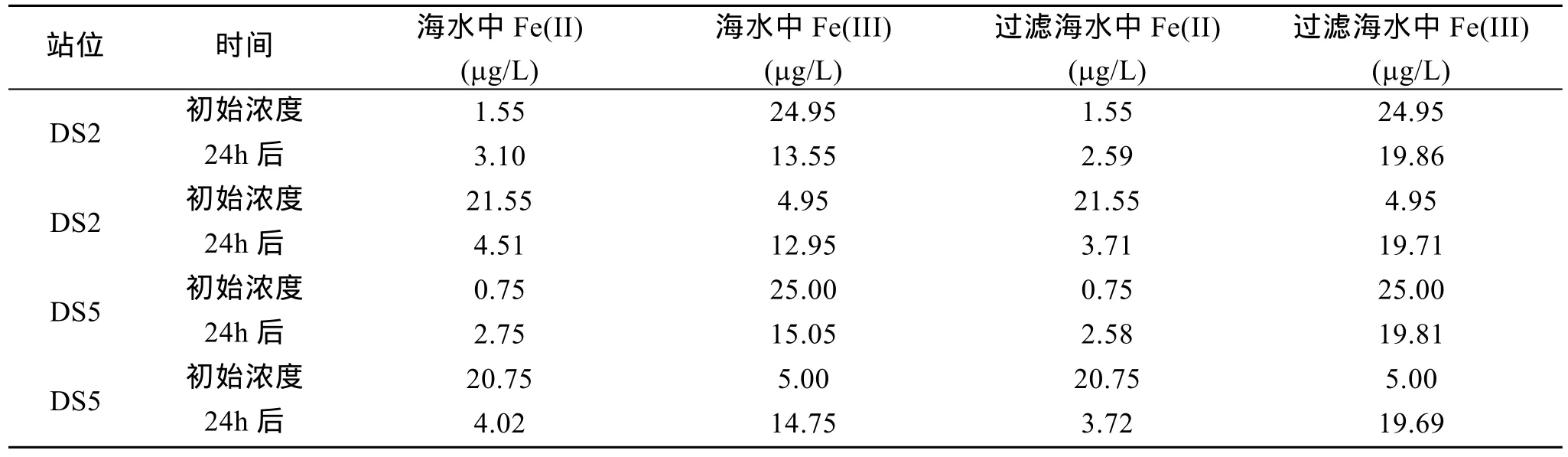
表3 添加Fe(II)和Fe(III)浓度24 h后相互转化Tab.3 Transform of Fe (II) and Fe (III) after different iron addition
由表3可见,添加Fe(III)到DS2和DS5站点海水中。24 h后,溶液中的Fe(II)浓度均小幅升高,且DS2中升高的量要高于 DS5。海水中的浮游植物偏好于吸收海水中的铁的形态为 Fe(II),可见海水中存在着大量的Fe(III)还原成Fe(II)。这主要来源于海水中的浮游植物在光照下对 Fe(III)的还原作用[15-18]。如表3所示,无论是DS2还是DS5海水中,无浮游植物的对照海水中 Fe(II)浓度均小于含浮游植物的试验组。可见,海水中的浮游植物的存在加速了Fe(III)的光还原过程。目前有两种机制来解释海洋中的浮游植物在Fe(III)转化成Fe(II)中的作用:(a)海洋浮游生物细胞表明存在广泛多样 Fe(III)还原复合酶[23-25];(b)海洋浮游植物细胞表面的酸性基团既能结合铁离子又能作为电子供体参与高价铁离子的还原。浮游植物细胞表面的芳香簇酸性基团在光照的作用下形成羟自由基[26],这些羟自由基和有机物按照以下的反应机理使得Fe(II)浓度增加:

添加Fe(II)到DS2和DS5两海水中,24 h后,溶液中的 Fe(II)浓度大幅减少,Fe(III)浓度明显升高,且两海水中变化差异不明显。这主要是因为海水中Fe(II)体系热力学稳定性较差,大量的 Fe(II)迅速被氧化[27]。
3 结论
(1)东山湾夏、秋季海水中的总溶解铁、Fe(II)浓度及其在总溶解铁中的比例均无明显差异。各采样点 Fe(II)浓度及其在总溶解铁中的比例均与海水中叶绿素 a浓度成正相关性,相关系数为 0.7959、0.9219。东山湾海水中的浮游植物以硅藻为主,占总浮游植物细胞总数的80%以上。
(2)围隔实验证明,总溶解铁的浓度随着光照强度的增加而减少,但Fe(II)浓度及其在总溶解铁中的比例均增加。浮游植物的存在促进了 Fe(III)被光还原成Fe(II),浮游植物越多,光还原反应越强。
(3)围隔加富实验证明,添加的 Fe(II)能在海水中被氧化成Fe(III),Fe(III)能在浮游植物的诱导下光还原成 Fe(II),浮游植物越多,还原产物 Fe(II)浓度及其在总溶解铁中的比例越高。
[1]杨东方,谭雪静.铁对浮游植物生长影响的研究进展[J].海洋科学,1999,23(3):48-49.
[2]林昱,庄栋法,陈孝麟,等.初析赤潮成因研究的围隔实验结果——几个理化因子与硅藻赤潮的关系[J].海洋与湖沼,1994,25 (2):139-145.
[3]唐松.印度洋海水营养盐添加模拟实验中浮游植物生长的营养盐限制作用[J].海洋科学,2010,34(7):34-40.
[4]Boyd P W.The role of iron in the biogeochemistry of the Southern Ocean and equatorial Pacific;A comparison of in situ iron enrichments[J].Deep Sea Research II,2002,49:1803-1821.
[5]Hannon E,Boyd P W,Silvoso M,et al.Modeling the bloom evolution and carbon flows during Soiree:Implications for future in situ iron enrichments in the Southern Ocean[J].Deep Sea Research II, 2001,48:2745-2773.
[6]Bowie A R,Maldonado M T,Frew R D,et al.The fate of added iron during a mesoscale fertilization experiment in the Southern Ocean [J].Deep Sea Research II,2001,48:2703-2743.
[7]Timmermans K R,Gledhill M,Nolting R F,et al.Responses of marine phytoplankton in iron enrichment experiments in the northern North Sea and northeast Atlantic Ocean [J].Marine Chemistry,1998,61:229-242.
[8]Martin J H.The case for iron [J].Limnol Oceanorg,1991,36:1793-1802.
[9]Boyd P W,Watson A J,Law C S,et al.A mesoscale phytoplankton bloom in the polar Southern Ocean stimulated by iron fertilization [J].Nature,2000,407:695-702.
[10]张莉,杨桂朋.海洋中铁、锰、铜等过渡金属元素的光化学研究进展[J].海洋科学,2000,24(10):33-36.
[11]Boye M,Berg M G.Iron availability and the release of iron complexing ligands byEmilianiahuxleyi[J].Marine Chemistry,2000,70:277-287.
[12]周成旭,严小军,陈安敏.亚铁离子对赤潮异弯藻种群消长和部分生化特性的影响[J].海洋科学,2008,32(1):10-18.
[13]Powell R T,Wilson Finelli A.Importance of organic Fe complexing ligands in the Mississippi River plume [J].Estuarine,Coastal and Shelf Science,2003,58:757-763.
[14]袁征,祁建华,张曼平.海水中铁的来源形态及其与浮游植物的相互关系[J].海洋湖沼通报,2003,4:38-48.
[15]王玉珏,杨桂朋.海水中无机物的光化学反应[J].海洋通报,2004,23(2):73-81.
[16]Li Shun-xing,Qian Sha-hua,Huang Gan-quan,et al.Separation and preconcentration of Se(IV)/Se(VI)speciation on algae and determination by graphite furnace atomic absorption spectrometry in sediment and water[J].Fresenius’ Journal of Analytical Chemistry,1999,365(5):469-471.
[17]Li Shun-xing,Zheng Feng-ying,Hong Hua-sheng,et al.Photo-oxidation of Sb(III) in the seawater by marine phytoplankton-transition metals-light system[J].Chemosphere,2006,65(8):1432-1439.
[18]Li Shun-xing,Hong Hua-sheng,Zheng Feng-ying,et al.Effects of metal pollution and macronutrient enrichment on the photoproduction of hydroxyl radicals in seawater by the algaDunaliella salina[J].Marine Chemistry,2008,108:207-214.
[19]邢伟,李敦海,沈银武,等.滇池试验围隔内不同形态铁浓度的变化与物化因子的关系[J].水生生物学报,2006,30(2):20-25.
[20]GB/T 17378- 2007,海洋监测规范[S].
[21]刘淑娟,罗明标,张慧.邻菲啰碄光度法测定环境样品中的形态铁[J].南昌大学学报,2005,29(5):457-466.
[22]曹佳莲,刘宪斌,刘占广,等.天津港南部海区水体富营养化水平评价[J].海洋湖沼通报,2008,(S):121-130.
[23]Maldonado M T,Price N M.Nitrate regulation of Fe reduction and transport by Fe-limitedThalassiosira oceanica[J].Limnology and Oceanography,2000,45(4):814-826.
[24]Shaked Y,Kustka A B,Morel F M.A general kinetic model for iron acquisition by eukaryotic phytoplankton[J].Limnology and Oceanography,2005,50(3):872-882.
[25]Salmon T P,Rose A L,Neilan B A ,et al.The model of iron acquisition:nondissociative reduction of ferric complexes in the marine environment[J].Limnology and Oceanography,2006,51(4):1744-1754.
[26]Li Shun-xing,Zheng Feng-ying,Hong Hua-sheng,et al.Effects of nitrate and phosphate on the biochemical composition of marine phytoplankton[J].Chinese Journal Marine Science,2006,30(1):49-53.
[27]Rose A L,Waite T D.Kinetic model for Fe (II) oxidation in seawater in the absence and presence of natural organic matter[J].Environmental Science and Technology,2002,36:433-444.
