DC-CIK联合化疗治疗结肠癌的临床研究
2012-01-23刘晓琳山东大学附属千佛山医院济南250014
李 莎 李 岩 梁 婧 刘晓琳 (山东大学附属千佛山医院,济南250014)
目前,全球结肠癌的发病率及死亡率处于上升趋势,手术及术后辅助化疗可减缓结肠癌疾病进展。手术及多周期化疗后,患者机体免疫功能受到不同程度的损伤,自体细胞免疫治疗成为结肠癌的重要治疗手段[1]。
树突状细胞是功能强大的专职抗原提呈细胞(Antigen presenting cell,APC),可高效介导对特异性抗原的免疫应答。细胞因子诱导的杀伤细胞具有T淋巴细胞强大的抗瘤活性和非主要组织相容性复合体(MHC)限制性杀瘤的优点。DC-CIK细胞联合培养,具有增殖速度快、杀瘤活性高、杀瘤谱广的优点。本研究通过DC-CIK联合化疗治疗结肠癌,旨在探讨DC-CIK免疫治疗在实体瘤治疗中的有效性和安全性。
1 资料与方法
1.1一般资料 病例入选标准:①按国际抗癌联盟(UICC)1997年分期标准结肠癌TNM分期为Ⅱ、Ⅲ期术后患者;②所有病例术后病理检查证实均为腺癌;③卡氏评分KPS≥70分;④无严重心肺、肝、肾等内科疾病;⑤治疗前常规行腹部CT、全身骨ECT、心电图、血常规及肝肾功能检查正常。
收集2008年1月至2009年12月就诊于山东省千佛山医院肿瘤科的40例Ⅱ~Ⅲ期结肠癌患者符合入选标准,其中男28例,女12例,年龄35~77岁。随机选取20例作为单纯化疗组,仅行化疗,20例作为联合治疗组,给予DC-CIK联合化疗。两组一般情况比较差异无统计学意义(P>0.05),见表1。本临床试验的程序均经医院伦理委员会审查批准,全部受试患者均签署知情同意书。
1.2主要仪器与试剂 流式细胞仪FACS Calibur(美国BD公司);COBE Spectra血液成份分离机(美国 Gambro BCT公司);酶联免疫酶标仪(丹麦DenkeyDragon);Ficoll淋巴细胞分离液(美国Sigma公司);T淋巴细胞亚群检测试剂盒(古巴分子免疫学中心);抗人 IFN-γ、IL-2、IL-6 ELISA 试剂盒(上海森雄科技有限公司)。
1.3DC-CIK细胞培养 DC的体外诱导成熟:用血细胞分离机采集患者外周血单个核细胞(Peripheral blood mononuclear cells,PBMCs),调整细胞密度为2×106ml-1,置于 37℃、5%CO2培养箱中培养 2 小时,将悬浮细胞移出,向培养瓶中加入 GM-CSF、IL-4,每2天换液 1次,并补充相关细胞因子,第6天加入 IFN-γ,诱导 DC成熟。
CIK细胞的体外诱导和扩增:以同样方法采集供者PBMC,用AIMV无血清培养基调整细胞浓度为4×106ml-1,置于37℃、5%CO2培养箱培养2小时。收集悬浮细胞,计数并用RPMI1640培养液调细胞浓度为1×106ml-1,第1天加入IFN-γ,24小时后加入CD3McAb及IL-2,每2天换液1次。

表1 两组临床资料情况比较Tab.1 The clinical data of two groups
DC和CIK共培养:第8天将收获成熟的DC与CIK细胞按照1∶10比例混合共培养6天。细胞培养第0天及每次收集细胞回输前取1 ml样品进行免疫表型检测。
1.4治疗方案 单纯化疗组:化疗方案:奥沙利铂130 mg/m2,静滴2小时滴完,第1天;CF 200 mg/m2,第2~6天;5-Fu 500 mg/m2,静滴4~6小时,第2~6天,21天为1周期,根据患者情况术后辅助化疗4~6个周期。
联合治疗组:患者行化疗前2天血细胞分离机单采外周血单个核细胞,培养 DC-CIK细胞。第3天起开始行化疗。细胞培养第13天时,经细菌、真菌及内毒素检测阴性后收集细胞,将收集的细胞用无菌生理盐水洗涤3次后混悬于含2%白蛋白的200 ml生理盐水中,于第14~16天连续回输3天,1次/天,每次1.5小时内回输完毕,共接受2个疗程DC-CIK细胞治疗。
1.5T细胞亚群及细胞因子水平测定 抽取两组患者治疗前后外周血,应用流式细胞术检测T细胞亚群中 CD3+、CD4+、CD8+、CD16+CD56+效应细胞的比例及CD4+CD25+调节性T细胞比例。ELISA法检测细胞因子IFN-γ、IL-2、IL-6的表达水平,按试剂盒说明书操作。
1.6疗效评定指标 治疗期间定期复查血常规、肝肾功能、肿瘤标志物及结肠镜、腹部B超、螺旋CT,必要时行PET-CT检查以了解肿瘤复发、转移等情况。随访两组患者的局部复发率、生存率。通过测定T细胞亚群及细胞因子水平,评估机体免疫功能的改善情况。比较两组患者周围神经毒性、骨髓抑制、胃肠道反应发生率,毒性反应按 WHO(1998)统一标准分为0~Ⅳ度。观察每次输注DC-CIK细胞过程中及回输后患者有无发热、过敏等不良反应。
1.7统计学分析 数据以±s表示,采用SPSS17.0统计软件包,进行t检验,率的比较采用χ2检验,P<0.05表示有统计学意义。
2 结果
2.1比较治疗后局部复发率、生存率 单纯化疗组随访20例,联合治疗组随访20例,化疗组局部复发率高于联合组,有统计学差异(P<0.05),而1、2年生存率低于联合治疗组,比较无明显差异(P>0.05见表2。
2.2治疗前后对患者外周血T细胞亚群的影响两组患者治疗前后外周血T细胞亚群的变化如表3所示,其中化疗组治疗后外周血 CD3+、CD4+、CD16+CD56+效应细胞和CD4+CD25+调节性T细胞有变化但无显著差异(P>0.05),CD8+效应细胞比例升高,CD4+/CD8+比值下降(P<0.05);而联合组治疗后外周血CD4+(见图1),CD16+CD56+效应细胞的比例(见图2)和CD4+/CD8+比值显著升高(P<0.05),CD8+效应细胞比例下降但无显著差异(P>0.05),CD4+CD25+调节性T细胞比例显著下降(见图3,P<0.05)。
2.3治疗前后对患者细胞因子的影响 如实验结果(表4)示,化疗组治疗后IL-6升高(P<0.05),IFN-γ、IL-2降低,但无显著差异。联合组治疗后IFN-γ较治疗前显著升高(P<0.05),IL-2和 IL-6变化无明显差异。
2.4DC-CIK联合化疗的安全性评价 两组患者治疗后相关毒性反应主要为周围神经毒性、骨髓抑制、胃肠道反应。Ⅰ~Ⅱ度周围神经毒性,主要表现为感觉迟钝和(或)感觉异常(可逆转);Ⅰ~Ⅱ度胃肠道反应主要表现为恶心、呕吐(可控制)。联合组发生率低于化疗组(P<0.05)。骨髓抑制以Ⅰ~Ⅱ度白细胞减少为主,应用重组人粒细胞集落刺激因子(rhG-CSF)后可继续完成治疗。化疗组和联合组发生率无显著差异(P>0.05,见图4)。在 DC-CIK细胞回输过程中及回输后,仅1例患者出现发热,体温38.2℃,持续时间约3~5小时,经对症处理后缓解;未观察到胸闷、低血压、过敏、休克等不良反应,未出现明显肝肾功能、凝血功能受损。
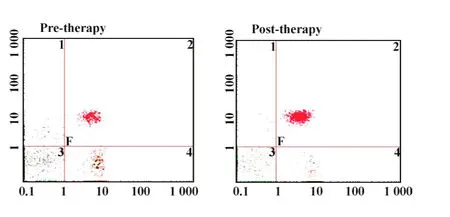
图1 DC-CIK联合治疗前后外周血CD4+T细胞比例Fig.1 The ratios of CD4+cells in combined therapy group before and after therapy

图2 DC-CIK联合治疗前后外周血NK细胞比例Fig.2 The ratios of CD16+CD56+cells in combined therapy group before and after therapy
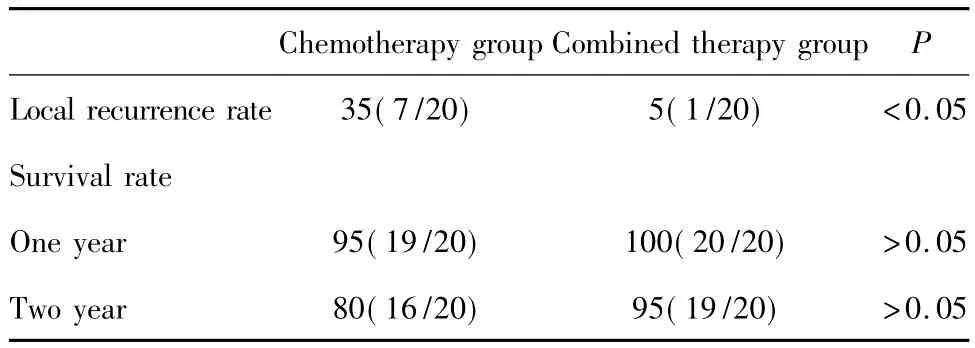
表2 两组患者治疗结束后随访复发、生存情况(%)Tab.2 The rate of recurrence and survival of two groups(%)
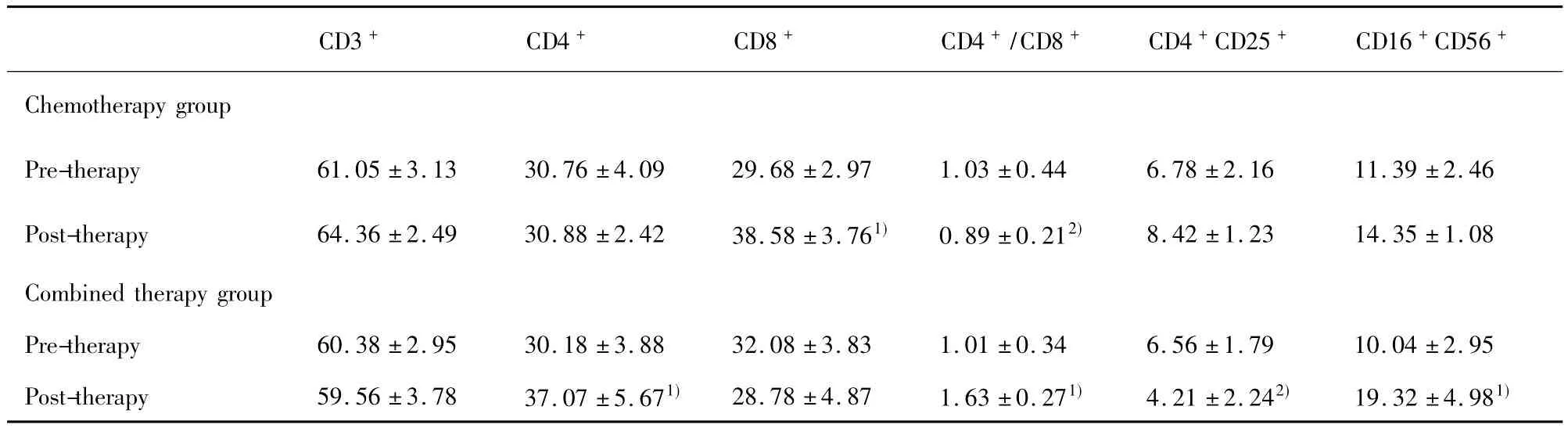
表3 两组患者治疗前后T细胞亚群变化(x ± s,%)Tab.3 Changes of T cell subsets of two groups(x ± s,%)
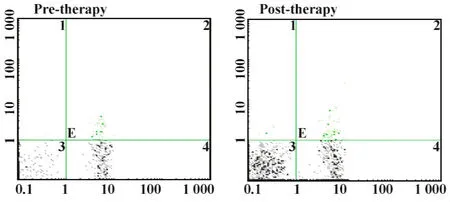
图3 DC-CIK联合治疗前后外周血调节性T细胞比例Fig.3 The ratios of CD4+CD25+cells in combined therapy group before and after therapy
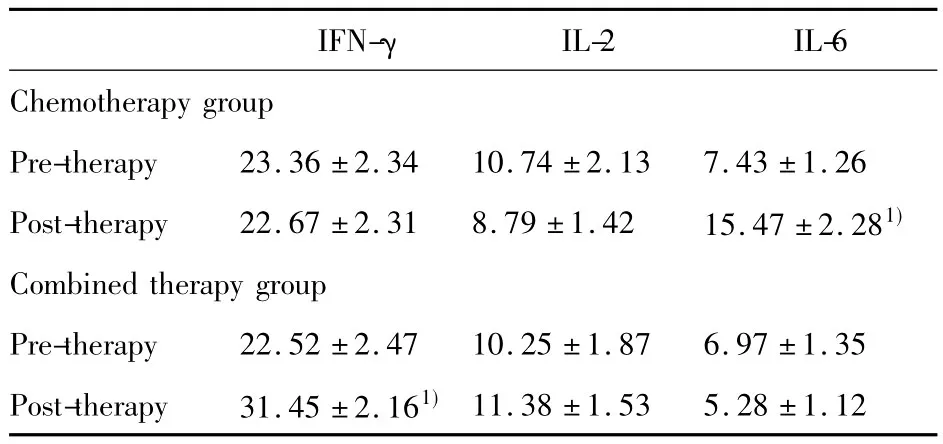
表4 两组患者治疗前后细胞因子变化(x ± s,ng/L)Tab.4 Changes of intra-cellular cytokines of two groups(x ± s,ng/L)
3 讨论
结肠癌是我国常见的消化道恶性肿瘤之一,术后辅助化疗对控制局部复发转移有显著作用,但化疗药物只能杀灭一定比例的肿瘤细胞,很难清除微小残留病变,最终需联合免疫治疗进一步提高疗效。
结肠癌患者的免疫功能常呈现抑制状态,免疫功能越低,越会发生“免疫漂移”(Immune shift)改变[2],即Th1/Th2平衡失调并向 Th2转化,严重影响机体的抗肿瘤能力。成熟T细胞属异质性群体,两个主要亚群,即辅助性T细胞(Th)CD4+和抑制性细胞(Ts)CD8+,CD4+Th细胞根据其分泌细胞因子的不同,分为Th0、Th1、Th2三个亚型。Th0细胞是未成熟的前体细胞,向 Th1、Th2细胞分化。Th1细胞主要分泌 IL-2、干扰素-γ(Interferon-gamma,IFN-γ)和肿瘤坏死因子α、β(Tumor necrosis factor-α、β,TNF-α、β),而 Th2 细胞主要分泌 IL-4、IL-5、IL-6、IL-10。近年来又报道了 Th3 亚型[3],可大量分泌TNF-β、IL-4和IL-10,下调APC及Th1细胞活性,诱导免疫耐受。
CD3存在于所有T细胞表面,可反映CD4+和CD8+T细胞的总体水平。CD4+Th细胞介导细胞毒有关的免疫应答,促进B细胞增殖、分化及产生抗体。一般认为,肿瘤患者外周血的CD8+细胞主要是抑制性T细胞。CD4+/CD8+比值可作为判断机体免疫功能状态的一项重要指标。结肠癌患者CD4+/CD8+比值变小,表明机体免疫功能低下,可能与肿瘤细胞分泌免疫抑制因子,诱导CD8+的产生,同时阻止 CD4+的形成和成熟[4],降低机体抗肿瘤免疫有关。CD4+CD25+调节性T细胞作为免疫抑制细胞,参与肿瘤的免疫逃逸,抑制 CD4+和CD8+T细胞的增殖和活化[5]。肿瘤患者外周血、肿瘤浸润淋巴结调节性T细胞比例升高。NK细胞的特征性表型主要是CD16+CD56+,是机体免疫监视系统的重要组成成份,NK细胞数量减少减弱了机体的免疫机能。

图4 两组患者毒性反应发生率(%)Fig.4 Incidence of side effects of two groups(%)
研究表明,化疗药物诱导的调亡肿瘤细胞能有效诱发免疫应答,对随后的免疫治疗起到增益作用[6]。Marten等[7]发现将同源 DC 和 CIK 细胞共培养后,DC和CIK细胞的增殖能力及CIK细胞的杀伤活性均明显增强。树突状细胞刺激初始T细胞(naive T cells)活化增殖,诱导抗原特异性细胞毒性T淋巴细胞成熟[8]。绝大多数肿瘤患者存在DC数量减少和功能障碍,提示体外诱导足够数量的功能强大的DC用于纠正患者的免疫缺陷成为一种可能。CIK可特异地聚集于肿瘤局部发挥靶向抗肿瘤作用;分泌大量的 Th1 类细胞因子[9],如 IFN-γ、IL-2及IL-12,促进肿瘤细胞对CIK杀伤作用的敏感性;还能分泌IL-6、TNF-α及GM-CSF等细胞因子,增强细胞毒作用。大量研究表明,DC与CIK细胞共同培养后,DC的抗原提呈及激发机体免疫应答的能力提高,CIK的增殖活性和细胞毒作用增强[10]。
本文基于对单纯化疗与DC-CIK联合化疗治疗Ⅱ、Ⅲ期结肠癌同期对照研究,治疗前两组患者临床资料无显著差异,治疗后化疗组局部复发率高于联合组,而1、2年生存率低于联合组,无明显差异,可能是因为病例数较少,随访时间较短,有待今后扩大样本量进一步随访获得相应临床数据。应敏刚等[11]对Ⅰ~Ⅲ期结肠癌术后患者进行了相关研究,DC-CIK联合组和对照组中位生存期分别为63个月(95%CI,55~72)、52个月(95%CI,42~62),Kaplan-Meier生存曲线和Logrank test检验结果表明,联合组生存期明显长于对照组(P<0.05)。因此,联合DC-CIK可降低局部复发率,有可能提高患者的生存率,延长生存期。
从两组患者治疗前后T细胞亚群检测结果看,联合组治疗后外周血CD4+/CD8+比值升高,CD4+CD25+调节性T细胞比例下降,说明联合治疗可使结肠癌患者免疫功能得以恢复与提高,进一步杀伤化疗后那些残存的肿瘤细胞。Th1细胞分泌的IFN-γ可抑制Th2细胞增殖,Th2细胞分泌的IL-6可下调Th1细胞的活性,导致免疫障碍。新近研究显示,DC-CIK 联合治疗可增加 IFN-γ 的表达[12]。本研究与此研究结果一致。DC与CIK细胞共培养后,DC与CIK细胞均被进一步激活,IL-2、IFN-γ分泌显著升高,增加抗肿瘤效应。
此外,联合组患者Ⅰ~Ⅱ度周围神经毒性、胃肠道反应发生率较化疗组明显降低,并在免疫细胞回输过程中仅1例患者出现发热,未发现其他不良反应。因此,DC-CIK联合化疗治疗结肠癌是安全有效的,不仅活化了体内T细胞,增强了肿瘤杀伤力,同时下调了CD4+CD25+调节性T细胞的免疫抑制性,破坏了肿瘤复发、转移的内环境,提高机体整体免疫功能,有良好的应用价值和治疗前景。
1 Qi-Jing Wang,Hui Wang,Ke Pan et al.Comparative study on antitumor immune response of autologous cytokine-induced killer(CIK)cells,dendritic cells-CIK(DC-CIK),and semi-allogeneic DC-CIK[J].Chin J Cancer,2010;29(7):641-647.
2 Yang P,Qiu G,Wang S et al.The mutations of Th1 cell-specific T-box transcription factor may be associated with a predominant Th2 phenotype in gastric cancers[J].Int J Immunogenet,2010;37(2):111-115.
3 Lahdenperä A,Ludvigsson J,Fälth-Magnusson K et al.The effect of gluten-free diet on Th1-Th2-Th3-associated intestinal immune responses in celiac disease[J].Scand J Gastroenterol,2011;46(5):538-549.
4 Hontscha C,Borck Y,Zhou H et al.Clinical trials on CIK cells:first report of the international registry on CIK cells(IRCC) [J].J Cancer Res Clin Oncol,2010;4(21):653-658.
5 Larmonier N,Fraszczak J,Lakomy D et al.Killer dendritic cells and their potential for cancer immunotherapy[J].Cancer Immunol Immunother,2010;59:1-11.
6 Pei Zhou,Ping Liang,Baowei dong et al.Phase I clinical study of combination therapy with microwave ablation and cellular immunotherapy in hepatocellular carcinoma[J].Cancer Biology & Therapy,2011;11(5),450-456.
7 Marten A,Renoth S,von Lilienfeld-Toal M et al.Enhanced lytic activity of cytokine induced-killer cells against multiple myeloma cells after co-culture with idiotype-pulsed dendritic cells[J].Haematologica,2001;86(10):1029-1037.
8 Topalian S L,Weiner G J,Pardoll D M.Cancer immunotheraphy comes of age[J].J Clin Oncol,2011;29(36):4828-536.
9 Franceschetti M,Pievani A,Borleri G et al.Cytokine-induced killer cells are terminally differentiated activated CD8 cytotoxic T-EMRA lymphocytes[J].Exp Hematol,2009;37:616-628.
10 张 丹,何剪太.DC-CIK细胞协同索拉菲尼对肝癌细胞的杀伤作用[J].细胞与分子免疫学杂志,2011;27(6):664-667.
11 应敏刚,魏植强,杨建伟 et al.结直肠癌术后放化疗联合DCCIK 的疗效分析[J].实用癌症杂志,2010;25(3):274-277.
12 Wang Q J,Wang H,Pan K et al.Comparative study on anti-tumor immune response of autologous cytokine-induced killer(CIK)cells,dendritic cells-CIK(DC-CIK),and semi-alogeneic DC-CIK[J].Chin J Cancer,2010;29(7):641-648.