自养小球藻培养条件的优化
2011-12-06张正洁
张正洁, 汪 苹
(北京工商大学食品学院,北京 100048)
自养小球藻培养条件的优化
张正洁, 汪 苹
(北京工商大学食品学院,北京 100048)
在无菌条件下,对影响自养小球藻生长的主要因素进行优化.实验表明,优化结果对小球藻的生长有显著影响.通过正交试验和单因素实验得到了以BG-11培养基为基础的优化培养条件:Na2CO3质量浓度为0.02 g/L、初始pH值为7、N/P为30、接种量为5%、温度25℃、光照强度8 800 lx.该优化条件有效地提高了自养小球藻的生长速率.
小球藻;自养培养;培养基
小球藻为绿藻门(ChloropHyta)小球藻属(Chlorella)的一种单细胞绿藻,其生态分布广,世界上已知的小球藻现有15种左右,加之其变种可达百种之多[1].我国常见的种类有普通小球藻(Chlorella vlgaris)、椭圆小球藻(Ch.ellipsoidea)和蛋白核小球藻(Ch.py-renoidosa).小球藻富含蛋白质、不饱和脂肪酸(亚油酸、亚麻酸、DHA、EPA等)、类胡萝卜素、虾青素和多种维生素[2],具有极高的营养价值和提高免疫力的功效.其中不饱和脂肪酸(PUFA)更具有广泛的生物学活性,具有抗血栓、降血脂等功能,尤其对心脑血管、关节炎等疾病有良好的防治作用.此外,DHA还能促进脑细胞的生长发育,改善大脑机能[3].传统上,深海鱼油是不饱和脂肪酸的主要来源,但从鱼油中提取的不饱和脂肪酸存在腥臭味,且处理过程复杂.微藻作为水体中初级生产力,具有合成不饱和脂肪酸的能力[4],且藻体内PUFA的相对含量远远高于鱼油中的含量,从藻细胞中提取的PUFA产品没有腥臭味,不含胆固醇成分,避免了服用鱼油胶囊时摄入大量胆固醇的缺点.此外,小球藻还含有一种非常重要的成分——小球藻生长因子,它既具有诱发干扰素激发人体防御和免疫组织中的巨噬细胞、T细胞和B细胞的功能,又具有人体对环境污染有害物质解毒和排泄的作用[5].因此,小球藻被联合国粮农组织列为21世纪人类健康食品.
小球藻作为光能自养型生物,可利用CO2作为碳源供其生长,虽多数微藻在CO2环境浓度为1% ~5%时生长良好,但现已发现可将微藻驯化为耐受高浓度CO2的藻种[6],由此对酒精发酵工艺中排出的高纯度CO2(每年约500万吨)吸收利用,既节约了资源,又减少了温室效应的发生.基于小球藻的上述特点,美国、日本、以色列等国家先后开发出现代化的小球藻培养技术并成为小球藻的主要生产国.目前该领域在我国研究较少,国内开展此项工作,其经济效益和社会效益前景广阔[7].
利用小球藻固定CO2并得到高不饱和脂肪酸等产物,需获得大量藻体.本研究以普通小球藻为材料,考察温度、光照强度、接种量、pH值以及营养成分对小球藻生长速率、细胞积累量的影响,寻求最优培养条件,提高小球藻生物量,以期为今后大规模培养小球藻提供参考.
1 材料与方法
1.1 材料
1.1.1 藻种来源
本实验藻种购自中国科学院水生研究所淡水藻库无菌普通小球藻1068藻株(Chlorella vlgaris 1068 strain).
1.1.2 培养基配方
本实验在BG-11培养基的基础上进行优化,1L BG-11培养基由5种储备液(1~5)及NaNO3构成.分别取储备液1:2 mL,2:20 mL,3:2 mL,4:1 mL,5:1 mL及1.5 g NaNO3于容量瓶中定容至1 L,调pH值为7.5.储备液配方如下:
储备液1(g/L) 柠檬酸0.3 g,柠檬酸铁铵0.3 g,Na2-EDTA0.05 g.
储备液 2(g/L) KH2PO41.5 g,MgSO4·7H2O 3.75 g.
储备液 3(g/L) CaCl2·2H2O 1.8 g.
储备液4(g/L) NaCO32 g.
储备液 5(g/L) H3BO32.86 g,MnCl2·4H2O 1.81 g,ZnSO4·7H2O 0.222 g.
NaMoO4·5H2O 0.39 g,CuSO4·5H2O 0.079 g,Co(NO3)2·6H2O 0.049 g.
其中,储备液1,3,4 定容至100 mL;储备液2,5定容至1 000 mL.
1.2 实验方法
1.2.1 生物量的测定
接种后,每日定时于超净工作台取样,以血球计数板法测定小球藻的细胞个数,绘制生长曲线,计算藻体生长速率.计算公式[5]:

式(1)中,K为生长速率,d-1;N0为起始细胞密度,106mL-1;N为经过 t时间的细胞密度,106mL-1;T为平均世代时间,d;t为生长时间,d.
实验采用25×16型血球计数板,细胞密度:N=(80个小格内细胞个数/80)×400×104×稀释倍数.
1.2.2 培养条件的确定
100 mL培养液装于250 mL三角瓶内,121℃灭菌20 min.超静工作台接种、取样,置于25℃光照培养箱中自养培养,光照强度8 800 lx,光暗比为12∶12,每日定时于160 r/min摇床内摇15 min.
1.2.3 正交试验优化培养基
小球藻生长所需的营养元素有15~20种,大多数元素不会成为限制性因子,其中C、N、P是其生长的主要营养元素[5],对小球藻的生长及其产物的积累有较大影响.
小球藻利用空气中的CO2进行光自养生长,CO2主要以HCO-3的形式利用,因此HCO-3盐可作为小球藻生长的碳源[8].空气中CO2体积分数为380×10-6,溶解于水中的 CO2将与空气中的 CO2分压产生平衡,符合亨利定律:
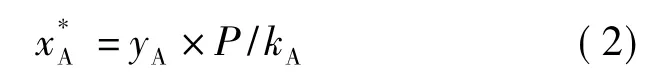
式(2)中,x*A为溶质A在液相中的浓度;P为大气压强,在本实验过程中取标准大气压值101 325 Pa;kA为亨利系数(Pa);yA为溶质A在气相中的浓度.
查得 25℃ 下,Ka=1.66×108Pa,yA=0.038%,P=101 325 Pa.

由计算可知,每100 mL的培养基中均有0.056 mg的CO2溶于水中.自养小球藻利用空气中的CO2供其生长,因此在优化培养基条件时Na2CO3的质量浓度无须过大.
氮、磷是生物生长所需的重要营养成分.一般认为,氮、磷是限制藻类增殖的重要因素,而硝酸盐和磷酸二氢钾一直是培养小球藻的一种普通氮源、磷源,一定的氮磷比将促进小球藻细胞的增长.
培养基的pH值是影响藻类生长代谢等许多生理过程的另一重要因子,并影响光合作用中CO2的可用性[9].小球藻存活的pH值范围为4.5~10.6,pH值较低,碳源主要以CO2和H2CO3的形式存在,不利于小球藻的利用;pH值较高,小球藻细胞易老化,细胞繁殖受到强烈抑制而导致生长缓慢.因此,接近中性的pH值最有利于小球藻的生长[10].,
本实验利用正交试验优化培养基中的Na2CO3浓度、N/P、pH值,并考虑Na2CO3质量浓度和pH值的交互作用,采用L9(34)正交表(表1)进行3因素3水平正交试验.

表1 因素水平表Tab.1 Levels of factors
2 结果与讨论
2.1 营养盐浓度和pH值对小球藻生长的影响
根据表1数据,在光照培养箱中光照培养,接种量为10%、温度25℃,光照强度8 800 lx,光暗比为12∶12,每日定时于160 r/min摇床内摇15 min.培养12 d于超静工作台内取样,血球计数板法测定小球藻的细胞个数并计算细胞密度.实验与直观分析结果见表2.

表2 正交试验与直观分析结果Tab.2 Results and analysis of orthogonal tests
表2中,第3列设计为ρ(Na2CO3)与pH值的交互作用列.4种因素对小球藻生长的影响按级差R的大小排列为ρ(Na2CO3)>ρ(Na2CO3)×pH>N/P >pH,ρ(Na2CO3)及 ρ(Na2CO3)与 pH 值的交互作用对小球藻生长的影响最为显著,pH值和N/P对其生长的影响因素较小,不构成显著影响.
通过比较 K1、K2、K3可知,当 Na2CO3的质量浓度大于0.05 g/L时,小球藻的生物量明显下降,而小于0.05 g/L时,随Na2CO3质量浓度的降低生物量稍有增加,但此趋势明显减缓.由此得出优化培养基配方:ρ(Na2CO3):0.02 g/L;pH 值:7;N/P:30.此结果与正交试验中长势最好的第2组实验条件相同,无需验证.
2.2 正交试验中的交互作用
小球藻通过光合作用将二氧化碳、水和无机盐转化为有机物.二氧化碳主要以HCO-3形式被利用,pH值是影响培养基中HCO-3在总溶解状态的CO2所占比例的主要因素,因此pH值与ρ(Na2CO3)二者将产生一定的交互作用,这与实验结果相符.
据表2可知,按级差R的大小排列,ρ(Na2CO3)与pH值的交互作用对小球藻生长的影响仅次于ρ(Na2CO3).对于如此明显的交互作用在实验中应给予关注.表3为ρ(Na2CO3)与pH值的交互作用表.

表3 ρ(Na2CO3)与pH值交互作用Tab.3 Interaction of ρ(Na2CO3)and pH 106mL-1
由表3可知,Na2CO3质量浓度为0.02 g/L,pH值为7时小球藻的生长密度最高,长势最优.
2.3 接种量对小球藻生长的影响
本实验将9个250 mL三角瓶分为3组,每组接种量分别为5%,10%,15%(V/V),三角瓶装液量为100 mL,置于光照培养箱中培养7 d,每日定时于超净工作台内取样,以血球计数板计数,测定结果取平均值,结果见表4,生长曲线如图1.

表4 不同接种量的测定结果Tab.4 Measured results with different inoculum
提高接种量是缩短延滞期的有效措施之一.一般情况下,接种量越多其延滞期越短,但由于接种量的增加在一定程度上造成了装液量的增加,从而导致液面与空气接触面积减小,影响溶解氧.实验中10%,15%的接种量无论生长速率,还是细胞的积累量均小于5%的接种量,且随接种量的增加,生长速率依次减小,细胞积累量依次降低,由此确定接种量以5%为宜.这与潘欣[10]、张丽君[11]得出的 10%为最佳接种量的结论不符.

图1 接种量对小球藻生长的影响Fig.1 Effects of inoculums on grows of Chlorella.sp
2.4 温度对小球藻生长的影响
微生物的生长和产物的合成都是在各种酶的催化下进行的,温度是保证酶活性的重要条件,因此在微生物发酵系统中必须保证稳定而适合的温度环境条件[11].
在本实验中,取9个250 mL三角瓶分为3组,分别置于20,25,30℃下培养.三角瓶装液量为100 mL,接种量为5%,光照培养箱中培养7 d,每日定时于超净工作台内取样,以血球计数板计数,测定结果取平均值,结果见表5,生长曲线如图2.比较从20~30℃的3种不同温度梯度的培养结果,在25℃的条件下,小球藻的细胞积累量及其生长速率均好于20℃和30℃.因此,当温度为25℃时最适宜自养小球藻的生长.

表5 不同温度下的测定结果Tab.5 Measured results with different temperature
2.5 光照强度对小球藻生长的影响
小球藻作为光合自养型生物,光是影响其生长的重要限制因素.当温度和营养元素不限制其生长时,光就成为影响小球藻自养生长的主要因素.

图2 温度对小球藻生长的影响Fig.2 Effects of temperature on grows of Chlorella.sp
一般情况下,在一定光照范围内藻的光合作用效率会随光照强度的增加而增加,但光照强度达到一定值时,光合作用效率几乎保持在一定水平不再增加,这种现象称为光饱和效应.如果光照强度超过光饱和点后,藻的光合效率将会下降,导致细胞生长缓慢甚至死亡,即光抑制限制.在光饱和点以下的光照强度是藻生长的一个限制性因子[12].
实验中,光照强度分别取4 400,8 800,13 200 lx进行单因素实验,结果见表6,生长曲线如图3.光照强度为8 800 lx时,小球藻长势最好,其生长速率最快,细胞积累量最大.光合作用由光反应和暗反应两个过程组成,当暗反应所需的中间产物不能从光反应中得到充分满足时,整个过程的速率完全取决于光反应的速率,即随着光照强度的增加光合作用加强,小球藻的生长较快;若光反应形成了大量中间产物,而暗反应速率已配合不上光反应速率,此时光合作用的整体速率将只取决于暗反应的大小,同时由于光照强度太强,会导致光合色素的光氧化和细胞中的某些酶受到氧化伤害而使光合作用速率下降,因而存在一个适宜的光照强度[13].

表6 不同光照强度下的测定结果Tab.6 Measured results with different illumination
3 结论
小球藻含有大量陆地生物所缺乏且十分独特的生物活性物质,具有生长快,产量高,可定向培养,适应能力强,易调控等特点,因而是许多高附加值生物制品的重要来源.利用小球藻含有的活性物质已成为目前各国的研究热点之一,其开发利用前景广阔,因此研究在培养过程中如何提高小球藻细胞密度及其生长速率具有重要意义.
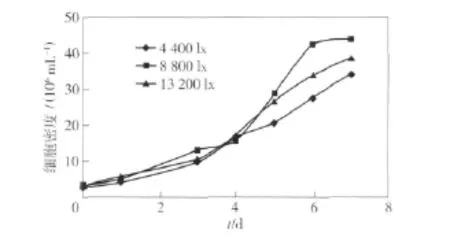
图3 光照强度对小球藻生长的影响Fig.3 Effects of illumination on grows of Chlorella.sp
BG-11培养基适用于小球藻的培养,但培养效果不甚理想.为寻求最佳的培养条件,提高生长速率,缩短培养周期,得到大量藻体,本实验通过3因素3水平正交试验,以及接种量、温度、光照强度单因素实验,得到了以BG-11培养基为基础的优化培养基配方:Na2CO3质量浓度为0.02 g/L、初始pH值为7、N/P为30、接种量为5%、温度25℃、光照强度8 800 lx.实验显示,经优化培养基培养的小球藻的生长速率为0.381 d-1,细胞积累量达到40.95×106mL-1,而在未经优化培养基条件下,其生长速率为0.107 d-1,细胞积累量为5.5 ×106mL-1.速率提高了3.561倍,细胞积累量提高了7.45倍,说明该优化培养基有效地提高了小球藻的生长速率及细胞积累量,为该藻的高密度大规模培养提供了有力依据.
[1]杨桂娟,栾忠奇,周笑辉.温度对小球藻生长量和溶氧量影响研究[J].农机化研究,2009(9):157-158.
[2]陈峰,姜悦.微藻生物技术[M].北京:中国轻工业出版社,1995:55.
[3]温少红,李叙凤,鞠宝,等.微藻高度不饱和脂肪酸的研究进展[J].海洋通报,2000,19(4):86-92.
[4]Zhukova N U.Fatty acid composition of 15 species of marine microalgae[J].Photochemistry,1995,39(2):351-356.
[5]闫海,张宾,王素琴,等.小球藻异样培养的研究进展[J].现代化工,2007,27(4):18-23.
[6]Masaki Ota ,Yoshitaka Kato,Hiromoto Watanabe.Fatty acid production from a highly CO2tolerant alga,Chlorocuccum littorale,in the presence of inorganic carbon and nitrate[J].Bioresource Technology,2009,100:5237-5242.
[7]李师翁,李虎乾,张建军.小球藻大规模培养的研究进展[J].植物学通报,1998,15(4):45-50.
[8]于贞,王长海.小球藻培养条件的研究[J].烟台大学学报:自然科学与工程版,2005(18):206-210.
[9]季祥,张智慧,张雪艳,等.小球藻培养条件的优化[J].安徽农业科学,2009,37(34):16763-16764.
[10]潘欣,李建宏,戴传超,等.小球藻异养培养的研究[J].食品科学,2002,23(4):28-33.
[11]张丽君,杨汝德,肖恒.小球藻的异养生长及培养条件的优化[J].广西植物,2001,21(4):353-357.
[12]余俊棠,唐孝宣,邬行彦,等.新编生物工艺学[M].北京:化学工业出版社,2004:23-26.
[13]王长海.海洋生化工程概论[M].北京:化学工业出版社,2004:23-26.
(责任编辑:叶红波)
Optimization of Culture Conditions of Chlorella.sp
ZHANG Zheng-jie,WANG Ping
(School of Food,Beijing Technology and Business University,Beijing 100048,China)
The effects of culture conditions on the growth of Chlorella.sp were studied.The nutrient factors showed obvious effect on Chlorella.sp.The culture conditions based on BG-11 were optimized by orthogonal experiments:Na2CO30.02 g/L,the initial pH 6,the ratio of nitrogen to phosphorus 30,inoculum 5%,temperature 25℃,illumination 8 800 lx.Under the optimal culture conditions,the growth rate of Chlorella.sp was enhanced significantly.
Chlorella.sp;autotrophic culture;medium
TS201.3
A
1671-1513(2011)01-0054-05
2010-09-13
国家“十一五”科技支撑计划项目(2007BAK36B07).
张正洁,女,硕士研究生,研究方向为小球藻的固碳作用及其产物;
汪 苹,女,教授,主要从事水污染控制工程、废水生物处理及反应器方面的研究.通讯作者.
