蜂胶和铁补充对运动大鼠血液铁状态的影响及蜂胶的抗氧化保护作用
2011-10-18车力龙刘显东沈敏杰顾晓明许化溪肖德生
车力龙,刘 军,刘显东,沈敏杰,顾晓明,解 洋,许化溪,肖德生
(1.江苏大学基础医学与医学技术学院,江苏 镇江 212013;2.江苏大学临床医学院,江苏 镇江 212001)
蜂胶和铁补充对运动大鼠血液铁状态的影响及蜂胶的抗氧化保护作用
车力龙1,刘 军2,刘显东2,沈敏杰2,顾晓明2,解 洋2,许化溪1,肖德生1
(1.江苏大学基础医学与医学技术学院,江苏 镇江 212013;2.江苏大学临床医学院,江苏 镇江 212001)
目的:观察蜂胶和铁补充对运动大鼠血液铁状态指标和血浆自由基代谢的影响,研究蜂胶对运动和/或铁补充过程中产生的氧化损伤的抗氧化保护作用。方法:40只3月龄Sprague-Dawley雄性大鼠,被随机分为5组:对照组(C组)、运动组(E组)、运动补铁组(EI组)、运动补蜂胶组(EP组)和运动补铁同时补蜂胶组(EIP组),每组8只。6周递增负荷跑台训练后检测各组大鼠红细胞指标(红细胞数(RBC)、血红蛋白(Hb)、红细胞比容(Hct))和血浆铁状态指标(血浆铁(PI)和总铁结合力(TIBC));并检测血浆MDA和SOD值。结果:E组红细胞和铁状态指标显著低于C组,MDA值显著高于C组,SOD值显著低于C组。与E组比较,EI组、EP组和EIP组的红细胞、铁状态指标均显著升高;EI组MDA值显著高于E组,SOD值显著低于E组;EP组和EIP组MDA值显著低于E组,SOD值显著高于E组。EIP组MDA值显著低于EI组,SOD值显著高于EI组,但与EP组无显著差异。结论:虽然铁补充能改善运动大鼠贫血和低铁状态,但增加了大鼠氧化应激风险。蜂胶能有效提高机体清除自由基能力,减少脂质过氧化,增强抗氧化酶活性;对改善运动大鼠贫血和低铁状态也有一定作用。
蜂胶;铁补充;运动大鼠;铁状态;抗氧化
铁是人体必需的微量元素之一,是构成血红蛋白、肌红蛋白、细胞色素和与呼吸链能量代谢相关的许多酶的重要成分,因此,铁缺乏或低铁状态影响人体氧运输、能量代谢、血红素代谢、细胞信息传递和免疫功能,而且由于最大氧摄入和肌细胞的氧化代谢能力降低,从而影响运动人体的运动速度、运动耐力、运动成绩或最大操作能力[1-2]。长期高强度大运动量训练运动员缺铁性贫血发病率高于普通人群,或者虽然没有达到贫血程度,但出现运动性低铁状态,影响运动能力和运动耐力[3-4]。因此,运动营养学界和运动医学界普遍建议给运动员补充铁来纠正运动贫血或运动性铁缺乏。但补铁会增加体内自由基产生[5],加之剧烈运动过程中自由基产生显著增加[6],双重影响效应叠加会进一步加重补铁运动员体内氧化应激反应,增加运动损伤机率,影响运动成绩,并严重影响运动员身体健康。因此,寻找合适的既具有抗氧化应激能力,又不影响甚至促进运动员补铁效果的运动保健品或运动食品一直是运动界追求的目标。
蜂胶是蜜蜂从植物芽孢和树干处采集的树胶,并混入蜜蜂上颚腺分泌物和蜂蜡经咀嚼加工而成的一种天然活性物质。已有多个研究显示,食用蜂胶是安全的,无明显毒副作用,不产生免疫抗原性反应[7-8]。临床医学实践中长期将蜂胶作为保健食品和药物配伍成分。蜂胶成分复杂,含有大量的黄酮类、萜烯类、氨基酸、多种维生素和微量元素,具有很强的增强机体免疫功能,防御机体氧化损伤[9],调理胃肠功能,改善胃肠吸收能力,治疗消化道溃疡和治疗贫血的作用[10]。也有关于蜂胶促进小鼠力竭运动后疲劳恢复的报道[11]。因此,本实验将蜂胶与补铁剂单独或同时饲喂运动大鼠,观察蜂胶和补铁剂单独或联合作用对运动大鼠的补铁效果、自由基代谢的影响及蜂胶在运动补铁过程中的抗氧化保护作用。
1 材料与方法
1.1 材料与试剂
蜂胶:超临界CO2萃取方法制备的江大蜂胶软胶囊,内容物为金黄色。每颗胶囊含蜂胶500mg。成人(按60kg体质量计)推荐剂量为每天两颗,相当于16.7mg/kg。
蜂胶 江大源生态生物科技有限公司;大鼠颗粒饲料 南京医药生物工程有限公司;血细胞记数板 上海求精生化试剂仪器有限公司;氰化高铁血红蛋白检测试剂盒 天津一方科技有限公司;血浆总铁结合力试剂盒、MDA试剂盒和SOD试剂盒 南京建成生物工程研究所;其余试剂均为分析纯。
1.2 仪器与设备
722分光光度计 上海光学仪器厂;原子吸收分光光度计 北京普析通用仪器有限责任公司;大鼠跑台 北京硕林苑科技有限公司。
1.3 方法
1.3.1 实验动物
清洁级3月龄Sprague-Dawley雄性大鼠,体质量200~220g,由江苏大学实验动物中心提供。饲喂专用大鼠全价营养颗粒饲料,普通木屑垫料,带栅网标准大鼠饲养笼饲养,5只/笼。室温(22±1)℃,相对湿度(50±5)%,12h光照时间(6:00—18:00)和12h黑暗时间交替的昼夜光节律。
1.3.2 动物分组
大鼠适应实验室环境2d后进行适应性训练3d,10、15min/d。训练期间使用声音、小木棍、110V电刺激大鼠,确保其运动连续性和运动强度。然后筛选体质量相近、健康活泼、能适应跑台训练的大鼠40只作为正式实验动物,数字表法将大鼠随机分成5组:对照组(C组)、跑台运动组(E组)、跑台运动补铁组(EI组)、跑台运动补蜂胶组(EP组)和跑台运动补铁补蜂胶组(EIP组),每组8只。训练期间E组有一只大鼠脚趾受伤出血被淘汰。
1.3.3 运动模型制作
参考赵杰修等[12]的方法,大鼠进行递增负荷跑台训练。动物跑台坡度为0度,跑台速度为30m/min,每周训练6d,训练6周。前两周每天上午训练1次,后4周每天上、下午各训练1次。第1次训练时间为1min,之后每次以2min/次递增训练时间,最后1次训练时间为119min。训练过程中大鼠出现严重力竭症状(连续施加机械刺激大鼠不能继续跑动,下台后后腹部触地严重,成“甲鱼状”)时允许其休息2~5min,直到完成预定的训练计划。
1.3.4 铁剂和蜂胶的处理
参考刘戌年[13]的方法,按照50mg/(kg·d)用量给EI组和EIP组大鼠灌胃生理盐水配制的FeSO4混悬液。参考人体与动物用药剂量换算方法,给EP组和EIP组大鼠灌胃色拉油配制的蜂胶混悬液,剂量为100mg/kg。C组和E组大鼠灌胃等量生理盐水。灌胃时间为上午运动前3h左右。
1.3.5 样本收集和各项指标测试
最后一次运动结束24h后,用戊巴比妥钠溶液麻醉大鼠,心脏采血,肝素抗凝。部分血液生理盐水稀释,血细胞记数板法记数红细胞数(RBC);高铁氰化钾法测血红蛋白值(Hb);毛细管法测红细胞比容(Hct)。剩余血液3000r/min离心10min分离血细胞和血浆,原子吸收分光光度法测定血浆铁(PI)、血浆总铁结合力(TIBC),然后按照下式计算血浆转铁蛋白铁饱和度(TS)。严格按照试剂盒说明测定血浆MDA和SOD浓度。

式中:ρ1为血浆铁的质量浓度/(μg/mL);ρ0为血浆总铁结合力的质量浓度/(μg/mL)。
1.4 统计分析
采用SPSS 16.0统计分析软件分析实验数据,ANOVA方差分析,LSD法组间比较,P<0.05为组间差异显著性标准。所有结果数据均用±s表示。
2 结果与分析
2.1 蜂胶和补铁对运动大鼠血液RBC、Hb和Hct的影响

表1 蜂胶和补铁对运动大鼠RBC、Hb、Hct的影响Table 1 Effects of propolis and iron supplements on RBC, Hb and Hct of exercise rats
表1显示,E组大鼠RBC、Hb和Hct值均极显著低于C组(P<0.001),表明采用的运动模型明显降低了大鼠血液红细胞和血红蛋白水平。EI组大鼠的RBC、Hb和Hct值显著高于E组大鼠(P<0.01或 P<0.001或P<0.05),EP组大鼠的RBC、Hb和Hct值显著高于E组大鼠(P<0.01或P<0.001或P<0.05),EIP组大鼠的RBC、Hb和Hct值显著高于E组大鼠(P<0.001或P<0.001或P<0.01),表明无论是单纯补充铁剂或单纯补充蜂胶,还是铁剂和蜂胶联合补充,都能明显改善运动大鼠红细胞和血红蛋白状态。EI组RBC和Hct值与C组有差异(P<0.05),EP组RBC、Hb值与C组有差异(P<0.05或P<0.01),而EIP组RBC、Hb、Hct值与C组均无差异(P>0.05),表明蜂胶和铁剂联合补充对于改善运动大鼠贫血状态效果最好,基本恢复到对照组水平。
2.2 蜂胶和补铁对运动大鼠血浆铁状态指标的影响
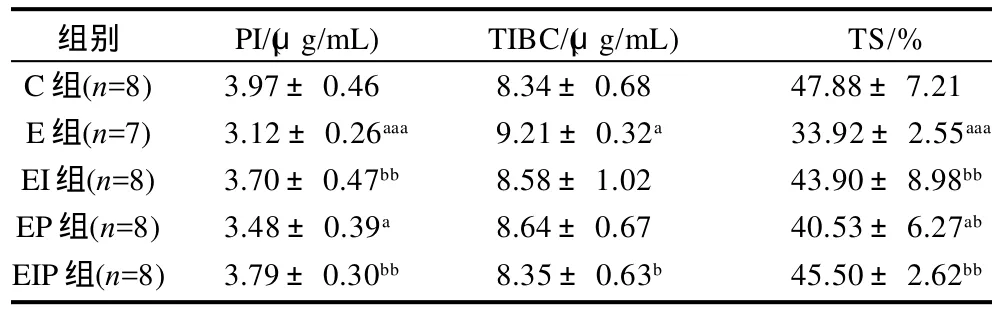
表2 蜂胶和补铁对运动大鼠血浆铁状态指标的影响Table 2 Effects of propolis and iron supplements on iron status in blood plasma of exercise rats
从表2可以看出,E组大鼠PI和TS值均非常显著低于C组大鼠(P<0.001),TIBC值显著高于C组大鼠,表明递增负荷运动导致了明显的运动性低铁状态。EI组大鼠PI和TS值显著高于E组大鼠(P<0.01),比C组大鼠低,但无显著性差异(P>0.05);EP组大鼠TS值显著高于E组大鼠(P<0.05),但PI和TS值均低于C组大鼠(P<0.05);表明单纯补充蜂胶也能改善大鼠血浆铁状态,但仍低于C组水平。EIP组大鼠PI和TS值显著高于E组大鼠(P<0.01),TIBC值显著低于E组大鼠(P<0.05),EIP组大鼠血浆3项铁状态指标与C组大鼠均无显著差异(P>0.05),表明铁剂与蜂胶联合补充改善运动性低铁状态的效果最好。
2.3 蜂胶和补铁对运动大鼠血浆MDA和SOD水平的影响

表3 蜂胶和补铁对运动大鼠血浆MDA和SOD水平的影响Table 3 Effects of propolis and iron supplements on MDA content and SOD activity in blood plasma of exercise rats
表3显示,E组大鼠血浆MDA水平显著高于C组(P<0.001),而SOD水平显著低于C组(P<0.01),表明递增负荷运动引起大鼠体内脂质过氧化反应加强,抗氧化活性降低,对机体造成了氧化损伤。EI组大鼠MDA水平显著高于E组大鼠(P<0.01),SOD水平显著低于E组(P<0.05),表明补铁进一步加剧了运动诱导的氧化应激损伤。EP组大鼠MDA水平低于E组大鼠(P<0.05),SOD水平显著高于E组大鼠(P<0.01);EIP组大鼠MDA水平显著低于EI组大鼠(P<0.001),与C组大鼠无显著差异(P>0.05);EIP组大鼠SOD水平显著高于EI组(P<0.001)和E组大鼠(P<0.05),比C组大鼠SOD水平稍高,但差异不显著(P>0.05),表明蜂胶补充对运动大鼠和运动补充铁剂大鼠的氧化应激损伤有明显的修复功能。
3 讨 论
大量研究表明,长期高强度训练人体或实验动物会出现运动性贫血或运动性低铁状态[14]。本实验大鼠经递增负荷跑台训练后,血液红细胞指标和血浆铁状态指标都显著下降,与文献报道结果[15-16]基本相符。铁对于运动员非常重要,因为高强度运动训练需要运动员体内具有高能量代谢速率以满足大负荷运动需要,而高能量代谢速率与体内氧运输供应能力、酶的生物活性和呼吸链能量生成速率等密切相关。铁是构成血红蛋白、肌红蛋白及体内许多呼吸链能量代谢重要酶的辅助因子,高水平的能量代谢离不开铁的参与。当体内铁代谢紊乱时,如长期大运动量训练导致机体铁缺乏时,会引起体内蛋白质合成受限,血红蛋白携氧能力降低,能量代谢水平降低,进而影响运动员运动能力和运动耐力,使运动成绩下降或得不到提高。
对于运动性贫血或运动性低铁状态形成的机制目前仍不十分清楚,主要有以下几种假说对此加以解释[14]:1)剧烈运动破坏红细胞,引起溶血;2)剧烈运动使机体铁丢失增加;3)剧烈运动使机体铁吸收不良;4)剧烈运动引起铁摄入不足;5)运动引起血浆容量增加,血细胞和血浆铁被稀释;6)运动引起铁在体内的重新分布;7)运动诱导一氧化氮生成增加,反向调节机体铁状态水平[17]。但没有一种假说能够很好的解释人体和实验动物表现出来的所有现象。可能需要同时考虑采用的运动方式、运动时间、运动强度甚至动物的种类、性别、年龄等。
由于运动性贫血或运动性低铁状态严重影响运动成绩,在目前机制不明的情况下,虽然运动医学界和运动营养学界对于运动员是否需要补铁以及补铁效果如何存在很大的争论,但运动员仍然普遍采取补充铁剂的方式提高运动成绩。本实验结果显示,运动大鼠补充铁剂后,血液红细胞和铁状态指标均显著改善,表明补铁确实有一定作用。但长时间补铁必然增加体内铁负荷,增加游离铁(free iron,FI)的产生。FI参与自由基代谢,通过Fenton反应产生羟自由基(·OH)。一般认为·OH是体内所有自由基中对组织细胞毒性最强的自由基,不仅可使许多重要酶活性降低或完全失活,而且可通过脂质过氧化反应直接造成组织损伤,所以体内铁过载与许多慢性疾病,如糖尿病、心血管疾病、肿瘤、神经退行性疾病等的发病机制关系密切。MDA是脂质过氧化的代谢产物,其含量可以反映体内脂质过氧化程度。SOD是体内自由基清除系统中一种重要的抗过氧化酶,是体内抗氧化应激损伤的重要成分,其作用是催化超氧阴离子生成H2O2,阻断·OH的生成。本实验结果显示,补铁后大鼠血浆MDA水平显著高于E组,而SOD水平显著低于E组,表明补铁增大了运动大鼠脂质过氧化反应程度,降低了机体的防御功能。由于高强度训练本身就增大机体脂质过氧化反应程度,降低机体抗氧化能力,因此,运动大鼠补铁和高强度运动的双重效应可能进一步加重机体氧化应激损伤。本实验结果也显示,EI组大鼠MDA水平不仅高于E组大鼠,而且比C组大鼠更高;而SOD水平也是EI组低于C组程度,大于低于E组程度。说明补铁和高强度运动对机体氧化应激损伤有叠加效应。
蜂胶的抗氧化作用已基本得到公认。有学者认为[18],蜂胶的抗氧化机制可能是:蜂胶中的黄酮类物质可以提高机体抗氧化酶的活性,阻止自由基反应的引发;蜂胶中的黄酮类物质可以阻断自由基链式反应;蜂胶中还含有抗氧化物质如果糖、氨基酸、VE、VC和Se等;蜂胶通过螯合金属离子如游离铁离子而削弱金属离子的促氧化作用。本实验显示,大鼠服用蜂胶后,不仅EP组大鼠MDA水平显著低于E组大鼠,SOD水平显著高于E组大鼠;而且EIP组大鼠的MDA水平显著低于EI组大鼠,SOD水平显著高于EI组大鼠,表明补充蜂胶削弱了运动或/和补铁引起的氧化损伤,增强了机体抗氧化能力。有意思的是,本实验显示补充蜂胶不仅增强了机体的抗氧化能力,而且对改善运动大鼠血细胞降低和血液铁状态也有作用,与Haro等[19]的研究结果相似。本实验认为可能与以下几方面机制有关:1)蜂胶调理胃肠道功能,改善肠道血液供应,对增加机体铁吸收能力有一定作用[20];2)蜂胶能有效治疗消化道溃疡,减少运动引起的铁丢失;3)蜂胶能提高红细胞变形能力,降低其脆性,减少剧烈运动过程中红细胞的破裂[18,21];4)蜂胶成分非常复杂,其中含有的氨基酸、果糖、VC和类黄酮都有利于铁的吸收[19,22];5)蜂胶能增强机体免疫功能,加速剧烈运动后疲劳的恢复,提高机体整体代谢水平,也有利于机体对铁的摄取[23]。但具体机制还有待今后的进一步研究。
综上所述,补铁对运动性贫血或运动性低铁有改善作用,但可能增加机体的氧化应激损伤。蜂胶能有效降低运动补铁造成的氧化应激,并对改善运动性贫血或运动性低铁状态有一定作用。
[1] 钱忠明. 铁代谢: 基础与临床[M]. 北京: 科学出版社, 2000: 254-273.
[2] 钱忠明, 肖德生, 王沁. 运动性铁缺乏研究进展[J]. 中国运动医学杂志, 1998, 17(2): 151-154.
[3] BEARD J, TOBIN B. Iron status and exercise[J]. Am J Chin Nutr,2000, 72(2): 594-597.
[4] SPODARYK K. Iron metabolism in boys involved in intensive physical training[J]. Physiol Behav, 2002, 75(1/2): 201-206.
[5] GALARIS D, PANTOPOULOS K. Oxidative stress and iron homeostasis:mechanistic and health aspects[J]. Crit Rev Clin Lab Sci, 2008, 45(1):1-23.
[6] NIKOLAIDIS M G, JAMURTAS A Z. Blood as a reactive species generator and redox status regulator during exercise[J]. Arch Biochem Biophys, 2009, 490(2): 77-84.
[7] 董捷, 闫继红, 苏忆兰, 等. 蜂胶复合胶囊毒理学的动物实验观察[J].食品科学, 2005, 26(4): 247-253.
[8] 梁晓芸, 聂木海, 诸茂盛. 蜂胶胶囊对小鼠的毒性及对体内SOD酶、MDA含量的影响研究[J]. 现代预防医学, 2002, 29(4): 506-508.
[9] 曹炜, 宋纪蓉, 陈卫军. 蜂胶对脂质过氧化的抑制作用[J]. 食品科学,2004, 25(1): 34-36.
[10] 于峰, 任强. 复方蜂胶口服液抗胃溃疡作用的药效学研究[J]. 中南药学, 2008, 6(5): 539-541.
[11] 曹炜, 尉亚辉, 杨建雄, 等. 蜂胶对增强小鼠力竭游泳耐力的影响[J].食品科学, 2004, 25(11): 273-276.
[12] 赵杰修, 田野, 曹建民, 等. 长期递增负荷跑台运动和营养补充对大鼠血清造血生长因子的影响[J]. 中国运动医学杂志, 2007, 26(4): 407-410.
[13] 刘戌年, VITERI F E. 缺铁大鼠间歇或每日补铁时铁吸收与滞留的比较[J]. 实验血液学杂志, 1994, 2(2): 165-169.
[14] 刘玉倩, 钱忠明, 常彦忠, 等. 运动对铁代谢影响的研究[J]. 体育科学, 2004, 24(1): 27-30; 34.
[15] 曹建民, 田野, 赵杰修, 等. 运动性低血色素大鼠血清铁及组织铁变化规律的研究[J]. 北京体育大学学报, 2005, 28(8): 1068-1070.
[16] 薛统, 高颀. 不同营养干预对运动性贫血大鼠红细胞及铁代谢指标的影响[J]. 北京体育大学学报, 2009, 32(8): 62-64.
[17] XIAO Desheng, QIAN Zhongming. Plasma nitric oxide and iron concentrations in exercised rats are negatively correlated[J]. Mol Cell Biochem,2000, 208(1/2): 163-166.
[18] 韩小燕, 刘春雨, 于洋. 蜂胶对小鼠红细胞酶活性及血浆自由基代谢的影响[J]. 中国食物与营养, 2009(5): 59-60.
[19] HARO A, LOPEZ-ALIAGA I, LISBONA F, et al. Beneficial effect of pollen and/or propolis on the metabolism of iron, calcium, phosphorus,and magnesium in rats with nutritional ferropenic anemia[J]. J Agric Food Chem, 2000, 48(11): 5715-5722.
[20] 姚树桐, 桑慧, 王家富, 等. 蜂胶水提液改善小肠缺血-再灌注大鼠肠系膜微循环[J]. 中国微循环, 2009, 13(6): 478-480; 504.
[21] 曹炜尉, 亚辉, 陈锦屏. 蜂胶对氧自由基致鼠红细胞膜损伤的保护作用[J]. 食品科学, 2002, 23(5): 118-120.
[22] AGUILO A, TAULER P, FUENTESPINA E, et al. Antioxidant diet supplementation influences blood iron status in endurance athletes[J].Int J Sport Nutr Exerc Metab, 2004, 14(2): 147-160.
[23] 徐德洲, 吕中明, 陈新霞. 蜂胶增强小鼠免疫功能的实验研究[J]. 实用预防医学, 2009, 16(6): 1939-1940.
Effect of Propolis and Iron Supplements on Iron Status in Blood of Exercise Rats and Antioxidant Function of Propolis
CHE Li-long1,LIU Jun2,LIU Xian-dong2,SHEN Min-jie2,GU Xiao-ming2,XIE Yang2,XU Hua-xi1,XIAO De-sheng1
(1. School of Medical Science and Laboratory Medicine, Jiangsu University, Zhenjiang 212013, China;2. School of Clinical Medicine, Jiangsu University, Zhenjiang 212001, China)
Objective: To explore the effects of propolis and iron supplements on iron status and free radical content in blood of exercise rats, and to investigate the antioxidative protection of propolis on oxidative damage derived from exercise and/or iron supplement. Methods: Forty Sprague-Dawley male rats aged 3 months were randomly divided into 5 groups of 8 each: control group (C group), exercise group (E group), exercise plus iron supplement group (EI group), exercise plus propolis supplement group (EP group) and exercise plus supplement with iron and propolis group (EIP group). The rats were subjected to treadmill training with an incremental loading for 6 weeks. Red blood cell indices including red blood cell count (RBC) and hemoglobin (Hb)and hematocrit (Hct), plasma iron status including plasma iron (PI) and total iron binding capacity, and serum MDA and SOD contents of rats were measured. Results: Compared with C group, a significantly lower level of red blood cell indices, iron status and SOD, and an obvious higher level of MDA were observed in E group. Compared with E group, a significantly higher level of red blood cell indices and iron status was observed in rats from EI, EP and EIP groups; meanwhile, MDA content in rats from EI group was higher than that in E group; SOD content in rats from EI group was lower than that in E group. MDA content of rats in EP and EIP groups was lower than that in E group and SOD content of rats in EP and EIP groups was higher than that in E group. MDA content in rats from EIP group was lower than that in EI group and SOD content in rats from EIP group were higher than that in EI group. No significant difference between EP and EIP groups was also observed. Conclusion: Iron supplement can increase the risk of oxidative stress in spite of improving anemia symptom and lower iron status of exercise rats.Propolis can effectively improve the ability of organism to scavenge free radicals, reduce lipid peroxidation, and enhanceantioxidant function. Therefore, propolis can improve the exercise-induced or iron-deficient anemia.
propolis;iron supplement;exercise rats;iron status;antioxidation
S896.6;TS201.4
A
1002-6630(2011)05-0244-05
2010-06-14
国家自然科学基金项目(30270639);江苏大学大学生科技创新项目(1201390005;1201390009)
车力龙(1963—),男,副教授,博士,研究方向为食品营养与安全。E-mail:cll8880@163.com
