燕麦发芽过程中酚类物质的变化
2011-10-18付晓燕胡崇琳田斌强孙智达谢笔钧
付晓燕,胡崇琳,田斌强,孙智达*,谢笔钧
(华中农业大学食品科学技术学院,湖北 武汉 430070)
燕麦发芽过程中酚类物质的变化
付晓燕,胡崇琳,田斌强,孙智达*,谢笔钧
(华中农业大学食品科学技术学院,湖北 武汉 430070)
对燕麦种子进行发芽实验,并分析酚类物质在发芽过程中的含量、组成及抗氧化活性变化。结果表明:燕麦发芽过程中,酚类物质的含量明显提高,且芽和根中总酚的相对含量高于籽粒;发芽前后不同部位多酚的组成不同,从而导致其抗氧化活性存在差异。抗氧化实验结果显示:原样、6d籽粒、6d芽和6d根的多酚提取物具有较强的还原力(EC50值分别为86.47、61.96、98.54μg/mL和51.98μg/mL)和清除DPPH自由基(IC50值分别为26.90、15.43、30.71μg/mL和21.30μg/mL)及NO2-( IC50值分别为0.653、0.441、1.353mg/mL和0.227mg/mL)的能力,且发芽可以作为一种提高燕麦利用价值的有效手段。
燕麦;发芽;多酚;高效液相色谱;抗氧化活性
燕麦被认为是谷类食品中最好的全价营养食品之一,含有大量的可溶性膳食纤维、丰富的优质蛋白以及维生素和必需脂肪酸,具有调节血脂、血糖,改善肠道功能等生理功效。抗氧化性也是燕麦诸多生理功能中较为突出的一个,燕麦中主要的抗氧化成分是酚类物质[1]。研究表明,燕麦中的酚类物质主要包括各种酚酸、燕麦蒽酰胺和黄酮类化合物等[2]。目前,在燕麦中已发现的酚酸有咖啡酸、阿魏酸、对香豆酸、对羟基苯甲酸、4-羟基苯乙酸、水杨酸、芥子酸、没食子酸、原儿茶酸、丁香酸、香草酸等;燕麦蒽酰胺是一系列羟基肉桂酸及其衍生物和邻氨基苯甲酸及其衍生物通过酰胺键(HNCO—)相连而成的物质,是燕麦中特有的多酚类物质;燕麦中黄酮类化合物含量较少[3-4]。
种子萌发是高等植物生命活动最强烈的一个时期,涉及到一系列形态和生理生化的变化。营养成分含量的增加和生物利用率的提高,抗营养因子的不利因素被减弱或消除这些现象在开发芽类食品方面受到了人们的关注[5],目前也已取得了不少成果。对于燕麦发芽的研究焦点主要集中在发芽过程中三大营养素及其相关酶活性的变化方面[6],对酚类物质在发芽过程中的一系列变化研究相对较少。本实验对燕麦发芽过程中酚类物质的含量变化、组成变化以及抗氧化活性变化进行研究,旨在为燕麦的深度开发和利用提供依据。
1 材料与方法
1.1 材料与试剂
晋燕八号裸燕麦由山西省农科院高寒区作物研究所提供。
DPPH自由基 美国Sigma公司;AB-8大孔吸附树脂 南开大学化工厂;乙醇、没食子酸、碳酸钠、铁氰化钾、三氯化铁、三氯乙酸、亚硝酸钠、对氨基苯甲酸、盐酸萘乙二胺等(均为分析纯) 国药集团化学试剂有限公司;甲醇、乙腈等(均为色谱纯) 美国Tedia公司;Folin-Ciocalteau试剂。
1.2 仪器与设备
250B生化培养箱 江苏金坛市宏华仪器厂;SHZ-82A恒温水浴振荡器 国华仪器厂;RE111型旋转蒸发仪 瑞士Buchi公司;755B分光光度计 上海精密科学仪器厂;TDL-5离心机 上海安亭科学仪器厂;FD-1-50冷冻干燥机 北京博医康实验仪器公司;LC-20AT高效液相色谱仪(SPD-M20A二极管阵列检测器、SIL-20A自动进样器、CTO-20A柱温箱) 日本岛津公司。
1.3 方法
1.3.1 燕麦种子发芽实验
将燕麦种子用2g/100mL次氯酸钠溶液于室温浸泡15min,洗去残余的次氯酸钠溶液,用蒸馏水浸渍种子于18℃生化培养箱中浸泡16~18h,取出部分种子作为浸泡样,将剩余种子沥干后置于自制发芽盘中于18℃培养箱中连续发芽8d,培养箱保持湿度在95%以上。发芽的燕麦种子每隔24h取一次样品,分为籽粒、芽和根三部分,所取样品于冷冻干燥机中干燥36h以待后续实验。
1.3.2 燕麦多酚的提取
准确称取一定量的不同发芽时间的样品(分别为原样、浸泡、发芽1~8d)于带塞三角瓶中,按料液比1:40(m/V)加入体积分数80%的乙醇溶液,置于水浴摇床中在50℃提取2h,提取结束后抽滤,将提取液于旋转蒸发仪上回收乙醇,浓缩样品,样品定容后以10000r/min离心10min,待测。
1.3.3 总酚含量的测定
采用 Folin-Ciocalteau 法[7]。
1.3.3.1 标准曲线的制作
分别吸取100、200、300、400、500mg/L没食子酸标准溶液0.1mL,依次加入6mL蒸馏水,0.5mL Folin-Ciocalteau试剂,混匀后加入20g/100mL的Na2CO3溶液1.5mL,充分混匀,定容至10mL,在室温静置1h后于765nm波长处测定其吸光度,以溶液质量浓度为横坐标,吸光度为纵坐标,得回归方程为:A=0.0011ρ+0.008,R2=0.9999。
1.3.3.2 样品的测定
准确吸取待测液0.1mL,按照标准曲线步骤操作,根据标准曲线计算待测液中多酚的没食子酸当量,并计算不同发芽时间的燕麦总酚相对含量和绝对含量,公式如下:

1.3.4 燕麦多酚的纯化
对未发芽燕麦种子、发芽6d的燕麦籽粒、芽和根,按1.3.2节方法提取其多酚,50℃减压回收乙醇后,剩余水相上AB-8大孔吸附树脂,先用10倍量蒸馏水洗脱除糖,再用体积分数70%的乙醇洗脱,收集洗脱液,将洗脱液于50℃真空浓缩,冷冻干燥,得燕麦多酚初步纯化物。
1.3.5 高效液相色谱分析条件
参考Bratt 等[8]的方法并略作改进。色谱柱:ODS-2 Hypersil(150mm×4.6mm,5μm);流动相:A相:pH2.8磷酸盐缓冲液(含5%乙腈),B相:乙腈;流速:1mL/min;检测波长:340nm;柱温:30℃;进样量:10μL。实验中采用二元线性梯度洗脱,洗脱梯度:0~60min,1%~40% B;60~70 min,40%~1% B。
1.3.6 清除DPPH自由基能力的测定
采用Fagerlund等[9]报道的方法,取不同质量浓度的样品溶液2.0mL和2×10-4mol/L的DPPH乙醇溶液2.0mL,加入同一具塞试管中,摇匀,在室温避光反应30min后于517nm波长处测其吸光度,计算燕麦多酚对DPPH自由基的清除率,公式如下:
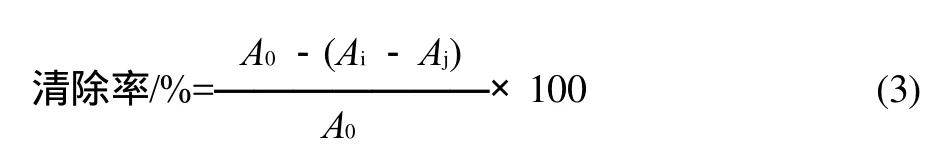
式中:A0为对照组吸光度;Ai为样品组吸光度;Aj为空白组吸光度。
1.3.7 还原能力的测定
采用Liu等[10]报道的方法,取不同质量浓度的样品溶液1.0mL,加入0.2mol/L、pH6.6的磷酸钠缓冲液1.0mL及1g/100mL的铁氰化钾溶液1.0mL,于50℃水浴反应20min后急速冷却,加入10g/100mL的三氯乙酸溶液1.0mL,3000r/min离心10min,取上清液2.5mL,加入蒸馏水2.0mL及0.1g/100mL三氯化铁溶液0.5mL,混合均匀,10min后于700nm波长处测定其吸光度,吸光度越大表示还原能力越强。
1.3.8 清除NO2-能力的测定
采用郭艳华等[11]报道的方法,取不同质量浓度的样品溶液1.0mL,加入pH3.0的柠檬酸钠-盐酸缓冲液2.5mL,再加入100mg/kg的NaNO2溶液0.5mL,用蒸馏水定容到5.0mL,37℃恒温1h。然后取反应液1.0mL,加入0.4g/100mL的对氨基苯磺酸溶液2.0mL与0.2g/100mL的N-1-萘乙二胺盐酸盐溶液2.0mL,摇匀放置15min后,于540nm波长处测其吸光度,根据以下公式计对NO2-的清除率。
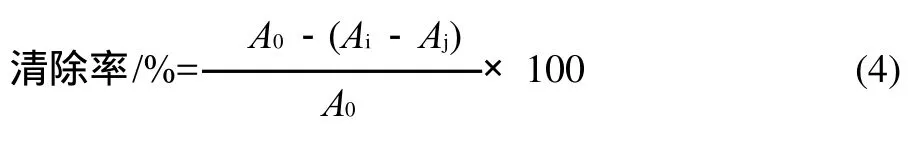
式中:A0为对照组吸光度;Ai为样品组吸光度;Aj为空白组吸光度。
2 结果与分析
2.1 燕麦发芽过程中总酚含量的变化
由图1a可知,在发芽初期,籽粒中总酚相对含量略微下降,随着发芽时间的延长,总酚含量呈上升趋势,发芽6d以后,曲线的增幅逐渐变缓。根据Skoglund等[12]的报道,这是由于酶的作用引起的,在发芽初期的浸泡过程中,多酚氧化酶(PO)的活性处于较高水平,导致部分多酚被氧化分解,随着发芽时间的延长,多酚氧化酶活性下降,燕麦蒽酰胺合成酶(HHT)活性提高,使得酚类物质大量合成。在发芽8d的过程中,籽粒中总酚相对含量由0.802mg/g上升至1.725mg/g。
由于芽和根在发芽初期很难采集,故只得到发芽5~8d的数据。由图1c可知,在发芽5~8d的过程中,根中总酚含量呈上升趋势,而芽中总酚含量变化不明显。当发芽8d时芽和根中总酚相对含量分别为5.445mg/g和4.758mg/g,远高于籽粒,这可能是由于芽和根中相关酶的活性较高所致。
相对含量的高低只能反映单位质量样品中总酚含量的不同,而随着发芽时间的延长,芽和根的长度不断增加,所占整体的比重逐渐提高,籽粒中的营养物质不断被输出,所占比重逐渐下降,因此就绝对含量而言,由图1b、1d可知,当发芽到达7d时,籽粒中总酚含量开始下降,而芽和根中总酚含量始终呈上升趋势。在整个发芽过程中,燕麦整体的总酚含量约提高了2倍。
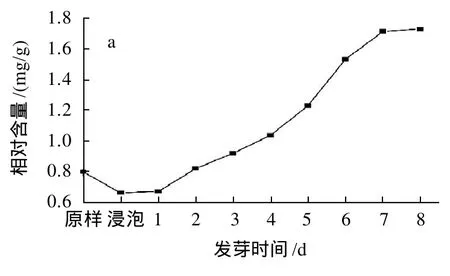
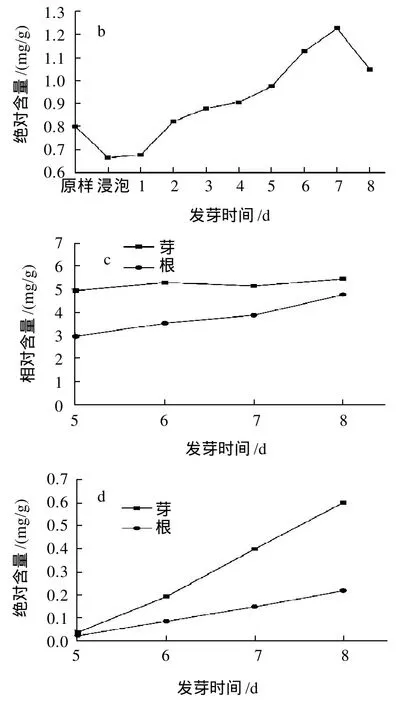
图1 燕麦发芽过程中总酚相对含量和绝对含量的变化Fig.1 Changes in relative and absolute total phenol contents of oat buds, roots and grains during germination
2.2 发芽前后燕麦多酚组成的变化
由于发芽6d以后燕麦整体的总酚含量上升趋势开始变缓,故选择发芽6d的样品作为研究对象。由图2可知,经过AB-8大孔树脂纯化后的原样、6d籽粒、芽和根的提取物,其多酚组成有很大差异。由图2a、2b可以看出,在籽粒提取物中,峰1~5是其主要组分,相同质量浓度的提取物,发芽后组分2、3、4和5的含量明显上升,尤其是组分4和5的相对含量变化最为显著,组分1的含量略微下降。芽和根的提取物中多酚组成相对简单,由图2c、2d可以看出,其主要组分分别有3种,且根提取物中组分1和2同时也是发芽后籽粒提取物中含量明显上升的组分,而这两种组分在原样和芽中的含量较低。
由上述主要组分的紫外光谱图可知(光谱图略),其最大吸收波长大致在340~350nm,与Jonsson[13]报道的燕麦蒽酰胺的最大吸收波长基本吻合,初步判断这些组分可能正是燕麦中所特有的酚类化合物——燕麦蒽酰胺。但由于缺乏必要的标准物质,对其种类的鉴定还有待进一步研究。
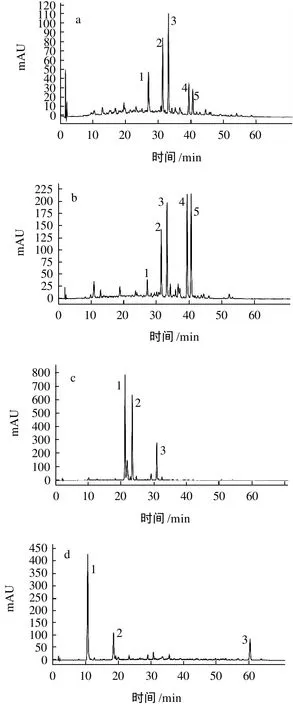
图2 燕麦多酚高效液相色谱图Fig.2 HPLC profiles of phenolic compounds from ungerminated oat seeds, 6-day germinated oat grains, 6-day germinated oat buds and 6-day germinated oat roots
2.3 发芽前后燕麦多酚抗氧化活性的变化
物质抗氧化活性的大小是其各组分综合作用的结果,不同组分对其活性的贡献并不相同。由于发芽前后不同部位多酚的组成不同,必然导致它们的抗氧化活性存在某些差异。本实验采用清除DPPH自由基、还原Fe3+和清除NO2三种抗氧化体系对发芽前后燕麦多酚的抗氧化活性进行评价。
2.3.1 清除DPPH自由基的能力
DPPH(二苯三硝基苯肼)自由基是一种有机自由基,具有稳定性好、操作简便等优点,近年来被广泛应用于评价物质的抗氧化活性或筛选自由基清除剂[14]。本实验采用茶多酚和VC作为阳性对照来衡量发芽前后燕麦多酚提取物的抗氧化活性。由图3可以看出,随着试样质量浓度提高,其清除DPPH自由基的能力逐渐增强,当清除率达到一定程度(约80%)后,曲线趋于平缓。根据它们的曲线方程计算各自的半抑制质量浓度(IC50),分别为原样26.90μg/mL、6d籽粒15.43μg/mL、6d芽30.71μg/mL、6d根21.30μg/mL,而茶多酚和VC的IC50分别为2.42μg/mL和4.96μg/mL。它们对DPPH自由基清除能力的大小顺序为茶多酚>VC>6d籽粒>6d根>原样>6d芽。可以看出,虽然样品组对DPPH自由基的清除能力均低于对照组,但发芽后燕麦多酚对DPPH自由基的清除能力却较发芽前有所提高。芽中虽然总酚相对含量最高,但其清除DPPH自由基的能力最差,这可能与不同部位提取物中多酚的组成差异有关。

图3 发芽前后燕麦多酚清除DPPH自由基能力的比较Fig.3 DPPH free radical scavenging rates of phenolic compounds from ungerminated oat seeds, 6-day germinated oat grains, 6-day germinated oat buds and 6-day germinated oat roots at various concentrations in comparison with tea phenols and vitamin C
2.3.2 还原能力
还原力是表示抗氧化物质提供电子能力的重要指标,抗氧化剂通过自身的还原作用给出电子而使自由基变为稳定的分子,从而失去活性[15]。研究表明物质的还原力与其抗氧化性之间存在联系,还原力越强,抗氧化性越强,因此可以通过测定还原力来说明抗氧化活性的大小。由图4可知,随着试样质量浓度提高,其吸光度增大,且吸光度值与质量浓度之间呈良好的线性关系。根据它们的线性回归方程求出吸光度值达0.5时所需试样的质量浓度(EC50),分别为原样86.47μg/mL、6d籽粒61.96μg/mL、6d芽98.54μg/mL、6d根51.98μg/mL、茶多酚13.42μg/mL、VC 17.12μg/mL。它们的还原力大小顺序为茶多酚>VC>6d根>6d籽粒>原样>6d芽。与清除DPPH自由基类似,虽然样品组的还原力均低于对照组,但也显示出一定的还原能力,且发芽后根和籽粒的还原力较原样有所提高,芽的还原力较差。说明在此条件下,芽中酚类物质提供电子的能力要低于根和籽粒中的酚类物质。

图4 发芽前后燕麦多酚还原能力的比较Fig.4 Reducing powers of phenolic compounds from ungerminated oat seeds, 6-day germinated oat grains, 6-day germinated oat buds and 6-day germinated oat roots at various concentrations in comparison with tea phenols and vitamin C
2.3.3 清除NO2的能力
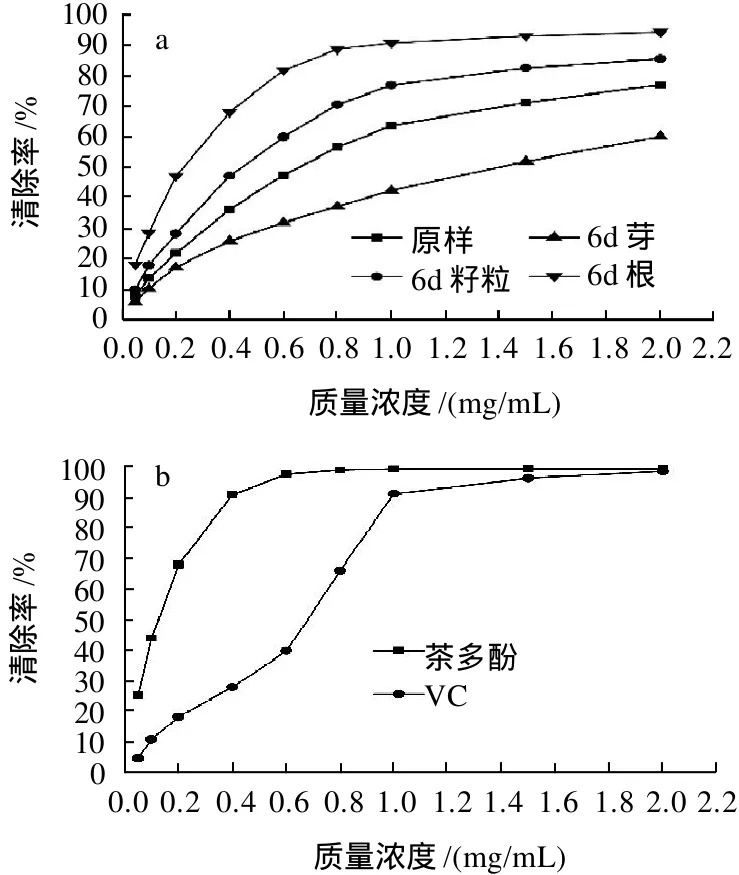
图5 发芽前后燕麦多酚清除NO2能力的比较Fig.5 Nitrate scavenging rates of phenolic compounds from ungerminated oat seeds, 6-day germinated oat grains, 6-day germinated oat buds and 6-day germinated oat roots at various concentrations in comparison with tea phenols and vitamin
亚硝酸盐与食物中的仲胺、叔胺等共存时易形成强致癌性物质亚硝胺。亚硝酸盐摄入过多可使血液里的Fe2+氧化,失去携氧能力,出现中毒现象。亚硝酸根在体内极易转变为氮自由基,参与氧化反应,破坏细胞、组织结构[16]。使用抗氧化剂能够能够清除NO2,从而成为防止亚硝胺致癌的有效途径。
发芽前后燕麦多酚对NO2的清除效果见图5,可以看出在实验质量浓度范围内,试样对NO2都具有一定的清除作用,且呈一定的量效关系。由曲线方程推算各自的IC50,分别为:原样0.653mg/mL、6d籽粒0.441mg/mL、6d芽1.353mg/mL、6d根0.227mg/mL、茶多酚0.124mg/mL、VC 0.683mg/mL。它们对NO2清除能力的大小顺序为茶多酚>6d根>6d籽粒>原样>VC>6d芽。可以看出,茶多酚的清除能力依然最好,而原样、6d籽粒与6d根中的多酚清除能力都比VC要好,且发芽后根和籽粒的清除能力明显大于原样,说明发芽能在一定程度上提高燕麦的防癌功效。
3 结 论
综上所述,燕麦发芽过程中酚类物质的含量、组成和抗氧化活性等都发生了明显变化。在发芽8d的过程中总酚含量约提高2倍,且芽和根中总酚相对含量高于籽粒。发芽可以作为一种提高燕麦酚类物质含量的有效手段,具有广阔的应用前景。
通过测定燕麦多酚清除DPPH自由基的能力、还原能力和清除NO2的能力发现,发芽后燕麦籽粒和根的提取物表现出较强的抗氧化活性,而芽提取物的抗氧化活性相对较弱。原样、6d籽粒、6d芽和6d根清除DPPH自由基的IC50值分别为26.90、15.43、30.71μg/mL和21.30μg/mL;还原力EC50值分别为86.47、61.96、98.54μg/mL和51.98μg/mL;清除NO2的IC50值分别为0.653、0.441、1.353mg/mL和0.227mg/mL。这种差异与不同部位多酚的组成密切相关,籽粒和根中共同含有两种主要组分,而这两种组分在原样和芽中的含量较低,因此初步推测这两种组分可能是关键的活性物质。由于缺乏必要的标准物质,对于发芽前后燕麦多酚种类的鉴定还有待进一步研究。
[1] 刘清, 姚惠源. 燕麦酚类抗氧化成分研究进展[J]. 粮食与油脂, 2004(9): 7-9.
[2] SKOGLUND M. Phenolic compounds in oats: effects of steeping, germination and related enzymes[D]. Uppsala: Swedish University of Agricultural Sciences, 2008.
[3] PETERSON D M. Oat antioxidants[J]. Journal of Cereal Science, 2001,33(2): 115-129.
[4] DIMBERG L H, THEANDER O, LINGNERT H. Avenanthramides: A group of phenolic antioxidants in oats[J]. American Association ofCereal Chemists, 1993, 70(6): 637-640.
[5] TIAN Binqiang, XIE Bijun, SHI J, et al. Physicochemical changes of oat seeds during germination[J]. Food Chemistry, 2010, 119(3): 1195-1200.
[6] WILHELMSON A, OKSMAN-CALDENTEY K M, LAITILA A, et al.Development of a germination process for producing high β-glucan,whole grain food ingredients from oat[J]. Cereal Chem, 2001, 78(6):715-720.
[7] PETERSON D M, EMMONS C L, HIBBS A H. Phenolic antioxidants and antioxidant activity in pearling fractions of oat groats[J]. Journal of Cereal Science, 2001, 33(1): 97-103.
[8] BRATT K, SUNNERHEIM K, BRYNGELSSON S, et al.Avenanthramides in oats and structure-antioxidant activity relationships[J]. Agriculture and Food Science, 2003, 51(3): 594-600.
[9] FAGERLUND A, SUNNERHEIM K, DIMBERG L H. Radical-scavenging and antioxidant activity of avenanthramides[J]. Food Chemistry,2009, 113(2): 550-556.
[10] LIU Qing, YAO Huiyuan. Antioxidant activities of barley seeds extracts[J]. Food Chemistry, 2007, 102(3): 732-737.
[11] 郭艳华, 胡思前. 荸荠皮提取物对亚硝化反应抑制作用研究[J]. 食品与机械, 2008, 24(3): 64-66.
[12] SKOGLUND M, PETERSON D M, ANDERSSON R, et al.Avenanthramide content and related enzyme activities in oats as affected by steeping and germination[J]. Journal of Cereal Science, 2008, 48(2):294-303.
[13] JONSSON K. Isolation and identification of three possible avenanthramide from oats that increase during germination[D]. Uppsala: Swedish University of Agricultural Sciences, 2006.
[14] 张立华, 张元湖, 安春燕, 等. 石榴皮提取物的大孔树脂纯化及其抗氧化性能[J]. 农业工程学报, 2009, 25(1): 142-147.
[15] 杨小兰, 田艳花, 师成滨, 等. 啤酒花多酚的提取工艺及抗氧化活性的研究[J]. 食品科学, 2006, 27(10): 297-302.
[16] 艾志录, 王育红, 潘治利. 苹果渣中多酚物质的抗氧化活性研究[J].食品科学, 2006, 27(12): 160-163.
Changes in Phenols during Oat Germination
FU Xiao-yan,HU Chong-lin,TIAN Bin-qiang,SUN Zhi-da*,XIE Bi-jun
(College of Food Science and Technology, Huazhong Agricultural University, Wuhan 430070, China)
Changes in the content, and composition and antioxidant activity of phenolic compounds during oat germination were analyzed. The results showed that total phenol content in oat went up notably with the extension of germination, and oat buds and roots had higher total phenol content than oat grains, which resulted in a difference in antioxidant activity. Ungerminated oat seeds, 6-day germinated oat grains, 6-day germinated oat buds and 6-day germinated oat roots had strong reducing power, with EC50 (median effective concentration) of 86.47, 61.96, 98.54μg/mL and 51.98μg/mL, respectively, and strong abilities to scavenge DPPH free radicals, with IC50 (median inhibitory concentration) of 26.90, 15.43, 30.71μg/mL and 21.30μg/mL and nitrite, with IC50 of 0.653, 0.441, 1.353 mg/mL and 0.227 mg/mL. Therefore, germination is an effective method to elevate the utilization value of oat.
oat;germination;phonols;high performance liquid chromatography (HPLC);antioxidant activity
S512.6
A
1002-6630(2011)05-0137-06
2010-07-22
“十一五”国家科技支撑计划项目(2006BAD27B09)
付晓燕(1985—),女,硕士研究生,研究方向为天然产物化学。E-mail:fuxiaoyan001@163.com
*通信作者: 孙智达(1963—),男,教授,博士,研究方向为天然产物化学。E-mail:sunzhida@mail.hzau.edu.cn
